荸薺組培苗在間歇浸沒式生物反應器(TIBs)中的高效增殖技術
高美萍 林志城 張馳 江文 董偉清 歐昆鵬 桂杰 閉志強 何芳練 陳麗娟


摘要:【目的】探討間歇浸沒式生物反應器(TIBs)對荸薺(Eleocharis dulcis)組培苗快速繁殖的效果,為提高荸薺組培苗繁殖效率及其工廠化生產提供技術支撐。【方法】以初代誘導培養獲得的桂蹄2號荸薺組培苗為外植體,利用TIBs系統進行組培快繁,研究荸薺組培苗不同繼代代數、接種密度、激素組合及反應器間歇浸沒頻率等因子對荸薺組培增殖的影響。【結果】經初代誘導培養的第4、5、6代繼代材料增殖倍數較高,其中第6代繼代苗增殖倍數最高,達31.1倍,到第7代后隨繼代代數的增加增殖倍數逐漸降低。當接種密度大于15叢/瓶時,外植體污染率達16.0%;當接種密度低于10叢/瓶時,外植體的污染率為0。低于10 min/6 h的間歇浸沒頻率有利于降低污染率,在6 h內低于15 min的浸沒時間有利于降低玻璃化苗率;當激素組合為3.0 mg/L 6-BA+0.01 mg/L NAA時,組培苗增殖倍數達38.5倍,且組培苗生長正常。【結論】在TIBs系統中,采用經初代誘導培養的第5代荸薺繼代組培苗,增殖培養基為MS+3.0 mg/L 6-BA+0.01 mg/L NAA+30.0 g/L蔗糖,pH 6.0,接種密度10叢/瓶,反應器間歇浸沒頻率為10 min/6 h,可獲得較好的培養效果。
關鍵詞: 荸薺;組培苗;TIBs;高效增殖
中圖分類號: S645.3 文獻標志碼:A 文章編號:2095-1191(2016)10-1653-05
0 引言
【研究意義】荸薺(Eleocharis dulcis)屬莎草科荸薺屬,又叫馬蹄、烏芋、通天草等,是我國原產的一種多年水生草本植物,其味甜多汁,肉質松脆爽口消渣,是一種藥食兼用的果蔬。荸薺不僅是廣西名特優農產品之一,還是我國傳統的重要出口創匯產品之一。傳統荸薺組織培養主要采用半固體培養,該方法在組織培養操作過程中需要大量的手工勞動,增殖率較低,是一種勞動密集型技術。因此,加強對荸薺組培快繁技術的研究,對于解決市場需求、實現荸薺組培苗工廠化生產具有重要意義。【前人研究進展】間歇浸沒式生物反應系統是近20年來發明的一種用于植物組織快繁生產的系統,最先由Teisson改進命名。該培養方式結合固體培養和液體培養的優點而舍棄其缺點,使培養材料達到最大增殖數(Alverd et al.,1993;Etienne and Berthouly,2002;Be and Debergh,2006;Benlal et al.,2008)。目前,國外利用間歇浸沒式生物反應器(TIBs)進行組培快繁研究的植物品種較多,國內利用該套系統進行研究的作物品種也在不斷增多,其中在甘蔗上的研究報道較多。Lorenzo等(2001)利用TIBs系統對一個古巴甘蔗品種進行組織培養,其一代增殖可達40倍,獲得的組培苗在田間的生長情況也較傳統方法獲得的組培苗適應性好。Angela等(2009)將幾個澳大利亞甘蔗品種在不同生物反應器中進行試驗比較,發現利用TIBs系統的甘蔗組培苗一代增殖率超過20倍。在國內,部分學者采用TIBs系統對甘蔗和香蕉進行組培快繁研究。劉麗敏等(2009)利用TIBs系統對ROC16和ROC22兩個甘蔗品種進行組培快繁研究,發現ROC16一代增殖率達40倍,ROC22一代增殖率為30倍。楊柳等(2011)以新臺農22號莖尖脫毒組培苗為材料,研究了不同激素組合、間歇浸沒頻率、接種密度等因素對其在TIBs系統中增殖效果的影響,結果表明,該系統可使甘蔗組培一代增殖40倍以上。李鐵軍等(2012)以篤斯越橘(Vaccinium uliginosum)叢生苗為材料,研究篤斯越橘在TIBs中的增殖效果,結果發現接種密度對篤斯越橘叢生苗增殖生長有重要影響,接種密度是重要的調控參數之一。【本研究切入點】目前,國內利用TIBs系統進行組培快繁的植物品種主要有甘蔗和香蕉,未見應用于水生蔬菜荸薺的相關報道。【擬解決的關鍵問題】研究荸薺組培苗不同繼代代數、接種密度、激素組合及反應器間歇浸沒頻率等因子對荸薺組培增殖的效果,優化TIBs系統培養荸薺組培苗的增殖技術,為提高荸薺組培苗繁殖效率及其工廠化生產提供技術支撐。
1 材料與方法
1. 1 試驗材料
以廣西農業科學院生物技術研究所提供的經初代誘導培養的健康荸薺組培苗(桂蹄2號)為試驗材料,誘導培養基為MS+1.0 mg/L BA+0.1 mg/L NAA+ 30.0 g/L蔗糖。TIBs系統根據Lorenzo等(1998)的設計思路建立。TIBs系統中培養瓶和儲液瓶分別為2.5和3.0 L的廣口無色玻璃瓶和三角瓶,瓶高分別為26和30 cm,直徑為14和15 cm。儲液瓶中液體培養基體積為1.0 L。
1. 2 試驗方法
1. 2. 1 不同代數繼代組培苗對TIBs系統組培的影響
分別以繼代培養2~8代的組培苗為試驗材料,增殖培養基為傳統荸薺增殖培養基,即MS+6-BA 1.5 mg/L+ NAA 0.01 mg/L+30.0 g/L蔗糖,pH 5.8~6.0,TIBs系統間歇浸沒頻率為10 min/3 h,接種密度為10叢/L(每15顆芽為1叢)。
1. 2. 2 不同接種密度在TIBs系統中的增殖效果 在試驗1.2.1基礎上,以第5代繼代組培苗為材料,培養基配方及TIBs條件同1.2.1,組培苗接種密度設置為5、10、15和20叢/L。
1. 2. 3 不同間歇浸沒頻率對TIBs系統組培的影響
在試驗1.2.2基礎上以第5代繼代組培苗為試驗材料,增殖培養基配方同上,接種密度10叢/L,TIBs系統間歇浸沒頻率設為10 min/3 h、10 min/6 h、10 min/12 h和10 min/24 h,共4個處理。
1. 2. 4 不同浸沒時間對TIBs系統組培的影響 在試驗1.2.3基礎上以第5代繼代組培苗為試驗材料,增殖培養基配方同上,接種密度10叢/L,TIBs系統設組培苗在培養液中浸沒時間為5、10、15、20和30 min/6 h,共5個處理。
1. 2. 5 不同激素組合對TIBs系統組培的影響 在試驗1.2.4基礎上以第5代繼代組培苗為試驗材料,接種密度為10叢/L,間歇浸沒頻率為10 min/6 h,6-BA濃度梯度設為1.0、1.5、2.0、3.0和4.0 mg/L,NAA濃度設為0.01和0.05 mg/L,共10個處理。
以上各試驗培養條件:光照強度1500 lx,培養溫度(28±2)℃,光照16 h/d,黑暗8 h/d。增殖培養40 d。試驗均設每處理3套TIBs系統,重復2次,取平均值。
1. 3 統計分析
接種后每周觀察記錄1次生長狀況,40 d后計算每瓶組培苗叢數,數據采用SPSS 18.0的SNK法進行差異顯著性分析。
2 結果與分析
2. 1 不同代數荸薺繼代組培苗在TIBs系統中的增殖效果
將經初代誘導培養的第2~8代荸薺組培苗轉接到TIBs系統中培養,增殖效果見表1。經過40 d培養后,第4、5、6代繼代組培苗增殖倍數較高,其中第6代繼代組培苗增殖倍數最高,為31.1倍;到第7代增殖倍數開始下降,第8代增殖倍數降到最低,為22.6倍。隨著繼代苗代數的增加,組培苗增殖的時間推遲,第4、5、6、7代差異不顯著(P>0.05,下同),均在6.0 d左右開始增殖。因此,為了保證材料的充足且不影響增殖倍數,利用TIBs系統進行荸薺組培苗快繁以第5代材料最佳。
2. 2 不同接種密度在TIBs系統中的增殖效果
選用第5代繼代組培苗,研究不同接種密度對荸薺組培快繁效果的影響,結果見表2。隨著接種密度的增加,增殖芽數也逐漸增多,但培養基污染風險加大,當接種密度大于15叢/瓶時污染率達16.0%,而低于10叢/瓶的接種密度外植體的污染率得到有效控制。因此,為達到低污染高增值的培養效果,選擇10叢/瓶用于后續試驗研究。
2. 3 不同間歇浸沒頻率在TIBs系統中的增殖效果
間歇浸沒頻率是TIBs系統的重要調控因素之一。選用第5代繼代組培苗、接種密度10叢/瓶,研究間歇浸沒頻率對荸薺組培快繁效果的影響,結果見表3。由表3可知,隨著間歇浸沒頻率的延長,組培苗的污染率上升,當間歇浸沒頻率達10 min/12 h后污染率明顯增加,植株的生長勢也較差;增殖倍數隨著間歇浸沒頻率的延長而降低,當間歇浸沒頻率為10 min/3 h和10 min/24 h時,芽增殖倍數分別達到最高32.1倍及最低24.4倍;當間歇浸沒頻率為10 min/3 h和10 min/6 h時,芽增殖倍數均在30.0倍以上。由此可見,短時間的間歇浸沒有利于荸薺植株的生長,提高荸薺組培苗的增殖率和降低污染率。本研究適宜的間歇浸沒頻率為10 min/6 h以下。
2. 4 不同浸沒時間在TIBs系統中的增殖效果
由表4可知,隨著浸沒時間的增加,組培苗芽的增殖倍數逐漸增加,其中,每6 h浸沒30 min的增殖倍數最高,為34.8倍。SNK法分析結果表明,浸沒20 min與浸沒30 min的增殖倍數間差異不顯著,浸沒5、10、15 min與浸沒20、30 min的增殖倍數間差異顯著(P<0.05,下同);延長浸沒時間對組培苗生長勢有促進作用;當浸沒時間超過20 min 時組培苗出現玻璃化苗,玻璃化率為27.0%,浸沒時間為30 min時玻璃化率為34.0%(表4)。為了控制組培苗的變異率,生產上在6 h內采用15 min以下的浸沒時間有利于組培苗的正常生長。
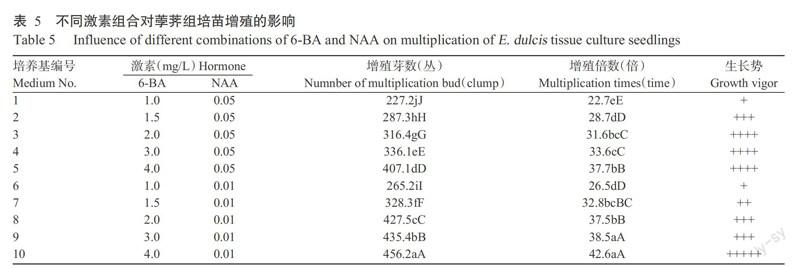
2. 5 不同激素組合對荸薺組培苗增殖的影響
在上述試驗結果的基礎上,將組培誘導的第5代繼代苗、接種密度10叢/瓶、間歇浸沒頻率采用10 min/6 h,轉接至含不同濃度6-BA和NAA組合的增殖培養基中培養。培養6 d左右時基部長出新芽,25 d后可見1 cm長的新芽,30~40 d內新芽增長速度最快。從表5可以看出,芽的增殖倍數隨著6-BA濃度的增加而逐漸上升,在4.0 mg/L 6-BA條件下培養基添加0.05和0.01 mg/L NAA,芽的增殖倍數最高,分別為37.7和42.6倍;當NAA為0.05 mg/L時,6-BA為1.0 mg/L與1.5、2.0、3.0、4.0 mg/L的增殖倍數差異顯著,而2.0與3.0 mg/L、2.0與4.0 mg/L間的增殖倍數差異不顯著;當NAA為0.01 mg/L時,6-BA為3.0與4.0 mg/L間增殖倍數差異不顯著,其他處理間增殖倍數差異均顯著;NAA 0.01 mg/L較0.05 mg/L更有利于芽的分蘗,增殖倍數更多,但植株較細,長勢稍遜。試驗還發現,當6-BA達到4.0 mg/L時出現叢生苗,苗細弱,緊密成一簇。為降低組培苗變異率,在保證組培苗質量的同時擁有較高的增殖倍數,以3.0 mg/L 6-BA+0.01 mg/L NAA最佳,在該條件下組培苗增殖倍數可達38.5倍。
3 討論
本研究通過對荸薺組培苗在TIBs系統中繼代增殖培養條件優化,得到采用經初代誘導培養到第5代繼代組培苗、接種密度10叢/瓶、培養基激素組合3.0 mg/L 6-BA+0.01 mg/L NAA、間歇浸沒頻率10 min/6 h,組培苗增殖達38.5倍。杭玲等(2005,2007)利用荸薺莖尖分別進行固體和液體組織快繁培養,結果表明,固體培養一代繼代增殖3~4倍,液體培養一代繼代增殖6~8倍,而本研究采用的TIBs系統組培增殖倍數遠高于傳統固體和液體培養方法。Alverd等(1993)利用該系統對香蕉(Musa AAB)進行組培快繁研究,發現一代增殖率達30倍,其原因可能與TIBs系統有良好的氣體交換環境有關;同時,培養基的循環利用可充分利用培養基的營養成分而有效防止營養沉積和有害物質積累(Aitken-Christie and Jones,1987)。
大量研究表明,使用不同代數的繼代苗為外植體,其組培苗的生長、增殖等狀況不同。楊柳等(2011)在利用TIBs進行甘蔗組培快繁研究時發現,以第4代甘蔗繼代苗為接種材料最有利于甘蔗組培苗的增殖和生長;粟靖(2011)研究發現,以第7代香蕉不定芽為試驗材料時,香蕉的生長和增殖效果最好。本研究利用TIBs系統進行荸薺組培苗快繁研究,選用第5代繼代組培苗最理想。
間歇浸沒頻率和間歇浸沒時間是影響植物組培快繁的關鍵因素之一,其直接影響外植體的呼吸和對營養的吸收(Shepherd and Silva,1996)。不同作物品種間最佳間歇浸沒頻率和浸沒時間差異明顯。Roels等(2005)研究表明,間歇浸沒頻率和浸沒時間為20 min/h最有利于香蕉增殖;Angela等(2009)研究發現,間歇浸沒頻率和浸沒時間為1 min/24 h對甘蔗品種Q165和Q117的增殖效果較好。本研究結果表明,荸薺組培苗的間歇浸沒頻率和浸沒時間為10 min/6 h時增殖效果較好。可見,不同作物品種芽的增殖倍數與間歇浸沒頻率、浸沒時間相關,具體原因有待對組培苗代謝及代謝產物進行深入探討后才能確定。本研究中在6 h內間歇浸沒時間低于15 min均未見玻璃化苗,浸沒時間超過15 min則易出現玻璃化苗,具體引起玻璃化苗的原因有待進一步研究。另外,TIBs系統培養由于營養液富集,容易造成污染,培養中要嚴格篩選繼代材料,避免細菌或霉菌類的污染材料接入培養瓶。
4 結論
本研究結果表明,利用TIBs系統進行荸薺組培苗快繁,適宜增殖生長的培養基為MS+3.0 mg/L 6-BA+
0.01 mg/L NAA+30.0 g/L蔗糖,pH 6.0,取第5代繼代組培苗,接種密度10叢/L,間歇浸沒頻率10 min/6 h,繼代增殖倍數可達38.5倍。
參考文獻:
杭玲,黃卓忠,廖首發. 2007. 荸薺脫毒及組培快繁技術研究與應用[J]. 江蘇農業科學,(6): 143-144.
Hang L, Huang Z Z, Liao S F. 2007. Research and application of water chestnut detoxification and tissue culture rapid propa-
gation technology[J]. Jiangsu Agricultural Sciences,(6): 143-144.
杭玲,蘇國秀,蔣慧萍,黃卓忠,何鐵光,蒙平,張向軍. 2005. 荸薺的組織培養和快速繁殖[J]. 廣西農業科學,36(4): 306-307.
Hang L, Sun G X, Jiang H P, Huang Z Z, He T G, Meng P, Zhang X J. 2005. Tissue culture and rapid propagation of water chestnut(Eleocharis tuberosa)[J]. Guangxi Agricultural Sciences, 36(4):306-307.
粟靖. 2011. 利用間歇浸沒式生物反應器(TIBs)進行香蕉組培快繁研究[D]. 南寧:廣西大學.
Li J. 2011. Banana micro-propagation in temporary immersion bioreactor system(TIBs)[D]. Nanning: Guangxi University.
李鐵軍,樸炫春,廉家盛,廉美蘭. 2012. 利用生物反應器接觸培養法增殖篤斯越橘叢生苗[J]. 林業科學,48(11):130-133.
Li T J, Piao X C, Lian J S, Lian M L. 2012. Proliferation of adventitious shoots of Vaccinium uliginosum using raft biore-
actors[J]. Scientia Silvae Sinicae,48(11):130-133.
劉麗敏,李松,戴友銘,余坤興,劉紅堅,淡明. 2009. 甘蔗莖尖脫毒培養技術研究[J]. 中國糖料,(2): 18-20.
Liu L M,Li S,Dai Y M,Yu K X,Liu H J,Dan M. 2009. Study on virus-free culture techniques of sugarcane stem tip[J]. Sugar Crops of China,(2): 18-20.
楊柳,秦剛,楊麗濤,吳建明,羅瑞鴻,魏源文,李楊瑞. 2011. 利用間歇浸沒式生物反應器進行甘蔗組培快繁的研究[J]. 華南農業大學學報,32(1):37-41.
Yan L, Qin G, Yang L T, Wu J M, Luo R H, Wei Y W, Li Y R. 2011. Optimization of sugarcane rapid propagation in temporary immersion bioreactors system[J]. Journal of South China Agricultural University,32(1):37-41.
Aitken-Christie J,Jones C. 1987. Towards automation: Pine shoots hedges in vitro[J]. Plant Cell,Tissue and Organ Culture,8(3):185-196.
Alverd D,Cote F,Teisson C. 1993. Comparison of methods of liquid medium culture for banana micropropagation effects of temporary immersion of explants[J]. Plant Cell, Tissue and Organ Culture,32(1):55-60.
Angela M, Jean A B, Prakash L. 2009. Development of a temporary immersion system(RITAR) for mass production of sugarcane(Saccharum spp. Interspecific hybrids)[J]. In Vitro Cellular & Developmental Biology-Plant, 45(4):450-457.
Be L V,Debergh P C . 2006. Potential low cost micro-propagation of pineapple(Ananascomosus)[J]. South African Journal of Botany,72(2):191-194.
Bernal A, Machado P, Cortegaza L, Elva R. 2008. Priming and biopriming integrated into the sugarcane micropropagation technology by Temporary immersion bioreactors(TIBS)[J]. Sugar Tech,10(1):42-47.
Etienne H, Berthouly M. 2002. Temporary immersion in plant micro-propagation[J]. Plant Cell,Tissue and Organ Culture,69(3):215-231.
Lorenzo J C, González B L, Escalona M,Teisson C,Espinosa P,Borroto C. 1998. Sugarcane shoot formation in an improved temporary immersion system[J]. Plant Cell,Tissue and Organ Culture,54(3):197-200.
Lorenzo J C,Ojeda E,Espinosa A,Borroto C. 2001. Field performance of temporary immersion bioreactor-derived sugarcane plants[J]. In Vitro Cellular & Development Biology-Plant, 37(6): 803-806.
Roels S,EscalonaI M,Cejas I, Noceda C,Rodriguez R,Canal M J,Sandoval J,Debergh P. 2005. Optimization of Plantain (Musa AAB) micropropagation by temporary immersion system[J]. Plant Cell, Tissue and Organ Culture,82(1):57-66.
Shepherd K, Silva K M. 1996. Mitotic instability in banana varieties. Aberrations in conventional triploid plants[J]. Fruits Paris, 51(2): 99-103.
(責任編輯 麻小燕)

