熱化學硫碘循環制氫系統中液相分層實驗教學探索
朱燕群 王麗建 徐少杰 傅廣實

摘要:傳統能源的日益枯竭和環境污染的加劇不斷刺激著新能源的發展,新能源的發展又依賴大批的專業人才,國內已經有64所高校開設了新能源科學與工程專業,但是專業成立不久仍處于起步階段,國內高校的人才培養模式和實踐課程體系的建設還不夠完善。本文針對新能源科學與工程專業的實驗教學和科研的需要,設計開發了一套熱化學硫碘循環水分解制氫系統中液相分層特性綜合實驗平臺。重點探討了目前液相分層的國內外研究現狀和實驗教學模式。以開放式教學激發學生興趣,加深理解,同時增強他們的實驗動手能力,培養學生的創新能力和提高學生的科研素質。
關鍵詞:硫碘制氫;液相分層;實驗教學
中圖分類號:G642.0 文獻標志碼:A 文章編號:1674-9324(2016)29-0251-04
隨著生態文明建設的日益推進,環境問題越來越受到人們的關注,特別是以煤、石油、天然氣為主的化石能源對環境造成了的巨大傷害。新能源的開發和利用已至關重要、迫在眉睫。而氫能具有資源豐富,可再生,高效,清潔安全,可儲存等優點[1],在眾多新能源中脫穎而出。
為迎接未來“氫時代”的到來,氫的大規模、低成本、高效制取是首先必須解決的關鍵問題。目前,制氫的方法多種多樣,按原料可分為礦物燃料制氫、生物質制氫和水分解制氫。水分解制氫技術又包含:電分解水、光分解水、熱分解水和熱化學水分解制氫等。其中,熱化學硫碘循環水分解制氫可以與高溫氣冷反應堆進行理想耦合,并且所需原料僅是水,非常具有應用前景,是未來的發展方向之一[2]。
熱化學硫碘循環水分解制氫由如下三個化學反應構成:
SO2+I2+2H2O 2HI+H2SO4 (1)
H2SO4 H2O+SO2+1/2O2 (2)
2HI I2+H2 (3)
SO2和I2與H2O通過Bunsen反應(1)常溫下就可以自發地進行放熱反應,生成的混合溶液在過量碘條件下可在短時間內自動進行液-液分層。上層溶液以H2SO4為主,并包含少量的HI、I2等雜質;下層溶液是所謂HIx相,除了少量的H2SO4,基本是HI-H2O-I2三元溶液體系。H2SO4相溶液需要經過純化去除雜質,閃蒸濃縮處理后,在970~1270K溫度范圍內發生分解反應生成SO2、H2O和O2(反應(2))。HIx相溶液經過電解電滲析(electro-electrodialysis)濃縮、精餾提純后,獲得高純度的HI氣體,然后進入溫度為570~770K的反應器內催化分解生成I2和H2(反應(3))。反應(2)和反應(3)生成的H2O、SO2和I2又重新回到反應(1)作為原料。整個閉路循環實現了凈輸入H2O和一定的熱量,即可生成H2和O2,所有的中間物料都是可以在內部循環使用的,而且每步反應都可以在相對較低的溫度下進行反應。
熱化學硫碘循環制氫系統可供匹配的熱源非常廣泛,反應條件也相對比較溫和,而且熱效率高,易于實現工業化,得到了廣泛的關注和研究。然而硫碘制氫至今仍存在諸多問題需解決,包括Bunsen反應副反應的抑制,液液分層現象規律,HI和H2SO4多相分解反應的機理研究。這些基礎研究成果都將為未來硫碘制氫的規模化、工業化發展奠定堅實的基礎。液相分離特性一直是其中比較重要的研究熱點,是整個循環流程中不可或缺的一環。Bunsen反應產物的自動分離是整個系統分為兩個子循環的開端,提高HIx相和H2SO4相的分離效果,去除兩相中的雜質,能夠降低純化、濃縮、提純等部分消耗的能耗,對系統熱效率的升高有著非常重要的影響[3]。實現硫碘制氫的工業化應用還有很長的路要走,培養更多的新能源專業的人才是一個很好的方式,而新能源科學與工程專業是工科中的新專業,在教學中與傳統的授課模式應該有所區別,液相分層在新能源的開發過程中是比較典型的類型,可以將液相分層實驗教學與科研資源進行有機的整合。這樣,在培養學生科研試驗能力的同時,又能夠對液相分層進一步深入細致的研究。未來,結合充分、全面的實驗數據,探究分離特性的機理,并發展出一套合理,嚴謹的分離數學模型。這些對于學生自身科研能力的全面提升,是大有裨益的。
一、液相分層的特性研究
硫酸相和碘化氫相的高效分離關系到整個硫碘循環的可行性和經濟性。兩相分離的方法有很多種,近年來主要圍繞電化學分離法[4]和過量碘法[5]展開,其中,最簡單且有效的方法是過量碘法。
Sakurai等[6,7]實驗結果發現:能使溶液出現分層現象I2摩爾分數的臨界值是0.32,增加碘量能夠有效促進兩相的分離;溫度和初始混合溶液的不影響兩相溶液的構成比例,但是溫度對兩相分離的影響較小,提升溫度會使溶液分層的可加入碘量的范圍增大。
Giaconia等[8]表明溫度基本上不影響兩相溶液的特性,溫度和碘量不會影響兩相溶液的純度,但他認為溶液分層存在最佳的溫度和初始濃度值,碘化氫相內的HI濃度可能超過共沸濃度。
Yoon等[9]通過液相分層實驗,結果表明當初始物料I2/H2SO4摩爾比在一定范圍內,HIx相溶液中的HI/H2O摩爾比可以大于1/5.3,表明無需電解-電滲析裝置,HIx相在常壓下就能達到超恒沸,降低溫度明顯減少了兩相雜質的含量。
Colette等[10]探究特定溫度下混合溶液的分層特性。結果表明:碘量和水量對兩相的分離和凈化影響顯著;盡管減少水量有利于分層,但是副反應的發生得不到有效抑制;而增大H2SO4/HI摩爾比有利于兩相的分層且有利于HIx相溶液中水雜質的減少。
Lee等[11]對各國學者的實驗數據進行了系統的總結。經過對比,他得到最優工況點是反應溫度330K,碘量4mol和水量11mol;而最優的工況區間則是330~350K,4~6mol過量碘和11~13mol過量水。在上述工況范圍內副反應能夠被有效的抑制,使碘化氫中HI濃度達到共沸濃度,有利于降低系統成本。
清華大學郭翰飛等[12]研究發現:過量的碘量或者H2SO4量有利于兩相分離;但是過量的碘量能抑制副反應的發生,而較低H2SO4濃度和較低溫度都可以減少副反應的發生。
本課題組朱俏俏等[3,13,14]經過系統地實驗研究發現:過量水能夠促進Bunsen反應的正向進行,并抑制副反應的發生,但是對于溶液的分離卻產生負面影響,導致分層所需的碘量上升;而溫度對分層現象的影響較小,出現分層所需碘摩爾分數隨溫度升高略有減小;而反應溫度的增加會促進副反應的發生,容易生成硫單質或硫化氫;提高過量碘的含量能顯著改善兩相分離的效果,且降低雜質含量,最大降幅達85%;模擬液完成兩相分離的時間受其組分影響較小,分層能在2min內進行完全。同時還得出了超恒沸HI溶液的生成機理并且揭示了獲得超恒沸溶液最佳運行條件。
諸多研究機構研究了溫度、水量等條件對液相分層特性的影響,尋找Bunsen反應的最佳工況。但研究結果表明,研究者們對最佳工況認知并不相同,原因在于各個研究機構研究的是不同的反應系統,其中包含多種考慮因素,不存在唯一準確的結論。故液相分層實驗的教學適合借鑒眾多一般性規律和結論,在廣泛的條件范圍內研究液相分層的特性。
二、實驗教學
(一)實驗要求和目的
Bunsen反應是SI循環水解制氫的基礎步驟,產物的分層特性與系統流程和熱效率密切相關。GA公司的過量碘法可以使Bunsen反應產物溶液自動分離,優點是不引入其他雜質。但過量的碘和水的加入,將導致后續流程變得復雜,而且伴隨著能耗的升高,會降低系統效率,增加設備初投資。故有必要為本課題組即將搭建的硫碘制氫循環系統尋找優化的工況條件。本實驗課程要求學生理解硫碘熱化學循環制氫的概念和意義,熟悉硫碘熱化學循環制氫的具體流程和相關技術,掌握Bunsen反應液相分層特性、組分濃度測試原理和方法。
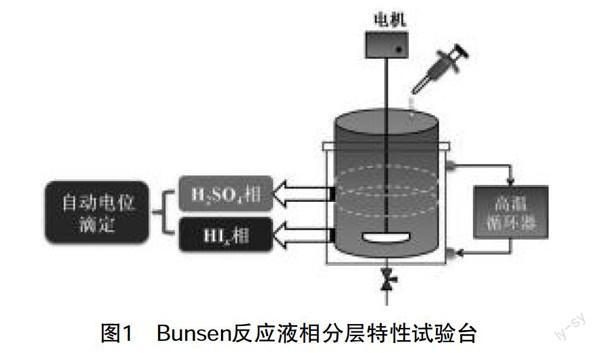
(二)實驗裝置的構成
本試驗在Bunsen反應液相分層特性試驗臺上進行,試驗臺架基本結構如圖1。配置真實的Bunsen反應產物溶液(H2SO4-HI-I2-H2O四元混合模擬溶液),加入到500mL夾套雙層玻璃反應釜,分離溫度由高溫循環水浴系統精確控制,及聚四氟的磁力攪拌器使初始溶液混合均勻。
基于電位滴定法,通過ZDJ-5型全自動電位滴定儀(如圖2)實現溶液組分測量。在被測溶液中插入一個參比電極和一個指示電極組成工作電池。隨著滴定劑的加入,由于發生化學反應,被測離子濃度不斷變化,指示電極的電位也相應地變化。在等當點附近發生電位的突躍,因此測量工作電池電動勢的變化,可確定滴定終點。最后,通過消耗的滴定劑的量計算得到待測溶液組分的濃度。和直接電位法相比,電位滴定法不需要準確的測量電極電位值,因此,溫度、液體接界電位的影響并不重要,其準確度優于直接電位法,普通滴定法是依靠指示劑顏色變化來指示滴定終點,如果待測溶液有顏色或渾濁時,終點的指示就比較困難,或者根本找不到合適的指示劑。
本實驗中,需對H2SO4、HI、I2和H2O等溶液濃度進行測定。其中,自動電位滴定儀可以直接測定H+、I-和I2濃度,通過質量守恒原則推測得到H2O含量,而SO■■濃度則通過離子守恒原則計算得到。為保證實驗的可重復性和精確性,實驗過程中對每個分析樣品進行至少3次重復取樣測定。由于遵循測試滴定過程中H+和I-互不干擾的原則,選用同一樣品依次滴定以避免復取樣帶來的誤差,而I2濃度則單獨取樣測定。
(三)實驗步驟
(1)連接各個儀器裝置,檢查管路,確保試驗系統密封良好;
(2)打開高溫循環器,使高溫循環器內水溫加熱至設定溫度值30℃或50℃,從而控制玻璃夾層反應釜水溫;
(3)按照摩爾比1/2/1.6/12配置H2SO4-HI-I2-H2O四元混合溶液,首先將56wt%氫碘酸溶液和固態碘(分析純)加入反應釜中,打開磁力攪拌裝置使碘完全溶解,然后加入定量去離子水,最后緩慢加入98wt%的濃硫酸溶液,充分混合均勻;
(4)溶液需靜置5~10min以確保液-液相溶液體系的完全分離,同時對低密度相(H2SO4相)和高密度相(HIx相)溶液重復取樣三次并稱重;
(5)通過酸堿和氧化還原滴定法測量兩相溶液中H+、和I2的濃度,其中標準的滴定溶液(NaOH、KIO3和Na2S2O3)則按照(GB/T 601-2002)方法來配制和標定,根據離子平衡和質量平衡原則,計算溶液中的硫酸根離子的濃度及水量;
(6)根據實驗結果,分析液相分層特性規律;
(四)結果計算
(1)H+濃度。酸堿滴定的反應方程式如下:H++OH-→H2O。根據消耗的NaOH溶液的體積與濃度,計算出H+的質量摩爾濃度。
M■=■ (4)
式中M■——待測液中的質量摩爾濃度mol/kg;
CNaOH——標準溶液的體積摩爾濃度mol/L;
VNaOH——滴定H+消耗的標準溶液的體積L;
m——待測液的質量kg。
(2)I-濃度。滴定I-的氧化還原反應方程式如下:6H■+5I■+IO■■■■→3I■2+3H■2O。根據消耗的溶液的體積與濃度,計算出I-的質量摩爾濃度。
M■=■ (5)
式中M■——待測液中的質量摩爾濃度mol/kg;
C■■——標準溶液的體積摩爾濃度mol/L;
V■——滴定I-消耗的標準溶液的體積L;
m——待測液的質量kg。
(3)I2濃度。滴定I2的氧化還原反應方程式如下:
I■2+2S■2O■■■→2I■+S■■O■■■。根據消耗的Na2S2O3溶液的體積與濃度,計算出I2的質量摩爾濃度。
M■=■ (6)
式中M■——待測液中的質量摩爾濃度mol/kg;
C■——標準溶液的體積摩爾濃度mol/L;
V■——滴定I2消耗的標準液的體積L;
m——待測液的質量kg。
(4)SO■■和水的濃度。SO■■和水的濃度分別依據離子守恒和質量守恒原則來計算:
M■=(M■-M■)/2 (7)
M■=(1000-M■×127.912-M■×98.0785-M■×253.8089)/18.01525 (8)
式中M■和M■——待測液中SO■■和H2O的質量摩爾濃度mol/kg;127.912,98.0785,253.8089和18.01525分別是HI、H2SO4、I2和H2O的摩爾質量g/mol。
通過這種開放式實驗教學,學生逐步掌握熱化學硫碘循環制氫,相關儀器的使用和液相分層的特性的評價方法,同時培養學生的實驗設計、實驗操作、實驗結果分析等綜合科研能力,為國內新能源科學與工程專業實驗教學提供了一種參考。
三、結論
將新能源實驗和高校實驗教學結合起來,作為課堂理論教學的延伸和擴展,設計相關實驗教學平臺,開展實驗教學,培養學生自主動手能力、分析和解決問題的能力,使學生更深入了解硫碘產氫系統的組成結構和工作原理。這有利于新能源領域的人才培養,使學生對氫能的認知更加廣闊和深入,促進硫碘熱化學循環制氫工藝的持續向前發展,為氫能時代的到來做好鋪墊。
參考文獻:
[1]周俊虎,謝琳,等.富含三類大分子有機質的廢棄食物發酵產氫特性[J].浙江大學學報(工學版),2006,40(11):2007-2010.
[2]Norman J H,Besenbruch G E,OKeefe D R.Thermochemical water-splitting for hydrogen production [R].GRI-80/0105,Washington DC:Gas Research Institute,1981.
[3]ZHU Q Q,ZHANG Y W,ZHOU C,et al. Optimization of liquid–liquid phase separation characteristics in the Bunsen section of the sulfur–iodine hydrogen production process. International Journal of Hydrogen Energy,2012,37(8):6407-6414.
[4]DOKIYA M,FUKUDA K,KAMEYAMA T,et al. Study of thermochemical hydrogen preparation.2.electrochemical hybrid cycle sulfur-iodine system[J].Denki Kagaku,1977,45(3):139-143
[5]NORMAN J H,BESENBRUCH G E,BROWN L C,et al. Thermochemical water-splitting cycle,Bench-scale investigations and process engineering[J]. IntJ Hydrogen Energy.1982;GA-A16713
[6]SAKURAI M,NAKAJIMA H,ONUKI K,et al. Preliminary process analysis for the closed cycle operation of the iodine-sulfur thermochemical hydrogen production process[J]. International Journal of Hydrogen Energy,1999,24(7):603-612.
[7]SAKURAI M,NAKAJIMA H,ONUKI K,et al. Investigation of 2 liquid phase separation characteristics on the iodine-sulfur thermochemical hydrogen production process [J]. International Journal of Hydrogen Energy,2000,25(7):605-611.
[8]GIACONIA A,CAPUTO G,CEROLI A,et al. Experimental study of two phase separation in the Bunsen section of the sulfur-iodine thermochemical cycle[J]. International Journal of Hydrogen Energy,2007,32(5):531-536.
[9]YOON H J,NO H C,KIM Y S,et al. Demonstration of the I-S thermochemical cycle feasibility by experimentally validating the over-azeotropic condition in the hydroiodic acid phase of the Bunsen process[J]. International Journal of Hydrogen Energy,2009,34(19):7939-7948.
[10]COLETTE MAATOUK S,BRIJOU MOKRANI N,TABARANT M,et al. Study of the miscibility gap in H2SO4/HI/I2/H2O mixtures produced by the Bunsen reaction - Part I:Preliminary results at 308K[J]. International Journal of Hydrogen Energy,2009,34(17):7155-7161.
[11]LEE B J,NO H C,YOON H J,et al. An optimal operating window for the Bunsen process in the I-S thermochemical cycle[J]. International Journal of Hydrogen Energy,2008,33(9):2200-2210.
[12]GUO H F,ZHANG P,LAN S R,et al. Study on the phase separation characteristics of HI–I2–H2SO4–H2O mixture at 20℃[J].Fluid Phase Equilibria,2012,324(0):33-40.
[13]張彥威,周俊虎,陳云,等.熱化學硫碘制氫中Bunsen反應分層現象及副反應的實驗研究[J].太陽能學報,2009,30(7):996-999.
[14]楊劍,黃鎮宇,胡瑩超,等.硫碘制氫中本生反應兩相分離的試驗研究[J].太陽能學報,2012,33(8):1289-1294.

