9-硝基-9-氮雜雙環[3.3.1]壬烷-2,6-二醇二硝酸酯的合成與表征
邵航松,凌亦飛,侯天驕,阮宏偉,王晨嬌,羅 軍
(南京理工大學化工學院,江蘇南京210094)
?
9-硝基-9-氮雜雙環[3.3.1]壬烷-2,6-二醇二硝酸酯的合成與表征
邵航松,凌亦飛,侯天驕,阮宏偉,王晨嬌,羅軍
(南京理工大學化工學院,江蘇南京210094)
摘要:以環辛二烯為原料,經環氧化、胺化成環、硝化等合成了一種新型含能材料9-硝基-9-氮雜雙環[3.3.1]壬烷-2,6-二醇二硝酸酯,采用NMR、IR、元素分析對其結構進行了表征;利用熱重分析和差示掃描量熱法對其熱性能進行了分析;利用Kamlet-Jacobs經驗公式對其爆轟性能進行了理論計算;研究了硝化反應過程中反應時間、反應溫度和物料配比等因素對收率的影響。結果表明,硝酸用量為7倍摩爾當量時,在30℃下反應3h,目標產物收率為83%。9-硝基-9-氮雜雙環[3.3.1]壬烷-2,6-二醇二硝酸酯熔點為120℃,起始分解溫度為150℃,放熱峰溫為192℃,表明其具有較好的熱穩定性。其爆速、爆壓、密度的理論計算值分別為7580m/s、23.82GPa和1.61g/cm3,有望應用于炸藥及推進劑配方中。
關鍵詞:有機合成;氮雜雙環壬烷;硝胺;硝化;環辛二烯;熱穩定性
引言
含雙環[3.3.1]壬烷結構的化合物廣泛存在于天然產物中,是很多生物活性物質和代謝物質結構的重要組成部分,在藥物、燃料、防銹、催化、含能材料等領域應用廣泛[1-8]。Larkin等[1]合成出了一類2,6-二取代-9-氧雜雙環[3.3.1]壬烷化合物,其可用作防銹劑,同時在燃料領域可用作防凍劑[3]。Stoss等[2]合成了雙環[3.3.1]壬烷-2,6-二醇二硝酸酯和9-氧雜雙環[3.3.1]壬烷-2,6-二醇二硝酸酯等,在藥物領域具有一定的應用價值。Archibald等[3]合成了2,6-二硝基雙環[3.3.1]壬烷和2,2,6,6-四硝基雙環[3.3.1]壬烷,可以作為新型的雙環多硝基含能材料。Graetz等[4]合成了氮雜雙環[3.3.1]壬烷骨架的氮氧自由基化合物,可以作為一種氧化催化劑。Frantz等[5]構建了氮雜雙環[3.3.1]壬烷骨架,并基于此完成了一些具有生物活性的天然化合物的全合成;Darout等[6]也基于氮雜雙環[3.3.1]壬烷骨架合成出了一類新型的氮雜金剛烷藥物。本課題組構建了雙環[3.3.1]壬烷-2,6-二酮,再經過多步反應合成出了2,2,4,4,6,6-六硝基金剛烷[7];還構建了9-羥基雙環[3.3.1]壬烷-2,6-二酮,并經過多步反應合成了一種新型含能材料4,4,8,8-四硝基金剛烷-2,6-二醇二硝酸酯[8]。
在雙環[3.3.1]壬烷-2,6-二酮骨架構建成功的基礎上[9],本研究以1,5-環辛二烯為原料,經過環氧化和胺化環合構建了9-氮雜[3.3.1]壬烷-2,6-二醇骨架,并通過硝化反應合成出了一種新型的含能材料9-硝基-9-氮雜雙環[3.3.1]壬烷-2,6-二醇二硝酸酯,采用TG和DSC分析了其熱性能,為其在含能材料中的應用提供參考。
1實驗
1.1試劑與儀器
環辛二烯,分析純,上海阿拉丁生化科技股份有限公司;過硫酸氫鉀復鹽(Oxone),分析純,薩恩化學技術有限公司;氨氣,純度99.99%,南京上元工業氣體廠;冰乙酸,分析純,成都市科龍化工試劑廠;乙酸酐,分析純,江蘇永華精細化學品有限公司;發煙硝酸,分析純,國藥集團化學試劑有限公司。
Nicolet傅里葉變換紅外光譜儀,美國Thermofisher公司;Bruker Avance-Ⅲ DRX 500MHz核磁共振儀、Bruker Avance-Ⅲ DRX 126MHz核磁共振儀,德國Bruker公司;Vario EL-Ⅲ型元素分析儀,德國Elemetar公司;TGA/STDA851e熱重/差熱同步分析儀,瑞士梅特勒托利多公司,樣品量0.5000mg;DSC823e差示掃描量熱儀,瑞士梅特勒托利多公司,樣品量0.3700mg,N2氣氛,流速30mL/min,升溫速率10.0℃/min,升溫區間50~300℃。
1.2目標化合物的合成
1.2.1合成路線
以環辛二烯為原料,先對其進行環氧化反應得到5,10-二氧雜三環[7.1.0.04,6]癸烷(化合物1),再對化合物1進行胺化成環反應得到9-氮雜雙環[3.3.1]壬烷-2,6-二醇[7.1.0.04,6]癸烷(化合物2),最后對化合物2進行硝化反應得到9-硝基-9-氮雜雙環[3.3.1]壬烷-2,6-二醇二硝酸酯(化合物3),反應路線如下:

1.2.25,10-二氧雜三環[7.1.0.04,6]癸烷(化合物1)的合成[9]
向三口燒瓶中加入15g(0.179mol)NaHCO3和150mL水,攪拌至固體基本溶解,再加入60mL丙酮、150mL二氯甲烷和5.7mL環辛二烯(5g,0.046mol),在冰水浴條件下,緩慢滴加57g(0.093mol)過硫酸氫鉀復鹽的水溶液,使反應溫度保持在30℃以下,滴加結束后,繼續保持此溫度反應5h。反應結束后,分離出有機相,水相用CH2Cl2(3×100mL)萃取,合并有機相,用無水Na2SO4干燥,過濾,減壓蒸餾除溶劑后得到無色液體,經硅膠柱層析,體積比為10∶1的石油醚/乙酸乙酯洗脫,得到5.14g無水油狀物,收率為79%。
1H NMR(500MHz,CD3OD,δ):1.88~1.97(m,4H),1.99~2.07(m,4H),2.98~3.06(m,4H);13C NMR(126MHz,CD3OD3,δ):22.28,56.30;元素分析(C8H12O2,%):計算值,C 68.54,H 8.63,O 22.83;實測值,C 68.62,H 8.71,O 22.67。
1.2.39-氮雜雙環[3.3.1]壬烷-2,6-二醇(化合物2)的合成
向密封管中加入3g(0.021mol)化合物1和10mL飽和的氨氣甲醇溶液,密封后加熱到120℃反應36h。反應結束后,減壓蒸餾除去溶劑后得黃色固體,經三氧化二鋁柱層析,體積比為1∶2的甲醇/乙酸乙酯洗脫,得到2.86g白色固體,收率為85%。
1H NMR(500MHz,CDCl3,δ):1.67~1.75(m,4H),1.81~1.9(m,2H),2.06~2.14(m,2H),2.78~2.87(m,2H),3.85~3.92(m,2H);13C NMR(126MHz,CD3OD,δ):22.63,29.39,50.48,69.99;FT-IR(KBr),ν(cm-1):3302,3247(O-H,N-H),2908,2944,1445,1400(C-H),1620(N-H),1327(O-H),1086,1057(C-O,C-N);元素分析(C8H15NO2,%):計算值,C 61.12,H 9.62,N 8.91,O 20.35;實測值,C 61.19,H 9.68,N 8.88,
O 20.25。
1.2.49-硝基-9-氮雜雙環[3.3.1]壬烷-2,6-二醇二硝酸酯(化合物3)的合成
向圓底燒瓶中加入2.5mL乙酸酐和2.5mL乙酸,在0℃下滴加1mL(22 mmol)發煙HNO3,使溫度保持在5℃以下。混合物攪拌20min后,分批加入0.5g(3mmol)化合物2。在30℃下反應3h。反應結束后,將體系混合物緩慢加入到NaHCO3的冰水溶液中。然后用CH2Cl2(3×50mL)萃取,合并有機相,用無水Na2SO4干燥,過濾,減壓蒸餾除溶劑后得到淡黃色固體,經硅膠柱層析,體積比為 30∶1的石油醚/乙酸乙酯洗脫,得到0.77g白色固體,收率為83%。
1H NMR(500MHz,CDCl3,δ):1.89~1.96(m,2H),2.01~2.06(m,2H),2.24~2.29(m,4H),5.17~5.23(m,2H),5.51~5.57(m,2H);13C NMR(126MHz,CDCl3,δ):20.83,23.69,51.15,76.63;FT-IR(KBr),ν(cm-1):1644,1281(O-NO2),1533,1324(N-NO2),1104,1023(C-O,C-N);元素分析(C8H12N4O8,%):計算值,C 32.88,H 4.14,N 19.17,O 43.81;實測值,C 32.95,H 4.18,N 19.13,O 43.74。
2結果與討論
2.1胺化成環反應機理
Henkel等[10]在氮雜金剛烷二醇的構建中使用飽和的氨氣甲醇溶液進行胺化成環反應;Graetz B等[4]采用相同的方法構建了氮雜二甲基金剛烷二醇骨架,產率達95%,如圖1所示。因此,本實驗也選用飽和的氨氣甲醇溶液對化合物1進行胺化成環反應,產率達85%。
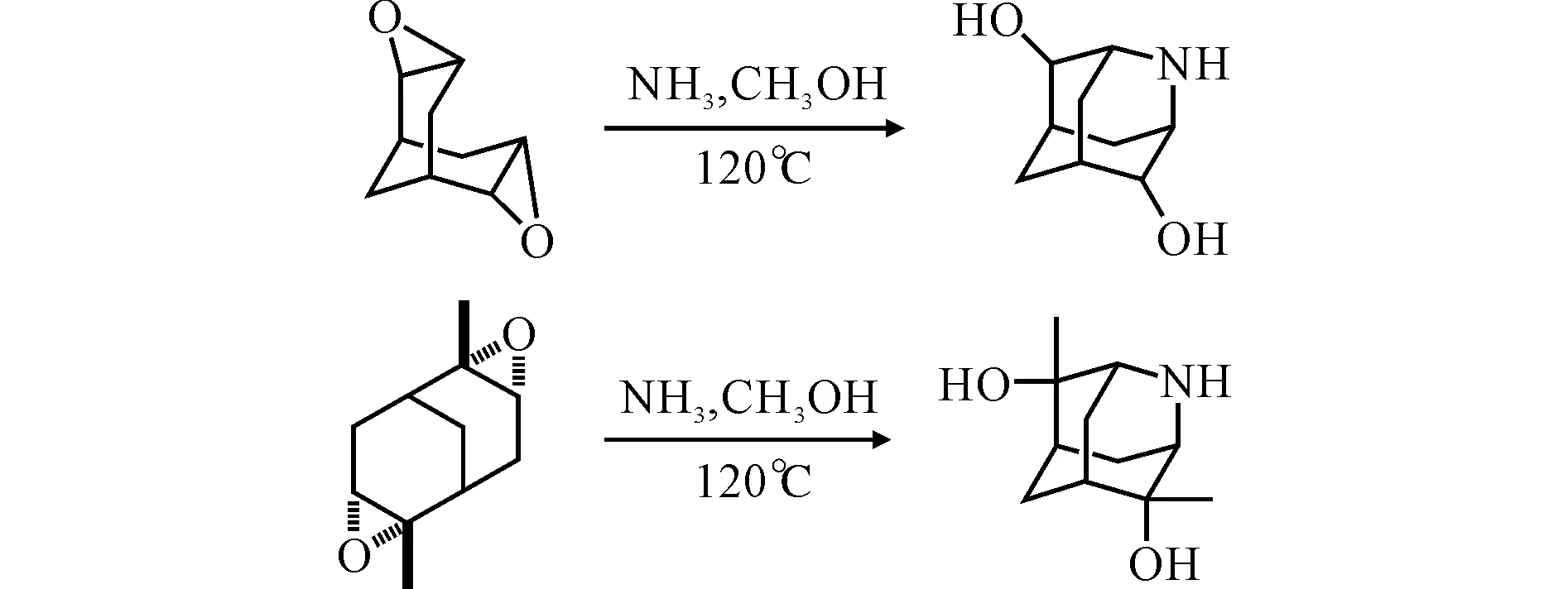
圖1 胺化成環反應構建氮雜金剛烷二醇骨架Fig.1 Aminative cyclization to construct azaadamantanediolskeletons
2.2最佳硝化反應條件的確定
在對化合物2進行硝化合成目標產物9-硝基-9-氮雜雙環[3.3.1]壬烷-2,6-二醇二硝酸酯的過程中同時涉及到O-硝化和N-硝化反應,針對仲胺N-硝化反應的特點,本研究采用硝酸-醋酸酐-醋酸體系進行硝化反應,研究了反應時間、反應溫度、發煙硝酸用量對硝化反應的影響。
2.2.1反應時間的影響
在溫度為30℃、化合物2與HNO3摩爾比為1.0∶7.0條件下,考察了反應時間對9-硝基-9-氮雜雙環[3.3.1]壬烷-2,6-二醇二硝酸酯(化合物3)收率的影響。結果表明,反應時間分別為1、2、3、4、5h時,化合物3收率分別為70%、77%、83%、72%、68%。
可以看出,隨著反應時間的延長,化合物3收率增大,3h時收率達到最大,再延長反應時間,收率降低。這可能是由于隨著反應時間的延長,化合物2先逐漸轉化,繼續延長反應時間,因為化合物2骨架中含有氮雜原子,長時間在酸性體系中會導致開環,所以酸性體系對產物的穩定性不利,使副產物增多[11]。因此,確定最佳反應時間為3h。
2.2.2反應溫度的影響
在化合物2與HNO3摩爾比為1.0∶7.0、反應時間為3h條件下,考察了反應溫度對化合物3收率的影響。結果表明,當反應溫度分別為10、20、30、40、50、60℃時,收率分別為69%、76%、83%、73%、68%。
可以看出,隨著反應溫度的升高,收率先增加后減小。當反應溫度為30℃時,硝化產物收率達到最高(83%)。這是由于隨著反應溫度的升高,底物的反應活性提高,從而收率也隨之提高。但是隨著溫度的繼續升高,副反應增多,從而影響了收率[11]。因此,確定最佳反應溫度為30℃。
2.2.3發煙硝酸用量的影響
在溫度為30℃、反應時間為3h條件下,考察了化合物2與發煙硝酸摩爾比對化合物3收率的影響。結果表明,當摩爾比分別為1.0∶3.5、1.0∶7.0、1.0∶10.5、1.0∶14.0、1.0∶17.5時,收率分別為72%、83%、71%、68%、55%。
可以看出,化合物2與發煙硝酸摩爾比為1.0∶7.0時,收率達到最高(83%),繼續增大發煙硝酸的用量,收率則開始降低。分析原因,可能是隨著發煙硝酸的加入,體系的酸性隨之變大,硝化反應也隨之變得復雜[11]。因此,化合物2與發煙硝酸最佳摩爾比為1.0∶7.0。
2.2.4優化條件的選取
綜合上述單因素實驗,選取化合物2與HNO3摩爾比(A)、反應溫度(B)、反應時間(C)三因素,每個因素各取三水平,采用L9(33)正交表進行正交實驗。結果表明,最優條件為:化合物2與HNO3摩爾比為1.0∶7.0,反應時間3h,反應溫度30℃。
在此優化條件下進行4次平行實驗,硝化反應的平均收率達到83%。
2.3熱穩定性及爆轟性能分析
采用熱重(TG)和差示掃描量熱法(DSC)分析了9-硝基-9-氮雜雙環[3.3.1]壬烷-2,6-二醇二硝酸酯的熱穩定性,結果見圖2。
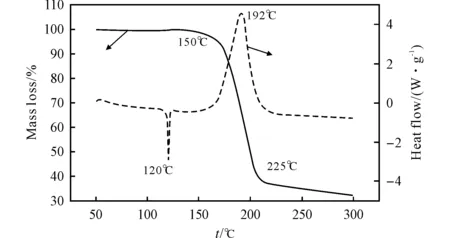
圖2 9-硝基-9-氮雜雙環[3.3.1]壬烷-2,6-二醇二硝酸酯的TG-DSC曲線Fig.2 TG-DSC curves of 9-nitro-9-azabicyclo[3.3.1]nonane-2,6-diyl dinitrate
由圖2可知,DSC曲線在120℃有一個吸熱峰,而此溫度時TG曲線顯示無質量變化,表明此段時間化合物正處于熔化過程,即化合物3的熔點為120℃。隨著溫度的上升,當超過150℃后,化合物3開始分解,在150~225℃之間失重率為67.37%,DSC曲線顯示化合物3在192℃有一個尖銳的放熱峰,表明在此溫度下發生了強烈的分解放熱反應。以上結果表明化合物3的熱穩定性較好。
采用Kamlet-Jacobs公式估算9-硝基-9-氮雜雙環[3.3.1]壬烷-2,6-二醇二硝酸酯的爆轟性能[12]。結果表明,其爆速為7580m/s, 爆壓為23.82GPa,密度為1.61g/cm3,有望用于炸藥及推進劑配方中。
3結論
(1)以環辛二烯為原料,經環氧化、胺化成環、硝化3步反應合成了一種新型含能化合物9-硝基-9-氮雜雙環[3.3.1]壬烷-2,6-二醇二硝酸酯,并利用核磁共振(NMR)、紅外光譜(IR)、元素分析等對產物進行了表征。
(2)優化了硝酸-醋酐-醋酸體系下9-氮雜雙環[3.3.1]壬烷-2,6-二醇(化合物2)的硝化反應條件,得到最佳反應條件為:化合物2與HNO3摩爾比1.0∶7.0,反應時間3h,反應溫度30℃,并在最佳反應條件下進行了4次平行實驗,平均硝化收率為83%。
(3)TG和DSC分析表明,9-硝基-9-氮雜雙環[3.3.1]壬烷-2,6-二醇二硝酸酯的熔點為120℃,從150℃開始分解,分解峰溫為192℃,表明其具有較好的熱穩定性;采用Kamlet-Jacobs公式估算其爆速為7580m/s, 爆壓為23.82GPa,密度為1.61g/cm3。
參考文獻:
[1]Larkin J M. 2,6-disubstituted-9-oxabicyclo [3.3.1]nonanes: US, 3636056[P]. 1972.
[2]Stoss P, Erhardt E. Bicycloalkanol-nitrate[J]. Archiv Der Pharmazie, 1987, 320(7): 621-624.[3]Archibald T G, Baum K. Synthesis of polynitroadamantanes. oxidation of oximinoadamantanes[J]. The Journal of Organic Chemistry, 1988, 53(20): 4645-4649.
[4]Graetz B, Rychnovsky S, Leu W H, et al. C2-symmetric nitroxides and their potential as enantioselective oxidants[J]. Tetrahedron: Asymmetry, 2005, 16(21): 3584-3598.
[5]Frantz M C, Skoda E M, Sacher J R, et al. Synthesis of analogs of the radiation mitigator JP4-039 and visualization of BODIPY derivatives mitochondriat[J]. Organic and Biomolecular Chemistry, 2013, 11(25): 4147-4153.
[6]Darout E, Robinson R P, Mcclure K F, et al. Design and synthesis of diazatricyclodecane agonists of the g-protein-coupled receptor 119[J]. Journal of Medicinal Chemistry, 2013, 56(1): 301-319.
[7]LING Yi-fei, ZHANG Ping-ping, SUN Lu, et al. Efficient synthesis of 2,2,4,4,6,6-hexanitroadamantane under mild conditions[J]. Synthesis, 2014, 46: 2225-2233.
[8]LING Yi-fei, REN Xiao-li, LAI Wei-peng, et al. 4,4,8,8-tetranitroadamantane-2,6-diyl dinitrate: a high-density energetic material[J]. European Journal of Organic Chemistry, 2015, (7): 1541-1547.
[9]Bieliunas V, Rackauskaite D, Orentas E, et al. Synthesis, enantiomer separation, and absolute configuration of 2,6-oxygenated 9-azabicyclo[3.3.1]nonanes[J]. The Journal of Organic Chemistry, 2013, 78: 5339-5348.
[10]Henkel J G, Faith W C, Hane J T. General synthesis of n-substituted 2-azaadamantanes and their 4,8-disubstituted derivatives[J]. Journal of Organic Chemistry, 1981, 46(17): 3483-3486.
[11]史楠,胡炳成,呂春緒. 小分子法合成1,5-二乙酰基-3,7-二硝基-1,3,5,7-四氮雜辛烷工藝研究[J]. 火炸藥學報,2013, 36(2): 13-19. SHI Nan, HU Bing-cheng, Lü Chun-xu. Study on the process of synthesizing 1,5-diacetyl-3,7-dinitro-1,3,5,7- tetraazacyclooctane by small-molecule method[J]. Chinese Journal of Explosives and Propellants, 2013, 36(2): 13-19.
[12]Kamlet M J, Jacobs M J. Chemistry of detonation I a simple method for calculation detonation properties of C-H-N-O explosives[J]. Journal of Chemical Physics, 1967, 48(1): 23-35.
Synthesis and Characterization of 9-Nitro-9-azabicyclo[3.3.1]nonane-2,6-diyl Dinitrate
SHAO Hang-song, LING Yi-fei, HOU Tian-jiao, RUAN Hong-wei, WANG Chen-jiao, LUO Jun
(School of Engineering, Nanjing University of Science and Technology, Nanjing 210094, China)
Abstract:A new energetic compound 9-nitro-9-azabicyclo[3.3.1]nonane-2,6-diyl dinitrate was synthesized via epoxidation, aminative cyclization and nitration using cycloocta-1,5-diene as raw material. Its structure was characterized by nuclear magnetic resonance spectrometry(NMR), infrared spectrometry(IR) and elementary analysis. Its thermal properties were analyzed by thermogravimetry (TG) and differential scanning calorimetry (DSC). The theoretical calculation of detonation performances was carried out by Kamlet-Jacobs empirical formula. The effects of reaction time, reaction temperature and ratio of substrates in the nitration reaction on the yield were studied. The results show that when the amount of nitric acid is seven-fold molar equivalent and the reaction performs at 30℃ for 3 h, the yield of target product is 83%. The melting point, initial decomposition temperature and decomposition peak temperature of 9-nitro-9-azabicyclo[3.3.1]nonane-2,6-diyl dinitrate are 120℃, 150℃ and 192℃ respectively, revealing that it has good thermal stability. The calculated values of detonation velocity,detonation pressure and density are 7580m/s, 23.82GPa, and 1.61g/cm3, respectively, which is expected to be applied in explosive and propellant formulations.
Keywords:organic synthesis; azabicyclononane; nitroamine; nitration; cyclooctadiene; thermal stability
中圖分類號:TJ55; O62
文獻標志碼:A
文章編號:1007-7812(2016)02-0064-04
作者簡介:邵航松(1991-),男,碩士,從事精細合成研究。E-mail: 15850570982@163.com通訊作者:羅軍(1975-),男,教授,從事有機合成化學研究。E-mail: luojun@njust.edu.cn
收稿日期:2015-09-29;修回日期:2015-10-30
DOI:10.14077/j.issn.1007-7812.2016.02.013

