鈣黏蛋白E、橋粒芯糖蛋白2、磷酸化Akt和轉錄因子Snail在侵襲性前列腺癌中的作用
匡小跟,張暉輝,許韓峰,李清,曹友漢
(南華大學附屬第一醫院泌尿外科,湖南衡陽421001)
?
鈣黏蛋白E、橋粒芯糖蛋白2、磷酸化Akt和轉錄因子Snail在侵襲性前列腺癌中的作用
匡小跟,張暉輝,許韓峰,李清,曹友漢
(南華大學附屬第一醫院泌尿外科,湖南衡陽421001)
摘要:目的探討鈣黏蛋白E(E-cadherin)、橋粒芯糖蛋白(2DSG2)、磷酸化Akt(pAkt)和轉錄因子Snail在前列腺癌發病進程中的作用;闡明E-cadherin、DSG2、pAkt和Snail對前列腺癌發病進程的影響及在臨床預后中的作用。方法組織芯片法檢測E-cadherin、DSG2、pAkt和Snail在前列腺癌組織中的表達情況。結果前列腺癌組織中E-cadherin表達明顯低于正常前列腺組織,細胞質和細胞核中均可觀察到pAkt表達,且在腫瘤高分化區和低分化區內均有較高表達。E-cadherin和DSG2表達呈顯著正相關。E-cadherin和DSG2表達下降提示前列腺癌患者血清前列腺特異性抗原(PSA)濃度含量增加,Gleason評分較高及病理分期更高。結論前列腺癌低分化細胞中鈣黏蛋白表達降低,鈣黏蛋白低表達提示腫瘤細胞侵襲性更強,轉移發生率高。鈣黏蛋白在前列腺癌發展中發揮關鍵作用,E-cadherin和DSG2有望成為侵襲性前列腺癌的預后因子。
關鍵詞:前列腺癌;預后;組織芯片;E-cadherin;DSG2;pAkt;Snail
前列腺癌診斷和治療的主要挑戰是預測當前癌癥狀態能否會進展為侵襲性癌癥[1]。到目前為止,除了血清前列腺特異性抗原(prostate specific antigen,PSA)外[2],還沒有確定的預后因子用于前列腺癌預后預測。因此,識別和發展新的能夠有效預測前列腺癌侵襲性的預后標志物勢在必行。
蛋白激酶B(protein kinase B,PKB或Akt)和磷酸化Akt(phosphorylated Akt,pAkt)在前列腺癌中過表達,Akt/pAkt蛋白表達與前列腺癌生化復發相關[3-4]。盡管目前發現前列腺癌中鈣黏蛋白E (E-cadherin)表達缺失[5-6],但目前尚未見關于E-cadherin表達缺失與前列腺癌生化復發相關性的研究報道。此外,目前也未見關于橋粒芯糖蛋白2 (desmoglein 2,DSG2)在前列腺癌中表達情況的研究報道。以往研究表明,PI3K/Akt信號通路活化可通過上皮細胞-間充質轉化(epithelial-mesenchymal transition,EMT)相關轉錄因子Snail抑制前列腺癌E-cadherin轉錄。本研究檢測前列腺癌組織標本中DSG2、活化Akt和Snail表達情況及其相關性,并分析E-cadherin及DSG2和生化復發的相關性,探討E-cadherin和DSG2作為前列腺癌侵襲性有效預測因子的潛力。
1 資料與方法
1.1研究對象
128例前列腺癌組織標本均為2001年1月-2005年12月南華附屬第一醫院泌尿外科前列腺癌手術后樣本。用于mRNA提取的所有組織均是經尿道前列腺電切術及恥骨弓上前列腺切除術中迅速收集,然后投入已經準備好的液氮中,冷凍保存。切取組織直接用包埋劑進行包埋,制作冷凍切片。所有病例均經HE染色確定,并進行Gleason評分及臨床分期。術后均經病理證實為前列腺癌。
1.2主要方法
所有標本均經10%中性福爾馬林溶液固定,石蠟包埋,應用組織芯片制備儀制備芯片。首先每個組織制作1張HE切片,由病理專家在顯微鏡下將病變的典型部位進行定位,并在切片上標記相關區域,然后將該切片和石蠟組織塊進行比較,依靠HE切片上標記在石蠟組織塊同一部位也做一標記,這樣就可以做到準確定位。制備長36 mm×寬26 mm×高15 mm大小的空白蠟塊,在此蠟塊26 mm× 21 mm范圍內打孔(1.5 mm)制成12×9共108點陣芯片的模塊。穿刺事先標記的目標組織(直徑1.5 mm),準確放入空白蠟塊的小孔內。每例標本均編號,從空載體芯片臘塊第1排第3孔開始,依次按序操作直至將所有標本均種植于空白蠟塊中,最后用石蠟切片機進行連續切片。建立布有250個陣列(樣本)不同級別的前列腺臨床標本的組織芯片,正常前列腺組織標本10例。
1.3免疫熒光雙重染色(FITC-CY3)和激光掃描共聚焦顯微鏡觀察
取組織芯片石蠟切片(4μm),58℃烤18 h,常規脫蠟,PBS洗3遍。檸檬酸緩沖液抗原修復20 min,室溫冷卻20 min,PBS洗3遍。滴加20%蛋清,室溫靜置30 min,PBS洗3遍。滴加10%正常羊血清,室溫靜置20 min。加鼠E-cadherin/DSG2/pAkt/ Snail(1∶50)和CK8/18(1∶100)混合物,室溫孵育4 h,PBS洗3遍。加羊抗鼠IgG-FITC(1∶30)和生物素化羊抗兔IgG(1∶100)混合物,避光室溫孵育1 h,PBS洗3遍。加Streptavidin.Cy3,室溫孵育1 h,PBS 洗3遍,蒸餾水洗3 min,以防熒光碎滅劑封片。Leica TCS SP2激光掃描共聚焦顯微鏡下掃描,計算機采集數據,數字成像。CK8/18陽性細胞可見細胞核內綠色熒光,E-cadherin/DSG2/pAkt/Snail陽性細胞核內可見紅色熒光。
1.4統計學方法
應用SPSS 18.0統計軟件進行數據分析。率的比較采用χ2檢驗和確切概率法,等級資料比較采用秩和檢驗,等級資料的關聯分析采用Spearman等級相關分析。P<0.05為差異有統計學意義。
2 結果
2.1免疫熒光分析原發性前列腺癌組織芯片中E-cadherin、DSG2、pAkt和Snail的表達
128例前列腺癌患者組織標本用福爾馬林固定和石蠟包埋后,分別提取直徑約為2 mm圓柱狀核心組織,并將這些組織嵌入到同一張切片,用于構建前列腺癌組織芯片,以便能同時測定各蛋白在多個樣本中表達情況。前列腺癌組織芯片由上海芯超生物科技有限公司制作完成。前列腺癌組織芯片構建時,首先由兩名病理科教授檢測各患者組織標本,以確定腫瘤細胞高密度區,供公司參考。構建好后,從前列腺癌組織芯片石蠟包埋中切取5μm組織用于免疫熒光分析。蛋白表達計分方法為發生免疫反應的腫瘤細胞占組織核的百分比(見圖1)。然后對每個樣本組織核的平均值進行統計學分析。患者的臨床學特征見表1。
2.2前列腺癌組織中E-cadherin、DSG2、pAkt和Snail蛋白的表達情況
免疫組織化學結果表明前列腺癌組織中E-cadherin和DSG2表達明顯低于前列腺組織,腫瘤高分化區細胞邊緣E-cadherin和DSG2蛋白高水平表達,而腫瘤低分化區域E-cadherin和DSG2表達下降(見圖2A、2B)。pAkt在前列腺癌細胞質和細胞核中均表達,且在腫瘤高分化區和低分化區內均有較高表達(見圖2C)。此外,前列腺癌Snail核表達水平較正常組織也略有上升(見圖2D)。見表2。
2.3前列腺癌蛋白表達和臨床病理學特征的關系
斯皮爾曼秩相關法統計發現,E-cadherin和DSG2表達呈顯著正相關,pAkt表達升高同時Snail水平也升高,pAkt和Snail表達之間呈弱顯著正相關。此外,pAkt與E-cadherin表達成弱顯著正相關。pAkt與DSG2表達相關性要比pAkt和E-cadherin表達相關性還要弱,而且無統計學意義。這些結果表明E-cadherin和DSG2隨著pAkt表達增強而增強,E-cadherin和Snail之間存在微弱負相關,但相關性無統計學意義。此外,DSG2和Snail表達呈微弱正相關,相關性也無統計學意義,提示前列腺癌中Snail表達并不影響DSG2表達。
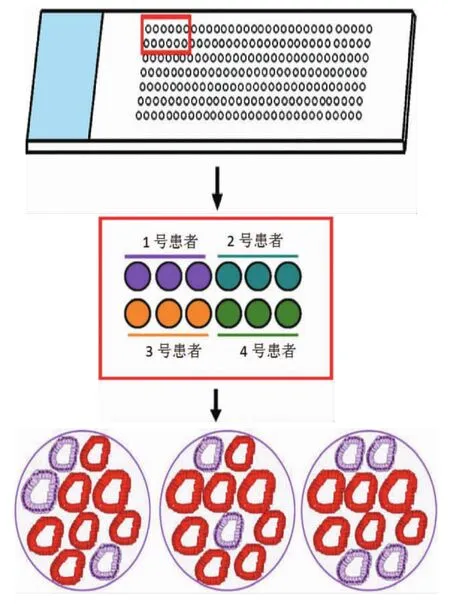
圖1 前列腺癌組織芯片制備及評價流程圖
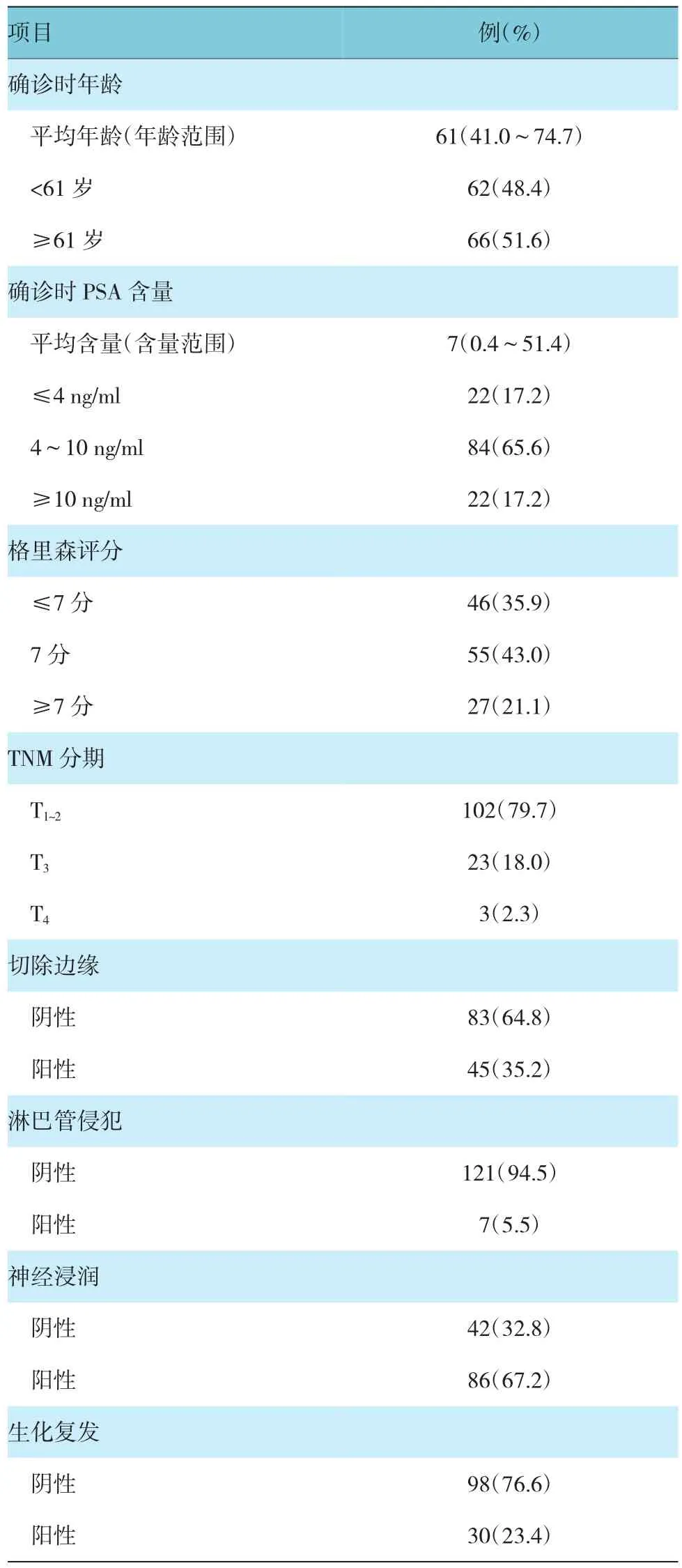
表1 患者一般資料(n=128)
統計還發現E-cadherin表達和所有檢查臨床病理特征之間存在負相關,盡管其相關性無統計學意義。而DSG2表達和所有臨床病理特征也呈負相關,DSG2表達分別與血清PSA濃度、Gleason評分呈顯著負相關,并且其相關性稍強于E-cadherin表達與血清PSA濃度、Gleason評分的相關性。總之,本結果表明,E-cadherin和DSG2表達下降提示前列腺癌患者血清PSA濃度含量增加、Gleason評分較高及病理分期更高。見表3。
2.4蛋白表達的臨床影響
E-cadherin表達70%處最接近于前列腺癌標本E-cadherin表達平均值,因而選取該處為閾值,將患者分為E-cadherin高表達組(≥70%)與E-cadherin低表達組(<70%),比較兩組患者生存期,結果發現E-cadherin表達≥70%組患者無復發生存率高于E-cadherin表達<70%組患者,差異有統計學意義(見圖3A,P=0.043)。E-cadherin表達<70%組患者生化復發中值時間為104個月,而E-cadherin表達≥70%組患者120個月隨訪期結束后尚未達到生化復發中值時間。同樣選取DSG2表達60%水平處為閾值,DSG2表達≥60%組患者無復發生存率高于DSG2表達<60%組患者,差異有統計學意義(見圖3B,P=0.01);DSG2表達<60%患者生化復發中值時間為104個月,而DSG2表達≥60%患者在120個月隨訪期結束后尚未達到生化復發中值時間。總之,鈣E-cadherin和DSG2表達降低與前列腺癌生化復發有關,有望成為前列腺癌侵襲性的預后因子。
前列腺癌組織中pAkt表達水平(67%)高于正常前列腺組織(38%)。pAkt陰性前列腺癌患者無復發存活率高于pAkt陽性前列腺癌患者(見圖3C,P= 0.038),差異有統計學意義。pAkt陽性患者生化復發中值時間為106個月,而pAkt陰性患者在120個月隨訪期結束后尚未達到生化復發中值時間。采用同樣方法測定Snail表達,結果發現前列腺癌組織Snail表達略高于正常前列腺組織(64% vs 60%);Snail陰性前列腺癌患者無復發存活率比陽性患者要高,但差異無統計學意義(見圖3D,P=0.263)。Snail陽性患者生化復發中值時間為106個月,而陰性患者在120個月隨訪期接受后尚未達到生化復發中值時間。綜合上述結果發現pAkt表達與前列腺癌生化復發有關,且這種相關性具有統計學意義,表明pAkt能夠作為前列腺癌侵襲性的預后因子。盡管如此,綜合本次結果表明E-cadherin和DSG2是更為有效的前列腺癌預后因子。
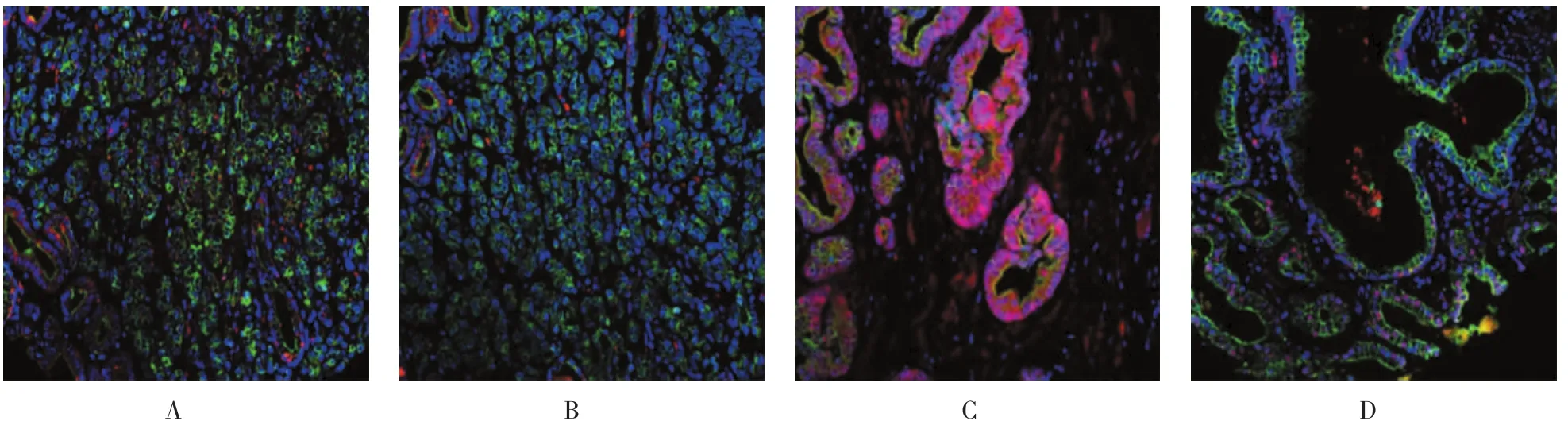
圖2 免疫熒光檢測E-cadherin、DSG2、pAkt和Snail等蛋白在前列腺癌組織中的表達情況
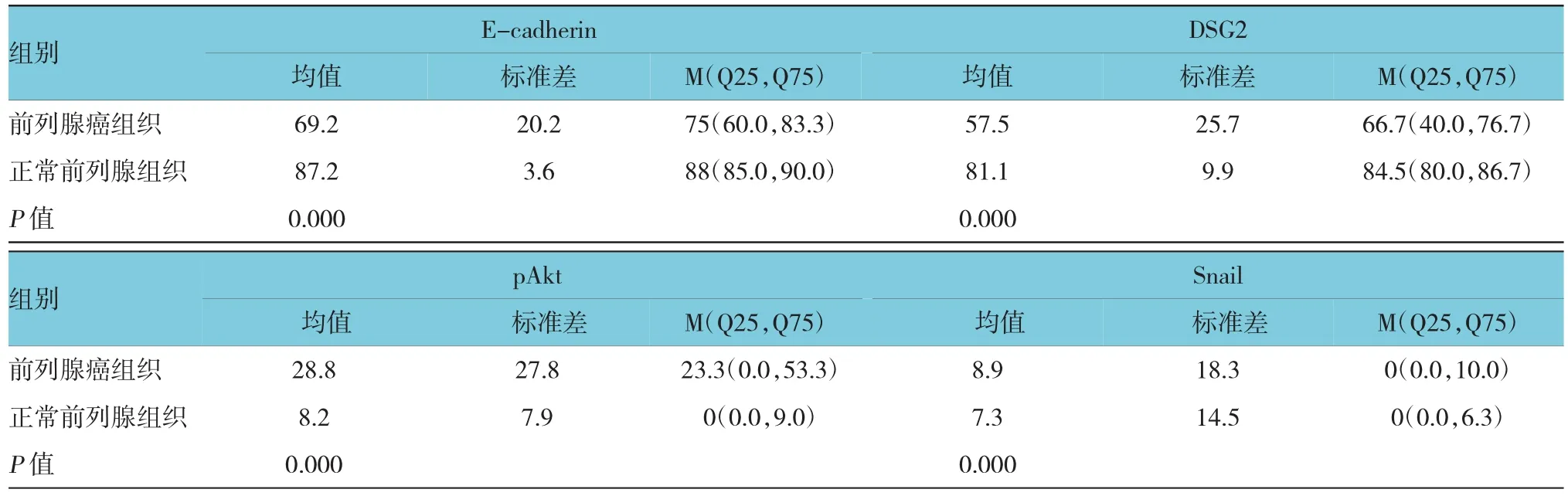
表2 前列腺癌組織中E-cadherin、DSG2、pAkt和Snail蛋白的表達情況
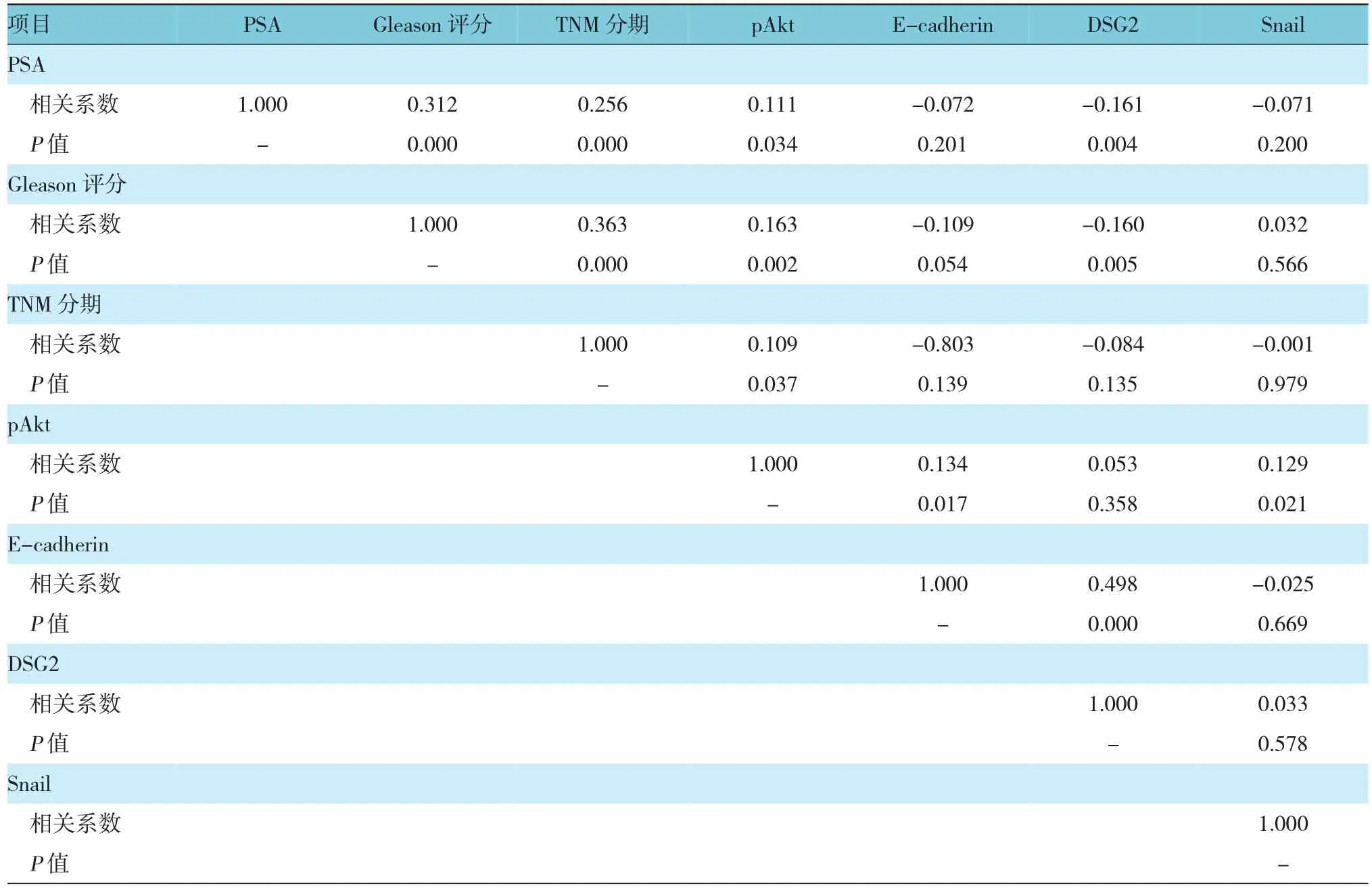
表3 各種蛋白表達關系及蛋白表達與前列腺癌臨床病理學侵襲性特征的關系

圖3 4種蛋白與前列腺癌生化復發之間的關系
3 討論
PI3K/Akt信號通路可能通過Snail介導前列腺癌E-cadherin轉錄抑制,而對DSG2表達無影響,此外,E-cadherin與DSG2表達調控無關[7]。本研究采用Spearman秩相關結果分析發現E-cadherin和Snail之間存在微弱負相關。這些結果提示Snail可能是前列腺癌E-cadherin表達的轉錄抑制因子,但與DSG2表達抑制無關。本研究pAkt和E-cadherin表達呈弱顯著正相關,與以往研究結果不一致[8],提示PI3K/Akt通路雖然抑制E-cadherin轉錄,但是pAkt和E-cadherin表達確呈弱顯著正相關,提示前列腺癌中還存在其他E-cadherin表達抑制機制。
雖然研究證實前列腺癌中E-cadherin表達缺失,但關于鈣黏蛋白在前列腺癌侵襲性預測中的應用還沒有大規模研究。此外,目前未見關于前列腺癌橋粒鈣黏蛋白表達的研究報道。黏合連接和橋粒參與前列腺上皮細胞間黏連[9-10],因而了解典型鈣黏蛋白和橋粒鈣黏蛋白的表達將有助于深入探索錨定連接在前列腺癌發展過程中的作用。本研究發現與正常前列腺組織比較,前列腺癌組織中DSG2表達顯著降低。此外,DSG2在腫瘤高分化區表達水平高,在腫瘤低分化區表達水平低,與E-cadherin分布相似。Spearman秩相關分析結果顯示E-cadherin和DSG2表達呈顯著正相關,E-cadherin及DSG2和血清PSA濃度、Gleason評分及病理分期呈負相關。Kaplan- Meier存活曲線結果進一步表明E-cadherin和DSG2等鈣黏蛋白低表達腫瘤細胞更可能有侵襲性,比鈣黏蛋白高表達細胞發生轉移風險更高,這些發現證實E-cadherin和DSG2等鈣黏蛋白在前列腺癌發展中發揮關鍵作用,E-cadherin和DSG2有望成為侵襲性前列腺癌的預后因子。
參考文獻:
[1]陳靖,牛遠杰.前列腺癌進展的相關基因分子變化[J].醫學綜述, 2011, 3(1): 368-370.
[2] Leidinger P, Keller A, Milchram L, et al. Combination of autoantibody signature with PSA level enables a highly accurate Blood-Based differentiation of prostate cancer patients from patients with benign prostatic hyperplasia[J]. PloS one, 2015, 10(6): e0128235.
[3] Shukla S, Bhaskaran N, Babcook MA, et al. Apigenin inhibits prostate cancer progression in TRAMP miceviatargeting PI3K/Akt/FoxO pathway[J]. Carcinogenesis, 2014, 35(2): 452-460.
[4]薄海.前列消癥湯治療激素難治性前列腺癌及調控PI3K/Akt傳導通路的分子機制[D].中國中醫科學院, 2013.
[5]劉祎,陳先國,梁朝朝.前列腺癌腫瘤組織中E-cadherin和N-cadherin的表達及意義[J].中華男科學雜志, 2014, 20(9): 781-786.
[6] Chao Y, Wu Q, Shepard C, et al. Hepatocyte induced re-expression of E-cadherin in breast and prostate cancer cells increases chemoresistance [J]. Clinical & Experimental Metastasis, 2012, 29(1): 39-50.
[7] Kume K, Haraguchi M, Hijioka H, et al. The transcription factor Snail enhanced the degradation of E-cadherin and desmoglein 2 in oral squamous cell carcinoma cells[J]. Biochemical and Biophysical Research Communications, 2013, 430(3): 889-894.
[8] Zhang HF, Alshareef A, Wu C, et al. Loss of miR-200b promotes invasion via activating the Kindlin-2/integrin β1/AKT pathway in esophageal squamous cell carcinoma: An E-cadherin-independent mechanism[J]. Oncotarget, 2015, 6(30): 28949-28960.
[9] Franzen CA, Todorovi? V, Desai BV, et al. The desmosomal armadillo protein plakoglobin regulates prostate cancer cell adhesion and motility through vitronectin-dependent Src signaling[J]. PloS one, 2012, 7(7): e42132.
[10] Chitaev NA, Troyanovsky SM. Direct Ca2+-dependent heterophilic interaction between desmosomal cadherins, desmoglein and desmocollin, contributes to cell-cell adhesion[J]. The Journal of Cell Biology, 1997, 138(1): 193-201.
(張蕾編輯)
論著
Role of E-cadherin, DSG2, pAKT, and Snail in aggressive prostate cancer
Xiao-gen Kuang, Hui-hui Zhang, Han-feng Xu, Qing Li, You-han Cao
(Department of Urology, the First Affiliated Hospital, Nanhua University, Hengyang, Hunan 421001, China)
Abstract:Objective To investigate the roles of E-cadherin, DSG2, pAKT, and Snail in the development of prostate cancer, and to explore the potential association between E-cadherin, DSG2, pAKT, and Snail and the progression of prostate cancer.Methods The expression of E-cadherin, DSG2, pAKT and Snail in prostate cancer tissues was assessed by tissue microarrays. Results Compared with normal prostate, a significant decrease in the expression of E-cadherin was found in prostate cancer. The pAKT expression was detected in both cytoplasm and nucleus and was generally high in both well and poorly differentiated areas of the tumor. A strong and significant positive correlation between the expression of E-cadherin and DSG2 was found. Decreased expression of both E-cadherin and DSG2 was related to increased level of serum PSA concentration, higher Gleason scores and advanced pathological stage. Conclusions Tumor cells with reduced cadherin expression are more likely to be aggressive and have a greater potential for metastatic behavior. Cadherin plays a critical role in the progression of prostate cancer, and both E-cadherin and DSG2 may be useful prognostic markers of aggressive prostate cancer.
Keywords:prostate cancer; prognosis; tissue microarray; E-cadherin; DSG2; pAKT; Snail
收稿日期:2015-11-19
文章編號:1005-8982(2016)08-0038-06
DOI:10.3969/j.issn.1005-8982.2016.08.008
中圖分類號:R737.25
文獻標識碼:A

