MicroRNA—421的相對水平表達與乳腺癌預后之間的相關性研究
肖安 彭蓉蓉
[摘要] 目的 本研究旨在進一步研究闡明MicroRNA-421相對表達量與乳腺癌發生、發展及預后的關系。 方法 我院乳腺外科行乳腺癌手術切除患者的病例樣本共計96例(從2012年1月~2015年1月),對96例乳腺癌病例采用逆轉錄實時定量聚合酶鏈反應(RT-PCR)的方法對MicroRNA-421的相對表達量進行檢測,運用Kaplan-Meier的生存曲線對腫瘤切除術后患者的生存情況進行分析。 結果 MicroRNA-421相對表達量與患者的年齡、性別、分化、瘤組織大小等并不存在相關性(t=1.52,P=0.32;t=0.42,P=0.75;t=1.28,P=0.94;t=-1.22,P=0.12);而遠處轉移方面,遠處轉移組的MicroRNA-421相對表達量明顯下調(t=2.93,P=0.01<0.05),而無遠處轉移組的相對表達量與正常組比較,差異無統計學意義(t=1.36,P=0.98>0.05),MicroRNA-421相對表達量明顯下調與遠處轉移的風險有關;生存分析方面,42例MicroRNA-421相對表達量明顯下調的患者中生存時間為(37.34±10.90)個月,而MicroRNA-421高表達的患者生存時間為(54.23±12.43)個月,兩組比較差異具有統計學意義(P<0.05),MicroRNA-421表達的高低與預后有著一定的相關性。 結論 MicroRNA-421相對表達量水平與乳腺癌的遠處轉移及預后有著相關性,MicroRNA-421的下調可能有潛在抑癌基因的作用,可作為乳腺癌診斷和預后的新型標志物,需要進一步的研究驗證。
[關鍵詞] 乳腺癌;MicroRNA-421;下調;預后
[中圖分類號] R737.9 [文獻標識碼] A [文章編號] 1673-9701(2016)08-0022-04
乳腺癌是來源于上皮組織最常見的惡性腫瘤之一,我國的乳腺癌發病率一直居高不下,每年死于乳腺癌的患者超過26萬,每年新發的乳腺癌約為100萬例,盡管對乳腺癌的診斷和治療技術不斷的提高,但是該病的預后仍不理想,多數患者患病后初次就診已經伴有廣泛的淋巴結轉移或者遠端的轉移,就已處于該病的晚期,失去根治手術的機會,耽誤了治療的最佳的時機,早期診斷對疾病的及時發現及治療具有重要的臨床意義[1-3]。MicroRNA是一類長度約為22nt的單鏈非編碼的小分子RNA,通過與靶基因mRNA-3UTR結合,降低或抑制mRNA的翻譯,從而起到負向調節基因表達的作用。目前普遍認為MicroRNA在致癌和抑癌方面有著重要的調控作用,對腫瘤的發生發展起著關鍵性作用,為此學術界對MicroRNA進行不斷深入研究,與乳腺癌相關的越來越多的MicroRNA被發現,提高了乳腺癌診斷和治療的水平[4,5]。為了探討MicroRNA與乳腺癌的相關性,我們前期通過基因芯片技術,檢測乳腺癌的MicroRNA表達譜,對其配對樣本的患者芯片進行分析,實驗研究發現乳腺癌組織與正常胃組織相比,上調的MicroRNA共有57個,其中上調>2倍的有14個,下調的MicroRNA共有42個,其中下調>2倍的有12個,其中MicroRNA-421下調最明顯,下調了8.25倍。因此推測MicroRNA-421在乳腺癌的發病中通過下調表達而作為抑癌基因發揮腫瘤調控作用。初步確定MicroRNA-421作為研究的重點,為進一步闡明乳腺癌發病病理因素及生存預后與MicroRNA-421相對表達量之間的關系,納入我院普外科行乳腺癌手術切除患者的病例樣本共計96例,對96例乳腺癌病例采用逆轉錄實時定量聚合酶鏈反應法對MicroRNA-421的相對表達量進行檢測,運用Kaplan-Meier生存曲線對腫瘤切除術后患者的生存情況進行分析,初步探討MicroRNA-421的表達與乳腺癌的發生發展之間的作用關系,為進一步的靶基因預測等深入研究奠定基礎。
1 對象與方法
1.1 研究對象
納入我院2012年1月~2015年1月乳腺外科行乳腺癌手術切除患者的病例樣本共計96例,通過病理診斷分析均為原發性乳腺癌,所有患者均為初診,術前未進行任何放療、化療及分子靶向治療等。年齡38~56歲,平均(46.34±1.13)歲。收集標本前該臨床試驗研究通過了醫院倫理委員會的批準,所有病例患者簽訂知情同意書。在術中取材之后,腫瘤位置以病理組織報告為標準,將樣本立即放置入液氮罐中保存,轉入-80℃冰箱長期保存,在實驗前取出,提取乳腺癌組織的MicroRNA,同時進行病理學的監測,對乳腺癌組織的病理學進行分型,腫瘤的浸潤程度按照國際抗癌聯盟標準分類,淋巴分化以及轉移采用國際WHO的診斷標準進行分析判斷,對所有手術治療的患者從出院到死亡進行隨訪觀察,以1年內每3個月1次、2年內每半年1次進行隨防,終生隨訪。
1.2 實驗試劑和儀器
1.2.1 試劑 Platinum SYBR Green qPCR SuperMix-UDG(美國Invitroge公司),TaqMix(東盛生物公司),PCR試劑盒、TaqMan miRNA試劑盒(美國Santa Cruz公司),RNA提取試劑盒采用(美國Sigma),DEPC(上海碧云天生物),乙醇、異丙醇、氯仿(上海碩盟生物)。
1.2.2 儀器 倒置相差顯微鏡(日本奧林巴斯),高速冷凍離心機(德國Biofuge Stratos),-80℃、-4℃冰箱(日本松下),高壓消毒箱(美國Tuttnauer),轉膜儀及電泳儀(美國伯樂公司),PCR儀(澳大利亞Rotor-gene),紫外分光光度儀(Beckman Coulter 公司)。
1.3 RNA提取及RT-PCR反應
對乳腺癌組織采用RNA提取試劑盒進行RNA提取,采用TaqMan MicroRNA試劑盒檢測MicroRNA-421在患者乳腺癌組織中的表達情況。內參校正:RT-PCR反應每個樣本量取10 ng的RNA提取量,由于實驗測試過程中受到RNA逆轉錄效率、RNA濃度定量誤差以及每個樣品等體積的cDNA的含量不同等系統誤差的影響,我們采用RNU6作為實驗內參。對MicroRNA-421的表達水平采用二步法進行檢測,第一步是通過莖環引物來合成互補cDNA,再通過MicroRNA的逆轉錄系統對10 ng RNA進行逆轉了反應體系進行反應,在PCR管加入10 μL的逆轉錄緩沖液,總的RNA濃度調整到2 ng/μL,最后加入5 μL的逆轉錄引物,在冰上混勻之后反應5 min,接著進行梯度變性反應,94℃、30 s,60℃、30 s,72℃、60 s,72℃、7 min遞減,第二步采用Platinum SYBR Green qPCR的反應體系,反應體系為2×的 PCR Taqman Universal的混合液以及Taqman miRNA的特異性引物,通過逆轉錄體系進行反應,cDNA共5 μL加入到RNA的去酶的水當中,將體積擴增至20 μL,通過循環反應94℃、30 s,60℃、30 s,72℃、60 s,72℃、7 min遞減的擴張40個循環之后,對實驗結果進行分析,采用實時定量反應,按照PCR操作說明,Ct的檢測值應當在20~32之外的需要進行第二次檢測。應用ΔCt=CtMicroRNA-421-CtRNU6的計算公式計算MicroRNA-421的相對表達量。
1.4 統計學方法
應用SPSS 21.0統計學軟件全部數據建立數據文件,將MicroRNA-421表達水平分為兩組,小于平均值為低表達組,大于平均值作為高表達組。通過分析MicroRNA-421的表達水平高低與發病相關因素分析以逐步回歸法篩選有統計學意義的變量,對臨床病理因素之間的風險情況采用Logistic回歸分析,計量資料以均數±標準差表示,組間均數比較采用t檢驗或方差分析,組間率的比較用χ2檢驗,P<0.05為差異有統計學意義。
2 結果
2.1 MicroRNA-421的相對表達量與臨床病理特征之間的相關性
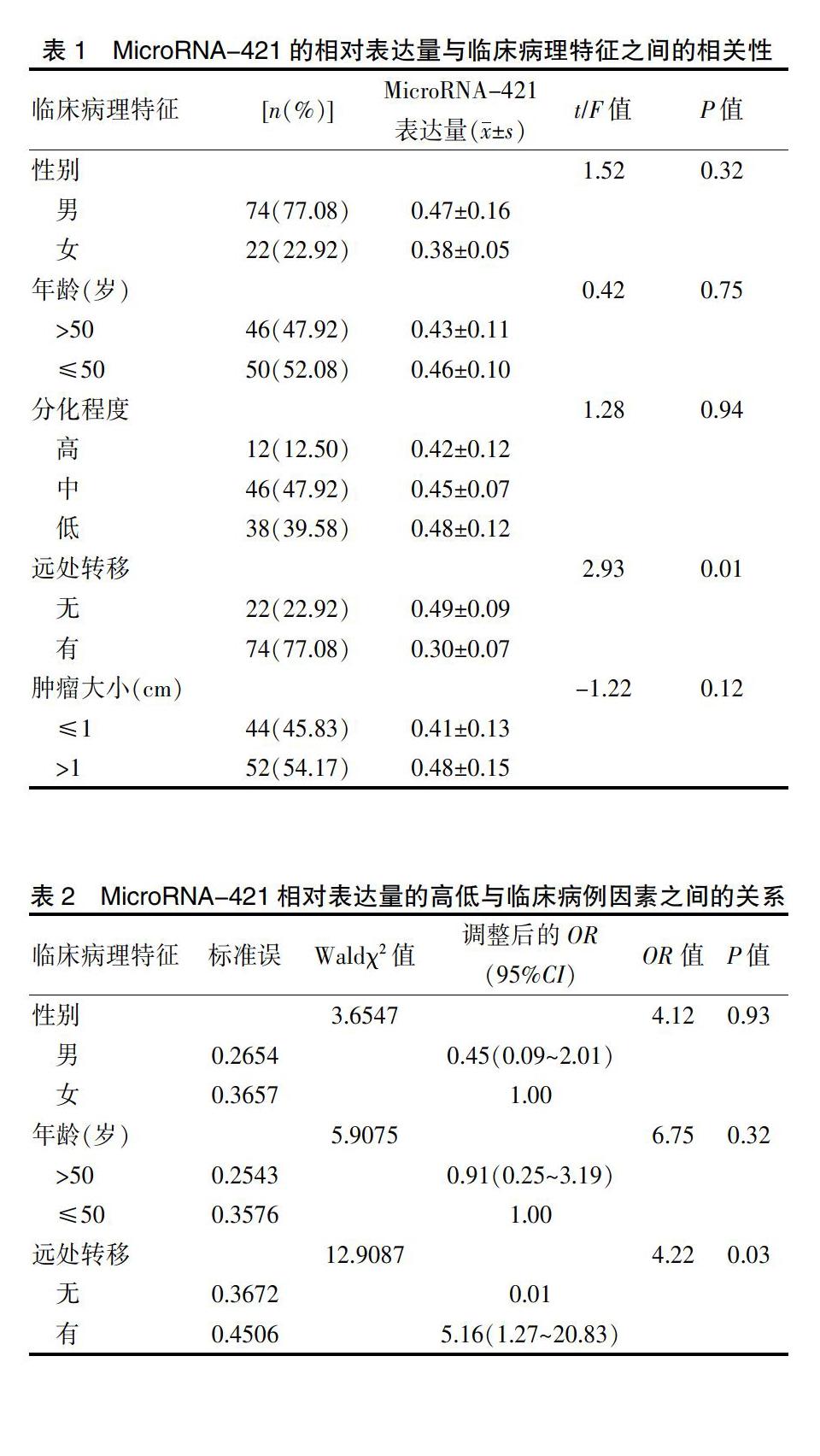
乳腺癌組織的MicroRNA-421的相對表達量為0.436(95%CI 0.323~0.534),表達量低于平均值42例,高于平均值54例,MicroRNA-421相對表達量與患者的年齡、性別、分化程度、瘤組織大小并不存在相關性(P>0.05);而在遠處轉移方面,遠處轉移組的MicroRNA-421相對表達量明顯下調(P<0.05),而無遠處轉移組的相對表達量與正常組相比差異無統計學意義(P>0.05),MicroRNA-421相對表達量明顯下調與遠處轉移的風險有關,見表1。
2.2 MicroRNA-421相對表達量的高低與臨床病理因素之間的關系
采用Logistic回歸分析方法分析MicroRNA-421相對表達量的高低與臨床病理因素之間的相關性,MicroRNA-421相對表達量的高低增加了遠處轉移的風險(OR=5.16,95%CI為1.27~20.83,P=0.03),見表2。
2.3 MicroRNA-421的相對表達量與預后之間的相關性
96例乳腺癌組織的MicroRNA-421的相對表達量為0.436,95%CI為(0.323~0.534)表達量低于平均值42例,高于平均值54例,MicroRNA-421相對表達量明顯下調的患者中生存時間為(37.34±10.90)個月,而MicroRNA-421高表達的患者生存時間為(54.23±12.43)個月,兩組比較差異具有統計學意義(t=2.398,P=0.026),MicroRNA-421表達的高低與預后有著一定的相關性,見封三圖5。
3 討論
乳腺癌是女性高發惡性腫瘤,中國抗癌協會公布的統計數字顯示,我國主要城市10年來乳腺癌發病率增長了37%,死亡率增長了38.9%。2011年美國CA雜志(A Cancer Journal for Clinicians雜志,2010年影響因子94.262)公布的最新統計數據顯示,美國2011年預計將有230 480例女性罹患乳腺癌,占女性新發惡性腫瘤的30%,大部分乳腺癌患者初次入院檢查已經是中晚期,因此探求研究乳腺癌發病的機制具有重要的現實意義[6-10]。通過大量的臨床研究發現,MicroRNA是一類能夠調節多種靶基因發揮生物學效應的重要分子,也是目前腫瘤分子機制的研究熱點內容[11-13]。最近研究發現MicroRNA作為新型的非編碼的單鏈RNA在乳腺癌標志的研究當中取得了一定的進展,已有研究發現,乳腺癌異性的MicroRNA表達譜可用于腫瘤的診斷和分型當中,差異性表達的MicroRNA對乳腺癌的亞型、轉移以及病理改變具有重要的意義,尤其是在術后復發率及生存期應用中可起到預后評估的作用。研究還提示MicroRNA相對表達量與乳腺癌的發展及預后有著重要關系,組織分型結果可見,其中MicroRNA-125b、MicroRNA-56a、MicroRNA-33的高表達對于乳腺癌的遠處轉移有著重要的價值。MicroRNA涉及到各類腫瘤的發生發展,且MicroRNA的表達譜還決定著腫瘤基因表達,在腫瘤亞型、轉移等臨床病理因素中發揮著重要作用,尤其對于術后的生存期及預后具有一定的相關性,研究提示了MicroRNA可以用于對腫瘤預后的評估,其表達量與腫瘤的預后有著一定的相關性[14,15]。
MicroRNA所具有的腫瘤調控作用是通過與其靶向的MicroRNA的MicroRNA-3UTR結合活編碼區的子序列堿基配對相關,主要通過負調控MicroRNA對整個相關基因表達體系發揮著精細調節的作用[19]。通過負調控靶基因,而促進靶基因的抑制作用,進而促進了腫瘤的發生發展,而抑制過表達的MicroRNA,可以抑制腫瘤細胞的增殖和遷移侵襲能力。我們通過高通量篩選技術篩查出了與乳腺癌相關的Micro- RNA-421,該分子是MicroRNA-200家族中的重要成員,其編碼定位在人的1號染色體(1p34.23)上,多種腫瘤都出現該區域,以往研究發現MicroRNA-421在不同腫瘤組織中均有差異性表達,其調控功能也有所不同[16,17]。有文獻報道MicroRNA-421的下調在結腸癌、乳腺癌、宮頸癌等中具有預后判斷價值。研究還發現在膀胱癌中MicroRNA-421表達的下調可作為膀胱癌晚期的標志性分子[18],過表達的MicroRNA-421可以子宮內膜癌的發生,還可提高順鉑對子宮內膜癌的細胞毒作用,提示MicroRNA-421在腫瘤的調控中具有重要的作用。本研究主要探討MicroRNA-421在乳腺癌中發生和轉移中的作用,結果顯示MicroRNA-421相對表達量與患者的年齡、性別、分化程度及瘤組織大小等并不存在相關性(P>0.05);而在遠處轉移方面,遠處轉移組的MicroRNA-421相對表達量明顯下調,而無遠處轉移組的相對表達量與正常組相比差異無統計學意義(P>0.05),MicroRNA-421相對表達量明顯下調與遠處轉移的風險有關;在生存分析方面,42例MicroRNA-421相對表達量明顯下調的患者中位生存時間為(37.34±10.90)個月,而MicroRNA-421高表達的患者生存時間為(54.23±12.43)個月,MicroRNA-421表達的高低與預后有著一定的相關性。
綜上所述,我們發現MicroRNA-421在乳腺癌中表達下調,與組織分化及預后有著密切的相關性,提示MicroRNA-421可能與乳腺癌的轉移侵襲等影響預后的因素有關,該分子差異性表達推測其可能是乳腺癌早期的潛在靶點,但是本研究不足的是病例數還相對較少,MicroRNA-421在乳腺癌中的作用機制及靶基因生物學預測和闡明有待于進一步研究。
[參考文獻]
[1] Brandl A,Wittmann J,J?覿ck HM. A facile method to increase titers of MicroRNA-encoding retroviruses by inhibition of the RNaseIII enzyme Drosha[J]. Eur J Immunol,2012, 41(2):549-551.
[2] Min H,Yoon S. Got target Computational methods for microRNA target prediction and their extension[J]. Exp Mol Med,2013,42(4):233-244.
[3] Maere S,Heymans K,Kuiper M. BiNGO:A Cytoscape plugin to assess overrepresentation of gene ontology categories in biological networks[J]. Bioinformatics,2014,21(16):3448-3449.
[4] Sethupathy P,Megraw M,Hatzigeorgiou AG. A guide through present computational approaches for the identification of mammalian microRNA targets[J]. Nat Methods,2011,3(11):881-886.
[5] Fassi Fehri L,Koch M,Belogolova E,et al. Helicobacter pylori induces miR-155 in T cells in a cAMP-Foxp3-dependent manner[J]. PLoS One,2010,5(3):e9500.
[6] Valeri N,Gasparini P,Fabbri M,et al. Modulation of mismatch repair and genomic stability by miR-155[J]. Proc Natl Acad Sci USA,2011,107(15):6982-6987.
[7] Du Y,Xu Y,Ding L,et al. Down-regulation of miR-141 in gastric cancer and its involvement in cell growth[J]. J Gastroenterol,2009,44(6):556-561.
[8] Ueda T,Volinia S,Okumura H,et al. Relation between microRNA expression and progression and prognosis of gastric cancer:A microRNA expression analysis[J]. Lancet Oncol,2013,11(2):136-146.
[9] Wu CX,Zheng Y,Bao PP. Pattern of changing incidence of gastric cancer and its time trend in Shanghai[J]. J Sur Concepts Prat,2012,13(1):24-29.
[10] Lee JW,Park YA,Choi JJ,et al. The expression of the miRNA-200 family in endometrial endometrioid carcinoma[J]. Gynecol Oncol,2014,120(1):56-62.
[11] Bockmeyer CL,Christgen M,Müller M,et al. MicroRNA profiles of healthy basal and luminal mammary epithelial cells are distinct and reflected in different breast cancer subtypes[J]. Breast Cancer Res Treat,2011,130(3):735-745.
[12] Sun T,Wang C,Xing J,et al. MiR-429 modulates the expression of c-myc in human gastric carcinoma cells[J]. Eur J Cancer,2012,47(17):2552-2559.
[13] Mees ST,Mardin WA,Wendel C,et al. EP300-a miRNA-regulated metastasis suppressor gene in ductal adenocarcinomas of the pancreas[J]. Int J Cancer,2010,126(1):114-124.
[14] Baek D,Villén J,Shin C,et al. The impact of microRNAs on protein output[J]. Nature,2013,455(7209):64-71.
[15] Ouyang G,Wang Z,Fang X,et al. Molecular signaling of the epithelial to mesenchymal transition in generating and maintaining cancer stem cells[J]. Cell Mol Life Sci,2010,67(15):2605-2618.
[16] Manning G,Whyte DB,Martinez R,et al. The protein kinase complement of the human genome[J]. Science,2012, 298(5600):1912-1934.
[17] Krishnamachary B,Zagzag D,Nagasawa H,et al. Hypoxia-inducible factor-1-dependent repression of E-cadherin in von Hippel-Lin-dau tumor suppressor-null renal cell carcinoma mediated by TCF3,ZFHX1A,and ZFHX1B[J].Cancer Res,2011,66(5):2725-2731.
[18] Krek A,Grun D,Poy MN,et al. Combinatorial microRNA target predictions[J]. Nat Genet,2005,37(5):495-500.
[19] Ohashi S,Natsuizaka M,Naganuma S,et al. A NOTCH3-mediated squamous cell differentiation program limits expansion of EMT-competent cells that express the ZEB transcription factors[J]. Cancer Res,2013,71(21):6836-6847.
(收稿日期:2015-09-02)

