絲素蛋白三維支架與骨髓間充質干細胞的生物相容性觀察
范青洪,余鋒,吳術紅,楊晉,金瑛,劉毅
(1遵義醫學院附屬醫院,貴州遵義563000;2仁懷市人民醫院)
絲素蛋白三維支架與骨髓間充質干細胞的生物相容性觀察
范青洪1,余鋒2,吳術紅1,楊晉1,金瑛1,劉毅1
(1遵義醫學院附屬醫院,貴州遵義563000;2仁懷市人民醫院)
目的 制備絲素蛋白三維支架,并與大鼠骨髓間充質干細胞(MSCs)復合培養,觀察二者的生物相容性。方法 將家用蠶絲反復脫膠,計算脫膠率;將脫膠的蠶絲溶于LiBr溶液中獲得絲素蛋白溶液,置于真空冷凍干燥機中作用24 h,獲得成型的絲素蛋白三維支架。液體置換法計算支架孔隙率;將該支架與MSCs復合培養,記錄支架降解1~8周降解液的pH值變化,MTT法檢測支架的細胞毒性(以吸光度值表示),掃描電鏡下觀察支架結構及MSCs生長情況。結果 平均脫膠率為20.72%,平均支架孔隙率為65.25%。復合培養1~8周降解液pH值分別為6.98、6.93、6.90、6.83、6.72、6.75、6.78、6.76。兩組吸光度值比較,P均>0.05。掃描電鏡下觀察到該支架具有三維空間結構,孔隙大小分布較均勻;復合物中可見MSCs在支架上生長良好,部分細胞嵌入支架孔隙中,與支架黏附良好;細胞外基質分泌量多,細胞與細胞間、細胞與支架間通過細胞外基質緊密相連。結論 成功制備絲素蛋白三維支架,該支架對MSCs無毒性作用,具有良好的生物相容性,是一種理想的韌帶組織工程學支架材料。
絲素蛋白三維支架;組織工程;骨髓間充質干細胞;生物相容性
組織工程技術是修復組織或器官缺損的一種新方法,是目前醫學研究的熱點。不同組織或器官缺損修復所需要的種子細胞與支架不同,而種子細胞、支架材料以及二者的復合是組織工程技術的三大核心點。大鼠骨髓間充質干細胞(MSCs)是目前研究較為成熟的種子細胞之一,絲素蛋白為天然高分子纖維蛋白,具有良好的生物相容性和力學特性[1]。2013年3月~2014年12月,本研究采用冷凍真空干燥法制備絲素蛋白三維支架,并觀察其與MSCs復合培養的生物相容性。
1 材料與方法
1.1 材料 天然蠶絲由西南大學紡織學院提供。LG-DMEM培養基:LG-DMEM粉劑10 g、HEPES 3.2 g,三蒸水攪拌混勻,定容至1 000 mL;將pH值調至7.2,濾膜過濾(0.22 μm)滅菌,分裝后4 ℃保存。完全培養基:10 mL胎牛血清、1 mL雙抗(青霉素、鏈霉素各100 U/mL)、1 mL谷氨酰胺及88 mL LG-DMEM培養基。MTT溶液:MTT粉末250 mg+PBS緩沖液50 mL,濃度5 mg/mL,避光保存。真空冷凍干燥機購于無錫市海昌機械設備有限公司。
1.2 實驗方法
1.2.1 絲素蛋白三維支架制備 采用冷凍真空干燥法。稱取蠶絲,采用Na2CO3作為脫膠劑,脫膠條件:試劑濃度0.4%,溫度98 ℃,脫膠時間30 min,水浴比為1∶100。連續脫膠2次,取出脫膠后的蠶絲,用三蒸水洗凈,置入56 ℃烘箱中烘干,稱質量。取2 g脫膠后的蠶絲溶于9 mol/L LiBr溶液,水浴比為1∶50。溶絲過程中不斷均勻攪拌,并適當加熱,待完全溶解后冷卻至室溫。倒入中等分子量半透膜中,兩端封閉,以流水透析72 h。收集透析袋中的溶液,即為絲素蛋白溶液,4 ℃保存備用。將上述絲素蛋白溶液用三蒸水稀釋至100 mL,配成濃度為2%的絲素蛋白溶液;分裝到24孔細胞培養板中(底面直徑約1.56 mm,厚度約5 mm),-80 ℃冰箱中過夜。在放入真空冷凍干燥機前一天,取出該24孔板,棄去孔板上蓋,以封口膜完全封閉,用粗針頭在封口膜上戳3~5個小孔,繼續-80 ℃保存。當絲素蛋白凝固后迅速放入真空冷凍干燥機中,作用條件:溫度-50 ℃,壓力0.5 MPa,持續時間24 h。取出模板,即可獲得成形的絲素蛋白三維支架。
1.2.2 絲素蛋白三維支架與MSCs的體外復合培養 取上述支架,干燥后環氧乙烷消毒,無菌條件下干燥后保存;在支架與MSCs復合前一夜,無菌條件下將支架取出放入6孔板中,用含10%胎牛血清的LG-DMEM培養基浸潤、包被,使培養基充分浸入支架,超凈臺中過夜。將MSCs按1×106/mL接種于支架上,采用半換液方式2~3天換液一次,每次換液量為原培養液的1/2~2/3。
1.3 相關指標觀察
1.3.1 脫膠率 根據脫膠前后蠶絲的質量,計算脫膠率;重復6次,取平均值。
1.3.2 支架孔隙率 采用液體置換法。取10 mL正乙烷,記錄體積為V1;將1個支架放入正乙烷中,作用10 min,確保支架完全浸入正乙烷中,記錄體積為V2;取出支架,記錄此時剩余正乙烷體積為V3。采用如下公式計算,支架孔隙率(%)=(V2-V1)/(V2-V3)×100%。重復5次,取平均值。
1.3.3 降解液pH值 將制備好的支架經環氧乙烷消毒后放入完全培養基中,觀察支架降解1~8周降解液的pH值變化情況。
1.3.4 細胞毒性 取上述支架作為觀察組,取MSCs進行常規培養作為對照組。采用MTT法檢測兩組培養第1、3、5、7、9天的吸光度值(A值),A值越高,說明細胞數量越多,支架對細胞的毒性越小。重復30次,取平均值。
1.3.5 支架結構及MSCs生長情況 將MSCs與支架復合培養至第5天,進行掃描電鏡下觀察。方法如下:沿培養孔壁完全吸去培養液,加入2.5%戊二醛溶液固定,要求溶液體積至少為復合物體積的5~10倍,作用2 h;吸出戊二醛,D-PBS液洗滌3次;經梯度乙醇脫水、中間液代換、臨界點干燥后,用導電膠將樣品黏貼在樣品臺上,觀察面朝上。采用離子濺射真空鍍膜法噴鍍導電金屬,完成鍍金后,掃描電鏡下觀察支架結構及MSCs生長情況。
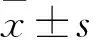
2 結果
2.1 脫膠率及支架孔隙率 6次脫膠率檢測分別為21.49%、19.74%、21.45%、19.89%、20.98%、20.79%,平均脫膠率為20.72%。5次支架孔隙率檢測分別為65.63%、65.71%、67.86%、62.96%、64.10%,平均支架孔隙率為65.25%。
2.2 降解液pH值 支架降解1~8周降解液pH值分別為6.98、6.93、6.90、6.83、6.72、6.75、6.78、6.76。
2.3 細胞毒性 觀察組及對照組培養第1、3、5、7、9天的A值比較,P均>0.05。見表1。

表1 觀察組及對照組細胞毒性比較
2.4 支架結構及MSCs生長情況 掃描電鏡下觀察到該支架具有三維空間結構,孔隙大小分布均勻。復合物中可見MSCs在支架上生長良好,部分細胞嵌入支架孔隙中,與支架黏附良好;細胞外基質分泌量多,細胞與細胞間、細胞與支架間通過細胞外基質緊密相連。
3 討論
臨床中將絲素纖維作為手術縫線已有100多年的歷史,除此以外,絲素蛋白還廣泛用于血管、角膜及其他生物醫用材料中[2]。研究表明,絲素蛋白具有良好的生物相容性和力學特性,且降解性能緩慢,是作為韌帶組織工程材料的最佳選擇之一[3~5]。蠶絲中的絲膠具有一定的免疫原性,故試驗中需要反復脫膠以減少絲膠殘留[6,7]。周燕等[8]研究表明,采用Na2CO3脫膠對絲素纖維的結構和降解性能有明顯影響,其濃度越大,纖維表面的刻蝕越顯著。本研究中,絲素平均脫膠率為20.72%,說明脫膠較徹底。
Greenwald等[9]將絲素纖維植入大鼠皮下6周后,發現其強力損失55%,彈性模量損失16%。Soong等[10]將絲素纖維和冷凍真空干燥法制成的絲素神經導管植入兔皮下24周,發現絲素神經導管質量基本損失,而絲素纖維質量減少到65.7%,但仍保持著完整的結構。以上均說明,絲素纖維是可以降解的,但降解速率可能與外界環境的理化作用、患者的生理特點、絲素纖維處理過程中蛋白質結構的變化等因素有關[11,12]。
支架的孔隙及孔隙率對細胞的生長、增殖及轉移具有重要意義。目前主要是通過掃描電鏡采集圖片以測量分析支架孔隙,或采用液體置換法計算孔隙率,而多大的孔隙率適合細胞的生長少見報道。楊亞冬等[13]研究發現,隨殼聚糖比例增加,支架孔隙減小,孔隙率明顯升高,但無論是大孔隙+小孔隙率,還是小孔隙+高孔隙率,其力學性能均不如將絲素/殼聚糖按5∶5及4∶6制成的支架。所以孔隙率的大小既不能影響骨架的力學性能,又要有利于營養物質與細胞基質的傳輸、轉移。本研究中支架的平均孔隙率為65.25%。理論上孔隙率越高,越有利于細胞的植入,但其力學特性也越小,而絲素蛋白濃度與孔隙率的具體關系及細胞生長所需的最佳孔隙率還有待進一步研究證實。
本研究中支架降解前5周pH值逐漸下降,最低時達到6.72;5周后pH值趨于穩定,均不超過6.80,該pH值變化對細胞生長幾乎無影響。而且觀察組和對照組培養第1、3、5、7、9天的A值比較無統計學差異,說明支架材料對MSCs無明顯毒性作用。掃描電鏡下觀察到該支架具有三維空間結構,孔隙大小分布均勻;復合物中可見MSCs在支架上生長良好,細胞外基質分泌量多,細胞與細胞間、細胞與支架間通過細胞外基質緊密相連。以上均說明絲素蛋白三維支架對大鼠MSCs具有良好的親和力及生物相容性,能促進細胞外基質的分泌,同時支架材料降解過程中對細胞無明顯毒性作用。
綜上所述,本研究成功獲得具有一定孔隙率的絲素蛋白三維支架,該支架對MSCs無毒性作用,具有良好的生物相容性,是一種理想的韌帶組織工程學支架材料。
[1] 劉毅,張承昊,范青洪,等.TGF-β1和bFGF-1對單層共培養MSCs和韌帶成纖維細胞韌帶特異性的影響[J].中國修復重建外科雜志,2014,28(11):1406-1412.
[2] Bucknall TE, Tearel L, Ellis H. The choice of a suture to close abdominal incisions[J]. Eur Surg Res, 1983,15(2):59-66.
[3] Cao Y, Wang B. Biodegradation of silk biomaterials[J]. Int J Mol Sci, 2009,10(4):1514-1524.
[4] Wang Y, Rudym DD, Walsh A, et al. In vivo degradation of three-dimensional silk fibroin scaffolds[J]. Biomaterials, 2008,29(24-25):3415-3428.
[5] Kim UJ, Park J, Kim HJ, et al. Three dimensional aqueous-derived biomaterial scaffolds from silk fibroin[J]. Biomaterials, 2005,26(15):2775-2785.
[6] Hartmann DJ, Charriere G, Richard-Blum S, et al. Immunogenicity of injectable collagen implants[J]. J Dermatol Surg Oncol,1990,16(4):394-398.
[7] Meinel L, Hofmann S, Karageorgiou V, et al. The inflammatory responses to silk films invitro and invivo[J]. Biomaterials, 2005,26(2):147-155.
[8] 周燕,吳惠英,左保齊.碳酸鈉質量濃度對蠶絲脫膠效果及絲素纖維結構與降解性能的影響[J].絲綢,2015,52(3):16-20.
[9] Greenwald D, Shumway S, Albear P, et al. Mechanical comparison of 10 suture materials before and after in vivo incubation[J]. J Surg Res, 1994,56(4):372-377.
[10] Soong HK, Kenyon KR. Adverse reactions to virgin silk sutures in cataract surgery[J] . Ophthalmology, 1984,91(5):479-483.
[11] Li M, Ogiso M, Minoura N. Enzymatic degradation behavior of porous silk fibroin sheets[J]. Biomaterials, 2003,24(2):357-365.
[12] Salthouse TN, Matlaga BF, Wykoff MH. Comparative tissue response to six suture materials in rabbit comea, sclera, and ocularmuscle[J]. Am J Ophthalmol, 1977,84(2):224-233.
[13] 楊亞冬,張文元,房國堅.絲素-殼聚糖復合制作的三維可降解多孔支架[J].中國組織工程研究與臨床康復,2009,13(51):100704-100708.
Biocompatibility between three dimensional silk fibroin scaffolds and BMSCs
FANQinghong1,YUFeng,WUShuhong,YANGJin,JINYing,LIUYi
(1TheAffiliatedHospitalofZunyiMedicalCollege,Zunyi563000,China)
Objective To prepare the three-dimensional (3-d) silk fibroin scaffolds and culture it with bone marrow mesenchymal stem cells (BMSCs), and to discuss the biocompatibility between them. Methods Degumming and calculating the loss rate, then dissolving the silk with LiBr to get the silk fibroin liquor. We put the silk fibroin liquor in vacuum freeze drying machine, and let it work for 24 hours under a specific condition to get the 3-d scaffolds. Measuring the porosity of the scaffold, culturing the scaffold with BMSCs, and PH of the medium from the first to eighth weeks was recorded. the cytotoxic effect was detected by MTT, and the framework and the growth of cells on the scaffold were observed by scanning electron microscope (SEM). Results The degumming percentage of silk fibroin was 20.72%, and the porosity of 3-d silk fibroin scaffolds was 65.25%. In the 1-8 weeks, the PH values were 6.98, 6.93, 6.90, 6.83, 6.72, 6.75, 6.78 and 6.76. No significant difference was found in the optical density between these two groups (P>0.05). Under SEM, the silk fibroin scaffold was 3-d, the pore size was homogeneous. BMSCs grew well in the silk fibroin scaffolds. It had good adhesion which showed the extracellular matrix secretion was enough, and cells and scaffolds were closely linked through extracellular matrix. Conclusions The 3-d scaffold is successfully prepared, which is non-toxic to BMSCs. It has good biocompatibility and might be an ideal scaffold material for the ligament tissue engineering.
three-dimensional silk fibroin scaffolds; tissue engineering; bone marrow mesenchymal stem cells; biocompatibility
貴州省科技廳社發攻關基金資助項目(黔科合SY[2010]3091號)。
范青洪(1987-),男,碩士,研究方向為四肢骨科與運動損傷。E-mail: fanqh110@126.com
劉毅(1962-),男,教授,研究方向為關節、創傷與運動醫學。E-mail: 13308529536@163.com
10.3969/j.issn.1002-266X.2016.16.002
R318.08
A
1002-266X(2016)16-0005-03
2015-11-17)

