關于硫酸性質與應用的系列問題(1)———透過硫酸分子結構理解其物理性質
?
關于硫酸性質與應用的系列問題(1)———透過硫酸分子結構理解其物理性質
◇北京王篤年
硫酸在現代社會生產和生活中有著重要的地位,從科學研究到工業生產,從中學化學教科書、實驗室到大眾文化,都不斷出現它的身影.硫酸產量是一個國家化學工業發展水平的重要標志.關于硫酸的性質與應用,是中學化學的基礎知識,但僅僅記住這些知識是不夠的;作為高中理科學生,應該根據硫酸的分子結構,深入理解硫酸的性質和應用.
1) 如何根據硫酸的分子結構理解其物理性質?
硫酸作為一種液態物質(熔點10.4 ℃,沸點337℃),其物理性質和一般的液體相比有很大的不同.黏稠、油狀、沸點極高、以任意比例溶解于水、溶解過程中釋放大量的熱……結構決定性質,讓我們先看看硫酸分子具有怎樣的結構,如圖1,2,3所示.
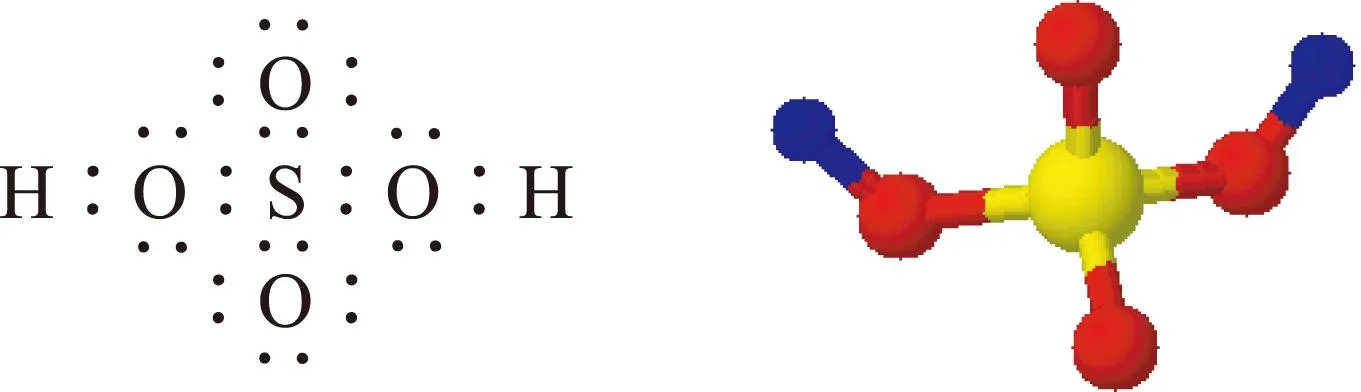
圖1 電子式 圖2 分子結構模型

圖3 結構式
硫酸分子內有4個氧原子以及2個和氧原子直接相連的氫原子(羥基氫原子),具備形成分子間氫鍵的條件,所以,硫酸自身分子之間存在大量的氫鍵作用,故沸點和一般的液體物質相比顯得非常高(相對分子質量接近的烷烴C7H16,熔點90.6℃,沸點98.4℃).由于硫酸分子之間作用力太強,以至于流動性減弱,顯得黏稠.
硫酸分子與水分子之間也可以形成大量氫鍵,故硫酸與水可以以任意比例混溶.由于形成氫鍵的過程釋放能量,所以硫酸溶于水的過程中會釋放大量的熱(該過程也包含破壞原來的“硫酸—硫酸”“水—水”分子間氫鍵,這2個過程會吸收能量,從實驗事實看,“硫酸—水”分子間形成氫鍵釋放的能量多于破壞原來的氫鍵所吸收的能量).硫酸具有強吸水性的原因,也和它容易與水分子間形成氫鍵有關.
純硫酸的密度為1.81g·cm-3,相對較大(相對分子質量接近的烷烴C7H16密度為0.7g·cm-3),顯然也與其分子間作用力強,彼此結合更緊密有關.
這里需要說明的是,油狀、黏稠的性狀和密度大小并無直接關聯.比如CCl4,它的密度很大(密度1.6g·cm-3),但并不黏稠,用滴管取用CCl4時可以看到,CCl4液滴比水滴小得多,又由于其密度大且與玻璃不易浸潤,一不小心很容易滴落到桌面上.
2) 硫酸的吸水性和脫水性有何區別與聯系?膽礬遇濃硫酸變白過程中,硫酸表現了吸水性還是脫水性?
一般認為,吸水性屬于硫酸的物理性質,而脫水性則屬于硫酸的化學性質,但又很難說清楚硫酸是如何表現其化學作用的,因為吸水、脫水前后,硫酸似乎都還是硫酸,只是濃度有所降低而已.宏觀上,從硫酸的角度看,似乎二者并無本質區別.其實不然,硫酸吸水雖然不能說就是簡單的物理過程(形成氫鍵屬于物理變化還是化學變化?這個問題存在爭議),但畢竟硫酸分子結合的是原本就獨立存在的H2O分子.相比而言,硫酸脫水的過程就很復雜了,比如硫酸使蔗糖脫水,硫酸一定參與了蔗糖脫水的反應過程,只是最終又恢復了原來的成分而已.蔗糖結構比較復雜,讓我們以乙醇脫水過程為例加以說明:
C2H5OH+HO—SO2—OH→
C2H5—O—SO2—OH(硫酸氫乙酯)+H2O,

在硫酸催化乙醇脫水反應中,硫酸的作用就是催化劑,其催化的本質就是脫水,所以傳統說法“催化劑、脫水劑”屬于重復敘述.
把膽礬加入濃硫酸中攪拌,藍色固體逐漸變白的過程中,硫酸表現了吸水性還是脫水性呢?讓我們借助如圖4所示實驗加以說明.
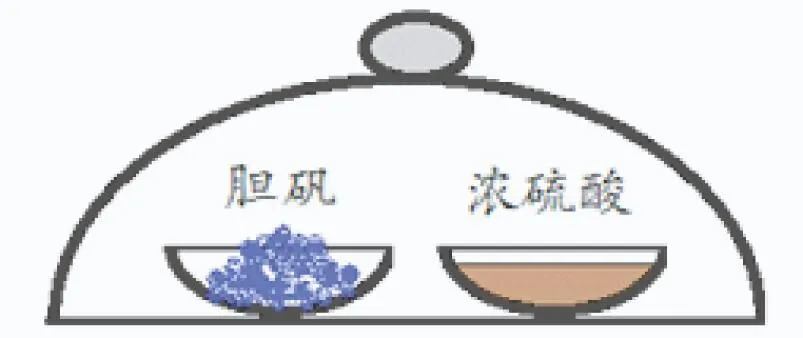
圖4
實驗表明,圖4所示密閉系統內,左側容器內的藍色的膽礬晶體經過很長一段時間后會變白,而右側容器內硫酸的濃度則會降低.那么此實驗中硫酸表現了吸水性還是脫水性呢?顯然是吸水性.若把硫酸和膽礬直接混合,膽礬變白的原理與這個實驗并無不同.
3) 何謂發煙硫酸?發煙硫酸發出的是煙嗎?
純硫酸具有吸收、溶解SO3的能力,硫酸工業正是根據這一點,利用98.3%的濃硫酸吸收SO3的,因為該溶解過程放熱少,且硫酸沸點高,不易導致硫酸沸騰產生酸霧.
吸收了過多SO3的硫酸就是發煙硫酸,吸收了過多SO3的發煙硫酸因SO3揮發,與空氣中的水蒸氣作用形成大量硫酸酸霧,肉眼難以辨別是煙還是霧,被稱為“發煙硫酸”.
(作者單位:北京十一學校)

