勒夏特列原理運用中的“特例”
?
勒夏特列原理運用中的“特例”
◇安徽湯偉(特級教師)張茹英
勒夏特列原理(即化學平衡移動原理)是化學學習過程中極為重要的原理,兩次諾貝爾獎得主鮑林曾告誡學生說:你可以忘記化學中的很多東西,但不要忘記勒夏特列原理!這足以說明勒夏特列原理的重要性.然而同學們在使用勒夏特列原理的時候,不能真正理解該定律為經驗規律,使用過程有一定的局限性和條件性,若使用不當,可能會走入一些誤區.
1“恒溫、恒壓”與“恒溫、恒容”的不同
勒夏特列原理指出,若增大反應物的濃度,平衡將向正反應方向移動.需要注意的是勒夏特列原理屬于經驗定律,主要適用于恒溫、恒容條件,而恒溫、恒壓條件下,增大一種反應物的濃度,另外一種反應物的濃度可能會減少,勒夏特列原理可能會失去其意義,此時,若借助化學平衡常數與濃度商的關系推斷,則更容易得出正確答案.

(1)N2(g)+3H2(g)2NH3(g),反應達到平衡后,測得NH3的物質的量為amol,保持容器內的溫度和壓強不變,向平衡體系中又通入少量的H2,再次達到平衡后,測得NH3的物質的量為bmol,請比較a、b的大小,并說明理由________.
(2) 上題中若向平衡體系中通入的是少量N2,請通過分析,討論a、b的大小________.
分析如果不仔細審題,未分清恒溫、恒壓還是恒溫、恒容條件,就會簡單地認為只要增加反應物的濃度,反應就會向正反應方向移動,生成物的物質的量一定增加.其實針對可逆反應的化學平衡體系,分析問題時要關注恒溫、恒壓還是恒溫、恒容條件,借助化學平衡常數,定量推算,可順利得解.
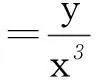
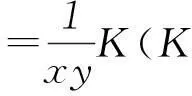
2固體或純液體對平衡體系不發生影響
勒夏特列原理研究的是可逆反應的體系,其中氣體及溶液一般可以借助濃度的變化情況分析其移動的方向,而在可逆反應體系中,若有固體物質存在,固體物質濃度一般設定為1,在化學平衡常數表達式中一般不書寫出來,故使用勒夏特列原理分析其可能反應時,要特別關注固體或純液體物質的存在情況.

A產物Y的狀態只能為固態或液態;
B平衡時,單位時間內消耗的n(X)∶n(Y)=1∶1;
C保持體積不變,向平衡體系中加入Y,平衡可能向逆反應方向移動;
D若開始時向容器中加入1 mol Y和1 mol Z,達到平衡時放出熱量Q=ΔH

3改變條件時可能引發副反應
勒夏特列原理指出增加反應物的濃度會使化學平衡向正反應方向移動,但是,針對具體的化學反應而言,可能會因為增大了反應物的濃度,引發一些副反應,與實際要研究的可逆反應的結果截然不同,所以,改變影響平衡的一些條件時,我們還要特別關注是否會出現一些副反應的存在情況.

A變黃;B變深;C變淺;D無變化

4反應的特殊性帶來的“意料之外”
使用勒夏特列原理分析相關化學平衡移動問題時,一般會錯誤地認為,增大反應物的濃度平衡向正反應方向移動,若增大生成物的濃度,平衡則會向逆反應方向移動,故增大反應物的濃度改為增大生成物的濃度,造成的結果應該截然相反,其實不然,分析相關問題時,要學會根據具體的反應特點分析,其結果可能會出乎我們的意料之外.

Aa>b; Ba>c; Ca 5多個條件同時改變時要綜合分析 使用勒夏特列原理分析平衡移動的結果時,有時候會片面地認為試題僅僅改變了一個條件,其實不然,有時候一個條件的改變,會造成多個條件的變化,分析該類問題時,要學會綜合分析. 5.7.2 頸部淋巴液漏 左側臂叢神經手術后,觀察有無胸導管損傷,傷口滲出為乳白色,即淋巴液漏。給予患者平臥位,頸部砂袋加壓,局部壓迫1~2周可愈合。108例患者中未發生此并發癥。 A醋酸溶液將鹽酸稀釋,pH會變大; B鹽酸將醋酸溶液稀釋,pH會變小; C醋酸電離平衡沒有發生移動,pH不變; D混合后c(Cl-)、c(CH3COO-)及c(H+)均減少 a(g)+b(g)2c(g)ΔH1<0; 進行相關操作且達到平衡后(忽略體積改變所做的功),下列敘述錯誤的是(). A等壓時,通入惰性氣體,c的物質的量不變; B等壓時,通入z氣體,反應器中溫度升高; C等容時,通入惰性氣體,各反應速率不變; D等容時,通入z氣體,y的物質的量濃度增大 綜上所述,在具體解答相關化學平衡問題時,常常會使用到勒夏特列原理,但使用勒夏特列原理解決有關的問題時,不能憑經驗簡單處置,要深刻理解勒夏特列原理的本質,多角度地考慮問題,只有這樣才能避免發生經驗主義的錯誤,才能避開試題設置的陷阱. (作者單位:安徽省靈璧中學)





