Orexin-A對大鼠海馬神經細胞凋亡的影響及機制
池恒,李國華,唐吉友
(1山東省千佛山醫院,濟南250014;2泰山醫學院;3濟南市第三人民醫院)
?
Orexin-A對大鼠海馬神經細胞凋亡的影響及機制
池恒1,2,李國華3,唐吉友1
(1山東省千佛山醫院,濟南250014;2泰山醫學院;3濟南市第三人民醫院)
摘要:目的探討Orexin-A對大鼠海馬神經細胞凋亡的影響及作用機制。方法 提取36只Wistar大鼠的海馬神經細胞,培養后隨機分為空病毒組、PLCβ1組、PLCβ4組,分別用空病毒和攜帶目的基因PLCβ1、PLCβ4的慢病毒轉染沉默目的基因,各組各自取一半細胞加入Orexin-A(100 nmol/L)培養8 h,用流式細胞術測算各組細胞凋亡指數,Western blotting法檢測海馬神經細胞外信號調節激酶(ERK)1/2的表達。結果與不加Orexin-A比較,加Orexin-A后空病毒組、PLCβ4組海馬神經細胞凋亡率降低、ERK1/2表達升高(P均<0.05),而PLCβ1組海馬神經細胞凋亡率、ERK1/2表達無明顯變化(P均>0.05)。結論 Orexin-A可減少大鼠海馬神經細胞的凋亡,該作用可能與OX1R/OX2R-Gq-PLCβ1信號通路有關。
關鍵詞:Orexin-A;海馬神經細胞;細胞凋亡;細胞外信號調節激酶1/2;大鼠
Orexin是下丘腦產生的一種神經肽,包括Orexin-A、Orexin-B。Orexin主要通過兩個G蛋白偶聯受體(OX1R、OX2R)發揮作用。其中,Orexin-A不僅能激活OX1R,也能激活OX2R,Orexin-B只能激活OX1R[1,2]。Orexin-A參與睡眠-覺醒的調節。研究表明,OX1R和OX2R被Orexin-A激活后,通過與多種G蛋白結合啟動細胞內的多條信號轉導途徑[3]。其中,Gq蛋白/磷脂酶C(PLC)/蛋白激酶C(PKC)是Orexin-A的關鍵信號途徑,可通過激活細胞外信號調節激酶(ERK1/2)的磷酸化影響細胞凋亡。2014年11月~2015年8月,我們通過慢病毒轉染沉默PLCβ1、PLCβ4的基因表達,探討Orexin-A對海馬神經細胞的作用及機制,為發作性睡病等睡眠障礙及其引起的學習記憶功能損害的患者提供新的治療靶點。
1材料與方法
1.1材料出生24 h內Wistar大鼠36只(山東大學實驗動物中心提供),雌雄不拘,營養良好;DMEM/F12培養基、Neurobasal培養基、B27、L-谷氨酰胺、青鏈霉素(美國Gibco 公司);胎牛血清、胰蛋白酶(美國HyClone公司);多聚賴氨酸(北京索萊寶公司);攜帶目的基因的病毒和空病毒(上海吉凱基因化學技術有限公司);Total RNA Kit (美國 Omega公司);PCR試劑盒(美國Thermo公司);引物(上海生物工程公司);Western blotting法檢測試劑盒、電泳液、轉膜液(杭州碧云天公司);p-ERK1/2一抗、總ERK1/2(美國Cell Signaling Technology公司);超凈工作臺、恒溫培養箱(美國Thermo公司);熒光顯微鏡(日本電子公司);實時定量PCR儀(ⅦA7 DX,美國Applied Biosystems公司);電泳轉膜裝置(美國Bio-Rad公司);流式細胞儀(美國BD公司)。
1.2海馬神經細胞培養及分組75%的乙醇消毒大鼠全身,急性分離其海馬組織。將海馬組織剔除腦膜和血膜,剪成1 mm3左右的碎塊,加入0.125%胰蛋白酶溶液于37 ℃、5% CO2培養箱中消化10 min,用含20%胎牛血清的DMEM/F12培養基終止消化。懸浮、離心、過濾,收集細胞,計數后,用含有20%胎牛血清的DMEM/F12培養基制成細胞密度為1×106/mL的細胞懸液,接種于預先用0.01%多聚賴氨酸包被的六孔板內,置于37 ℃、5% CO2培養箱中培養。8 h后細胞貼壁,換無血清細胞飼養液(96% Neurobasal+2% B27+1%谷氨酰胺+1%雙抗),每3天半量換新鮮的無血清細胞飼養液。培養3 d細胞均分為3組:空病毒組、PLCβ1組、PLCβ4組。
1.3慢病毒轉染及基因沉默效率檢測采用慢病毒作為載體轉染siRNA,3組細胞分別轉染不攜帶任何siRNA的空病毒和攜帶與PLCβ1和PLCβ4基因位點對應的siRNA的慢病毒。依據感染復數值,每組分別加入適量的病毒。8 h后觀察細胞狀態,更換培養基,繼續培養72 h。利用熒光顯微鏡觀察轉染情況,根據細胞計數計算轉染效率,3組細胞轉染效率均>90%。采用RT-PCR法檢測PLCβ1、PLCβ4mRNA 的表達。Total RNA Kit 提取細胞總RNA,反轉錄合成cDNA后進行PCR擴增。95 ℃預變性10 min、95 ℃變性15 s、60 ℃退火30 s、72 ℃延伸30 s,共40 個循環,4 ℃保存,選取GAPDH作為內參。取目的基因Ct值計算沉默效率,PLCβ1、PLCβ4基因沉默效率均>70%,達到基因沉默技術的標準(>50%)。
1.4Orexin-A干預3組海馬神經細胞轉染并基因沉默后,各組均取一半細胞加入Orexin-A(終濃度100 nmol/L),于37 ℃、5% CO2培養箱中培養48 h。
1.5海馬神經細胞凋亡率測算采用流式細胞術。Orexin-A干預48 h后,用預冷4 ℃無菌PBS充分洗滌細胞2次,取1×106/mL的細胞待檢測;用250 μL結合緩沖液重新懸浮細胞濃度至2×105~5×105/mL;取195 μL細胞懸液加入5 μL Annexin V-PE,輕輕混勻后間隔3 min,加入10 μL濃度為20 μg/mL的7AAD溶液;混勻于室溫避光孵育15 min;加300 μL結合緩沖液,輕輕混勻,采用流式細胞儀計算細胞凋亡指數。以上實驗重復5次取均值。
1.6海馬神經細胞中磷酸化ERK1/2(p-ERK1/2)表達檢測采用Western blotting法。Orexin-A干預48 h,各組細胞去除培養基,4 ℃ PBS沖洗,加入細胞裂解液于冰上裂解20 min,14 000×g離心力離心,取上清進行蛋白定量測定,后按4∶1加入上樣緩沖液,95 ℃加熱5 min,取10 μg加入上樣孔,12%分離膠分離蛋白后4 ℃恒流200 mA轉膜1 h,5%脫脂奶粉于搖床室溫封閉2 h,1×TBST震蕩洗滌5 min×3次,p-ERK1/2單克隆一抗(1∶10 000)4 ℃孵育過夜,1×TBST震蕩洗滌5 min×3次,HRP標記二抗(1∶5 000)37 ℃搖床孵育1 h,TBST洗滌后混合等體積發光液A液與B液孵育1 min,顯影、定影。用Western blotting法檢測p-ERK1/2表達水平,用Image J軟件測量條帶的灰度值,將p-ERK1/2與內參的灰度值進行比較,取對比值作為p-ERK1/2的相對表達量。以上實驗重復5次取均值。
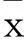
2結果
2.1Orexin-A對海馬神經細胞凋亡指數的影響見表1。
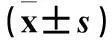
表1 Orexin-A對海馬神經細胞凋亡指數的
注:與同組不加Orexin-A比較,*P<0.05;與PLCβ1組加Orexin-A后比較,#P均<0.05。
2.2Orexin-A對海馬神經細胞ERK1/2表達的影響見圖1、表2。
3討論
Orexin-A能夠通過調節乙酰膽堿能、谷氨酸能和腎上腺素能等系統誘導海馬突觸可塑性的形成[4,5];能夠產生Orexin的神經元可以發出神經纖維投射到大鼠中樞神經系統廣泛區域,包括海馬、杏仁核、紋狀體、下丘腦前部等。海馬是與學習記憶有關的重要腦區,任何原因導致海馬的損害都會引起學習記憶能力下降。正常生理狀態下,缺乏Orexin-A 或阻斷其受體可導致學習記憶功能減退,另外睡眠剝奪容易損害海馬依賴性記憶也已得到動物實驗和臨床的證實[6,7]。本研究采用24 h內出生的Wistar大鼠幼鼠的海馬組織作為實驗標本,新生的乳鼠具有完整的海馬神經細胞,3組海馬神經細胞純度均>95%。利用快速眼動睡眠期睡眠剝奪可誘導Orexin-A 過度表達,導致大鼠雙側海馬神經細胞損害,給予OX1R 或OX2R 拮抗劑則能減輕睡眠剝奪的不利影響[8]。由此我們推測,睡眠剝奪可能通過過度誘導Orexin信號系統的激活來損害學習記憶。

圖1 Orexin-A對海馬神經細胞內p-ERK1/2表達的影響

組別p-ERK1/2表達不加Orexin-A加Orexin-A空病毒組0.43±0.081.43±0.43*#PLCβ1組0.39±0.090.48±0.23PLCβ4組0.37±0.201.66±0.45*#
注:與同組不加Orexin-A比較,*P<0.05;與PLCβ1組加Orexin-A后比較,#P<0.05。
PLCβ1主要表達于端腦,包括海馬、大腦皮質、杏仁核、側間隔和嗅球,PLCβ4除在小腦的浦肯野纖維高水平表達外,還表達于海馬、丘腦和中隔等,且PLCβ1和PLCβ4在胎兒晚期開始表達。因此,本研究中出生24 h內的大鼠海馬神經細胞主要表達PLCβ1和PLCβ4。本研究采用的慢病毒載體,一旦轉染即可長期穩定表達,是基因沉默模型的理想選擇。PLCβ1和PLCβ4的基因沉默效率均>70%,說明RNA干擾有效。本研究結果顯示,空病毒組中加Orexin-A比不加Orexin-A的細胞凋亡指數低,說明Orexin-A對細胞有保護作用;PLCβ4組中加Orexin-A比不加Orexin-A的細胞凋亡指數低,說明Orexin-A也對細胞產生了保護作用,細胞通路沒有被阻斷;PLCβ1組中加Orexin-A和不加Orexin-A的細胞凋亡指數無明顯差異,說明Orexin-A沒有對細胞產生影響,細胞通路被阻斷。由此我們推測,Orexin-A對海馬神經細胞的作用主要依賴于OX1R/OX2R-Gq-PLCβ1信號途徑。
ERK1/2是絲裂原活化蛋白激酶(MAPK)家族的一員,是將信號從表面受體傳導至細胞核的關鍵。在此途徑中, ERK1/2發生磷酸化(p-ERK1/2),即ERK1/2的活化形式,由胞質轉位到核內,參與細胞增殖與分化、細胞骨架的構建、維持細胞形態、細胞凋亡等。Orexin-A通過信號轉導機制調節ERK1/2通路激活,具有劑量依賴性,表現為當Orexin-A增加至終濃度為100 nmol/L時,ERK1/2被最大激活[9]。所以本研究采用100 nmol/L的Orexin-A,以保證ERK1/2能夠被充分激活。本研究結果顯示,空病毒組中不加Orexin-A與加Orexin-A的ERK1/2表達有統計學差異,PLCβ4組中加Orexin-A與不加Orexin-A的ERK1/2表達有統計學差異,說明空病毒組和PLCβ4組Orexin-A所通過的信號轉導通路沒有被阻斷,充分激活了ERK1/2。PLCβ1組中不加Orexin-A和加Orexin-A的細胞凋亡和ERK1/2表達無統計學差異,說明Orexin-A所通過的細胞信號轉導通路被阻斷,沒有充分激活ERK1/2。與上述流式細胞術的結果一致。因此我們證實,Orexin-A對海馬神經細胞的作用主要依賴于OX1R/OX2R-Gq-PLCβ1信號途徑。
參考文獻:
[1] Kaminski T, Smolinska N, Nitkiewicz A, et al. Expression of orexin receptors 1 (OX1R) and 2 (OX2R) in the porcine pituitary during the oestrous cycle[J]. Anim Reprod Sci, 2010,117(1-2):111-118.
[2] Steiner MA, Sciarretta C, Brisbare-Roch C, et al. Examining the role of endogenous orexins in hypothalamus-pituitary-adrenal axis endocrine function using transient dual orexin receptor antagonism in the rat[J]. Psychoneuroendocrinology, 2013,38(4):560-571.
[3] 趙璇,唐吉友,任延艷,等.Orexin-1受體拮抗劑對慢性點燃癲癇大鼠學習記憶的影響及海馬神經細胞的增殖變化[J].中國臨床神經科學,2012,20(3):247-253.
[4] Meerlo P, Mistlberger RE, Jacobs BL, et al. New neurons in the adult brain: the role of sleep and consequences of sleep loss[J]. Sleep Med Rev, 2009,13(3):187-194.
[5] Yan J, He C, Xia JX, et al. Orexin-A excites pyramidal neurons in layer 2/3 of the rat prefrontal cortex[J]. Neurosci Lett, 2012,520(1):92-97.
[6] Havekes R, Vecsey CG, Abel T. The impact of sleep deprivation on neuronal and glial signaling pathways important for memory and synaptic plasticity[J]. Cell Signal, 2012,24(6):1251-1260.
[7] Vecsey CG. Baillie GS, Jaganath D, et al. Sleep deprivation impairs cAMP signalling in the hippocampus[J]. Nature, 2009,461(7267):1122-1125.
[8] Ni LY, Zhu MJ, Song Y, et al. Pentylenetetrazol-induced seizures are exacerbated by sleep deprivation through orexin receptor-mediated hippocampal cell proliferation[J]. Neurol Sci, 2014,35(2):245-252.
[9] Guo Y, Feng P. OX2R activation induces PKC-mediated ERK and CREB phosphorylation[J]. Exp Cell Res, 2012,318(16):2004-2013.
Influence of Orexin-A on apoptosis of rat hippocampal nerve cells
CHIHeng1,LIGuohua,TANGJiyou
(1ShandongProvincialQianfoshanHospital,Jinan250014,China)
Abstract:ObjectiveTo invesitage the effect of Orexin-A on the apoptosis of rat hippocampal nerve cells and the mechanism of action. MethodsThe primary cultured hippocampal nerve cells from 36 Wistar rats were randomly divided in the empty virus group, PLCβ1 group and PLCβ4 group which were respectively transfected by empty vectors, lentiviruses with PLCβ1 and lentiviruses with PLCβ4. After the transfection, all three groups were further divided into subgroups treated with Orexin-A respectively for 8 h. We investigated the expression of ERK1/2by Western blotting and apoptosis rate was measured by flow cytometry for each subgroup.ResultsAfter treatment of Orexin-A, the expression of ERK1/2was increased and the apoptosis rate was decreased significantly in the PLCβ4 group and empty virus group (all P<0.05). However, these changes in the PLCβ1 group were not obvious after treatment with Orexin-A (all P>0.05).ConclusionOrexin-A may decrease the apoptosis of rat hippocampal nerve cells, and this function may be related with OX1R/OX2R-Gq-PLCβ1 signaling pathway.
Key words:Orexin-A; hippocampal nerve cells; apoptosis; extracellular signal-regulated kinase 1/2; rats
(收稿日期:2016-01-06)
中圖分類號:R741
文獻標志碼:A
文章編號:1002-266X(2016)09-0010-03
doi:10.3969/j.issn.1002-266X.2016.09.004
通信作者簡介:唐吉友(1963-),男,主任醫師,博士,主要研究方向為睡眠與學習記憶。E-mail:tangjiyou@sohu.com
作者簡介:第一池恒(1990-),女,碩士研究生,主要研究方向為睡眠與學習記憶。E-mail:hedwigchi@qq.com
基金項目:山東省自然科學基金資助項目(ZR2012HM068);國家自然科學基金資助項目(81471345)。

