我國基本藥物招標采購質量分層制度研究
柳鵬程+陸麗汀
摘 要 本文基于安徽省2012年藥品集中采購中標目錄數據,采用Mann-Whitney U檢驗將不同質量類型的藥品價格進行對比,通過顯著性P值分析藥品之間是否有顯著性差異,并通過比較其價格水平差異來分析這種差異產生的原因及影響,以此來探討雙信封招標制中質量分層標準與方法的合理性,并提出針對性政策建議。
關鍵詞 招標采購 質量分層 Mann-Whitney U檢驗
中圖分類號:R197 文獻標識碼:C 文章編號:1006-1533(2016)05-0060-04
Study on drug quality grading of essential drug bidding
——Based on the analysis of “double envelope” system in Anhui Province
LIU Pengcheng, LU Liting
(School of International Pharmaceutical Business, China Pharmaceutical University, Nanjing 211198, China)
ABSTRACT Based on the data of the centralized drug bidding directory of Anhui province in 2012, the price of two different types of drugs was compared by Mann-Whitney U test. Whether or not there is a significant difference between the two groups of drugs was analyzed by the significance P values and the causes and influence resulting in this kind of difference were also analyzed by comparison of the price difference so as to discuss the rationality of the standards and methods of drug quality grading system in double envelope and propose the corresponding policy recommendation.
KEY WORDS drug bidding; quality stratification; Mann-Whitney U test
在我國,檢驗合格的同通用名藥物的質量存在差異已是不爭之事實。而優質藥品因其生產質量要求嚴格,故生產成本高于普通藥品。若將優質藥品與普通藥品一起招標,進行價格競爭時,其必然處于劣勢地位。在“唯低價者取”的藥品招標形式中,中標者多為普通藥品。此舉雖然表面上控制了藥品價格,但實際上將導致市場中“劣幣驅逐良幣”的現象。長期以往,制藥企業所生產藥品的質量將隨之大幅降低,人民群眾健康水平亦無法得到保證[1]。為避免此類情況的發生,2001年原國家衛生部頒布的《醫療機構藥品集中招標采購工作規范》中,首次提出“質量分層”概念,即藥品招標時對藥品質量進行不同層次的劃分,并按照質量進行招標定價。然而,質量分層政策至今仍然存在較多爭議。謝小東等[2]將我國各省的基本藥物招標的經濟技術標評審體系進行了歸納及比較,認為質量分層制度還存在缺陷,并對完善評審體系提出了建議;朱琳等[3]對全國14 個省(區)基本藥物招標方案中藥品質量分層規定進行比較分析,認為各地質量分層制度各有優缺點,并建議在全國建立統一規范的藥品質量評分指標體系。
以上學者研究均認為現有質量分層存在一定問題,但以理論描述居多,從實證角度進行研究的較少。自從1996年我國政府開始探索藥品集中招標采購制度以來,各地涌現出多種招標方式,如上海閔行模式、重慶模式等。其中,安徽省“雙信封”質量分層制度較為突出,受到社會各界廣泛關注與好評[4]。故本文針對我國典型省份——安徽省藥品質量分層的合理性進行實證研究。
1 安徽省“雙信封”招標制度簡介
安徽省實行“雙信封”制評標辦法,即在編制標書時分別編制經濟技術標書和商務標書。在經濟技術標入圍的前提下,進入商務標,投標價低者中標。在技術標的評審中不按質量層次分組,對藥品的質量類型、質量相關因素、企業規模以及市場信譽等指標進行評審打分,按照得分高低,確定入圍商務標評審的藥品;商務標評審會進行質量分層,最后綜合得分最高者為擬中標藥品,得分次高者為擬備用品種[5]。
技術標評審是指將所有藥品按照競價進行分組,由專家評審組根據藥品質量類型、質量相關因素、企業規模、市場信譽這4項要素進行評審打分,實行百分制計分。其中客觀指標86分,主觀指標14分(表1)。需要注意的是,藥品質量類型的要素權重為46分,在所有要素的評審中比重最大且遠遠高于其他要素,可見質量類型在藥品的技術標分值中起著決定性的作用。根據專家給出的分值高低,確定入圍商務標評審的藥品。若技術標評審得分相同,則企業規模得分(銷售金額和行業排名得分總和)高者入圍。
每一項評審要素被細分成多項評審二級指標,每項二級指標均存在多種描述,不同描述對應分值亦不相同(表2、表3)。
2 數據來源及調整
2.1 數據來源
本文中標藥品樣本信息數據均來自于安徽省醫藥集中采購平臺官網(http://www.ahyycg.cn),主要取自安徽省2012年縣級公立醫院藥品集中采購中標目錄以及同年安徽省縣級公立醫院藥品集中采購技術標入圍藥品目錄。在中標目錄中篩選出同通用名、同劑型、同規格的包含3個質量類型的藥品,其中因普通大輸液類所有同通用名、同劑型、同規格的藥品價格均一,不具對比價值,故不列入研究范圍。2012年安徽省縣級公立醫院藥品集中采購中標目錄(第一批)中共有6 655個中標藥品。依據各治療領域銷售排名靠前的藥品,結合臨床使用習慣,本文中樣本共納入162個藥品,其中每一質量類型包含54個品種,其中針劑品種11個,非針劑品種43個。
2.2 數據調整
即使藥品的規格相同,它們每單位(盒/瓶)包裝所含具體藥品數量不同,因此需要將藥品價格根據包裝進行調整。具體價格調整方法為:將質量類型一的藥品最小劑量單位包裝內所含數量定義為標準單位,質量類型二和質量類型三的藥品最小劑量單位包裝內所含數量定義為初始單位。其招標價格則以標準單位為基準進行調整。調整公式為P=p×(S/s),其中,P為藥品調整后的價格,p為藥品調整前的中標價,S為標準單位,s為初始單位。
例如,薄膜衣片0.5 g規格的阿奇霉素片,質量類型一的包裝為3片/盒,招標價最小計量單位為盒,則標準單位為3。為調整差異,質量類型二的包裝為4片/盒,根據公式P=p×(S/s),此阿奇霉素的價格調整為P=13.98×(3/4)=10.485元(表4)。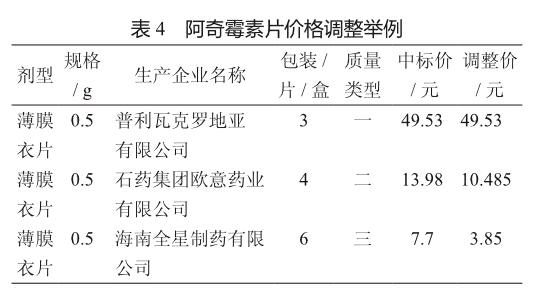
3 研究方法
因分析所用的樣本分布為非正態分布,適合使用非參數檢驗進行分析。如Mann-Whitney U檢驗、K-S檢驗、W-W游程檢驗、極端反應檢驗等,本文選用較為常見的Mann-Whitney U檢驗。
質量價格差異倍數是由藥品質量分組不同而導致的價格差異程度,即以調整后價格為基礎,計算不同質量層次之間藥品價格比,其計算公式為R=Pa/Pb,其中,R代表質量價格差異倍數;Pa代表a(a=1,2,3)質量類型的藥品單位價格;Pb代表b(b=1,2,3)質量類型的藥品單位價格。
4 不同質量的藥品價格差異實證分析
4.1 顯著性檢驗
將3組藥品進行兩兩比較后,得到Mann-Whitney U檢驗結果如表5所示。一類藥品與二類、三類藥品比較,其P值均<0.01;而二類與三類藥品對比結果顯示,其P值為0.167,>0.05,由此得出檢驗結果:一類藥品價格水平明顯高于二類、三類的價格水平,而二類藥品和三類藥品的價格水平沒有統計學差異。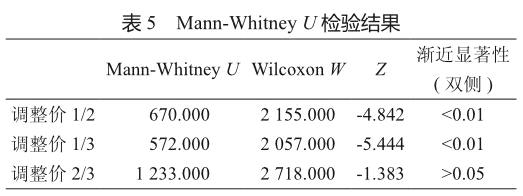
4.2 質量價格差異倍數分析
將一類藥品價格與二類藥品調整價進行比較,二類藥品調整價與三類藥品調整價進行比較,即為兩組藥品質量價格差異。對其進行描述性統計分析結果如表6所示。質量類型一、二之間的價格差異倍數的最大值為45.27,最小值為1.19,平均差異倍數為5.740 6;質量類型二、三之間的價格差異倍數的最大值為4.79,最小值為1,平均差異倍數為1.437 7。
4.3 結果分析
從3個質量類型的藥品的描述性統計可以得出:一類藥品的平均價格水平遠高于二類和三類藥品。從質量價格差異倍數可以得出:一類藥品與二類、三類藥品的平均價格差異倍數要明顯高于二類與三類藥品的平均價格差異倍數,而二類藥品與三類藥品的價格水平無明顯差異,其質量價格差異倍數也基本都<2。
4.3.1 一類藥品與二類、三類藥品的對比
2000年印發的《藥品政府定價辦法》對不同種類的藥品的差價率做出了相關規定:區別GMP與非GMP藥品、原研制與仿制藥品、新藥和名優藥品與普通藥品定價,優質優價。其中,劑型規格相同的同一種針劑型藥品,已過發明專利保護期的原研藥與GMP企業生產的仿制藥差價率不能超過35%,其它劑型的藥品差價率不超過30%。
在一類藥品的樣本中,過專利保護期的原研藥品占了40%以上,從表7可以得出,一類藥品與二類藥品的價格相比,價格差異倍數R>2(即一類藥品價格在二類藥品價格2倍以上)的藥品(樣本中有34個)占到了60%以上,樣本中價格差異倍數最高的為0.15 g的氟康唑膠囊,一類比二類高了45倍多,這顯然沒有達到國家的相關要求。
一類藥品價格水平偏高的重要原因之一就是原研藥在一類藥品的基本藥物中標品種中占據很大的比重。原研藥由于受到專利的保護,在市場份額上占到很大優勢,又因為它的研發、生產等各方面成本較高,其定價水平也比仿制藥要高很多。在安徽省的基本藥物中標目錄中,大部分的原研藥即使已過了專利保護期,但因其具備先進的生產工藝、高層次的質量水平,在與政府談判議價時能持較為強勢的態度,在行政上也有一定的保護,因此在基本藥物招標時降價的幅度就比較小。
4.3.2 二類與三類藥品對比
2010年國家發改委發布的《藥品價格管理辦法(征求意見稿)》規定:經國家藥品監管部門或其認可的社會機構認定,相同劑型的同種藥品的質量標準顯著高于其他企業生產的或獲得國務院授予國家獎項的藥品,以同規格品種的統一價格為基礎,按照上浮不超過30%制定或者調整政府指導價格。
二類藥品主要是獲得美國FDA認證證書、歐盟cGMP認證證書、日本JGMP認證證書的制劑生產線生產并向相應國家出口的藥品,國家科技部等多部委頒發“國家重點新產品”證書的藥品,三類藥品由生產工藝專利、實用新型專利、中藥組合物專利、中藥保護二級、國家質量標準起草單位以及一般GMP藥品組成,從分類上來看,二類藥品資格審核標準要比三類藥品的高,質量水平也高于三類藥品,定價上也應有所體現。但Mann-Whitney U檢驗結果顯示,二類藥品與三類藥品的價格分布沒有顯著性差異,二類與三類藥品的質量價格差異倍數的中值為1.184 4,從表8可以看到,R<1.1的占到了46.30%,R<1.3的占55.56%,還有14組二、三類藥品的質量價格差異倍數為1,即二類藥品與三類藥品的價格相同。
綜上所述,安徽省基本藥物招標在質量類型定價上還不是很合理。結果顯示,一類藥品優勢較大,價格水平偏高,與二類、三類藥品價格差距過大;而對二類、三類藥品評審中,沒有將評分拉開差距,對我國仿制藥產業保護較為欠缺。
5 政策建議
整體而言,我國藥品招標評審體系還有待完善。第一,不同質量層次的藥品的賦分不僅要有相應的差距,同時還要保持其合理性,對于專利期內與非專利期內、優質仿制藥與普通仿制藥應區別對待;第二,對于企業規模的考核應以單個藥品的市場占有率為標準,而不是企業所有藥品的市場份額;第三,技術標的其他評審要素設置也不夠科學,應加大對于臨床療效的賦分,改變其對質量的審核趨于形式化的現狀。
參考文獻
[1] 陳莉. 基本藥物招標的“后安徽時代”[J]. 上海醫藥, 2011, 32(5): 259-260.
[2] 謝小東, 邵蓉. 我國各省區基本藥物招標中經濟技術標評審體系比較研究[J]. 中國藥房, 2013, 24(12): 1076-1078.
[3] 朱琳, 孫利華, 劉國恩, 等. 關于藥品招標中質量分層的思考[J]. 中國藥房, 2010, 21(40): 3774-3777.
[4] 孫云龍, 韋冠, 馬愛霞. 基本藥物招標采購中的“安徽模式”分析[J]. 中國藥業, 2012, 21(8):1-4.
[5] 楊林, 吳彬, 李亞騫, 等. 全國各省基本藥物“雙信封”招標中經濟技術標評審標準比較研究[J]. 中國藥房, 2012, 23(16): 1466-1468.

