卵巢腺癌組織中TRAIL及其受體的表達及意義
李曉蘭
(三峽大學第二人民醫院,湖北宜昌 434000)
?
卵巢腺癌組織中TRAIL及其受體的表達及意義
李曉蘭
(三峽大學第二人民醫院,湖北宜昌 434000)
目的觀察卵巢腺癌組織中腫瘤壞死因子相關凋亡誘導配體(TRAIL)及其受體的表達變化并探討其臨床意義。方法60例卵巢腺癌患者根據FIGO分期標準分為Ⅰ期30例(早期組)、Ⅱ期以上30例(晚期組),對照組為同期因子宮及宮頸病變同時切除卵巢并經病理證實為正常卵巢組織者30例,采用Western blot法檢測各組卵巢組織TRAIL及其死亡受體4(DR4)、DR5、誘騙受體1(DcR1)、DcR2蛋白。結果各組TRAIL蛋白相對表達量組間比較差異均無統計學意義,P均>0.05;DR4、DR5蛋白相對表達量早期組<對照組<晚期組,DcR1、DcR2蛋白相對表達量晚期組>早期組、對照組,P均<0.05;早期組、對照組DcR1、DcR2蛋白比較,P均>0.05。結論卵巢腺癌組織中存在TRAIL及其受體失衡,其在卵巢腺癌的發生、發展中起重要作用。
卵巢腺癌;腫瘤壞死因子相關凋亡誘導配體;死亡受體;誘騙受體
卵巢癌是女性生殖系統的常見惡性腫瘤,發病率較高,病死率居婦科惡性腫瘤首位。目前臨床常用的治療方法有卵巢腫瘤細胞減滅術和化療等,但晚期卵巢癌患者的5年生存率仍較低[1~3]。腫瘤壞死因子相關凋亡誘導配體(TRAIL)是人心肌cDNA文庫中克隆出來的,因其具有強大的誘導腫瘤細胞凋亡的能力,而對正常組織細胞基本無影響,因此被認為是一種更安全且極具有潛力的抗腫瘤因子,成為近年研究熱點。目前,已發現死亡受體4(DR4)、DR5、誘騙受體1(DcR1)、DcR2和骨保護素(OPG)5種TRAIL受體[4,5]。2010年1月~2015年1月,我們觀察了不同階段卵巢癌組織中TRAIL及其受體DR4、DR5、DcR1、DcR2的表達變化,旨在探討其在卵巢癌發生、發展中的作用。
1 資料與方法
1.1臨床資料收集我院同期收治的卵巢腺癌患者60例,年齡30~75歲;均經病理診斷證實為漿液性卵巢腺癌,根據FIGO(2009)分期標準分為Ⅰ期30例(早期組)、Ⅱ期以上30例(晚期組)。對照組為同期因子宮及宮頸病變同時切除卵巢者30例,年齡30~75歲,均經病理證實為正常卵巢。三組年齡具有可比性。
1.2卵巢組織TRAIL及DR4、DR5、DcR1、DcR2檢測采用Western blot法。取三組卵巢組織,-80 ℃冰箱保存。取出組織,TBS洗滌2~3次,采用Bradford方法測定蛋白濃度;SDS-PAGE電泳,轉膜,一抗、二抗免疫反應;化學發光,凝膠圖像分析,將膠片進行掃描(EPSON V300掃描儀)存檔;Alpha軟件處理系統分析目的條帶的光密度值,以目的條帶的光密度值代表卵巢組織TRAIL及DR4、DR5、DcR1、DcR2的相對表達量。
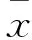
2 結果
早期組、晚期組、對照組TRAIL蛋白的相對表達量分別為1.03±0.04、1.01±0.03、1.00±0.02,組間比較差異均無統計學意義,P均>0.05。早期組、晚期組、對照組DR4蛋白的相對表達量分別為0.58±0.03、1.25±0.03、1.00±0.02,組間比較,P均<0.05。早期組、晚期組、對照組DR5蛋白的相對表達量分別為0.73±0.03、1.49±0.11、1.00±0.04,組間比較,P均<0.05。早期組、晚期組、對照組DcR1蛋白的相對表達量分別為1.02±0.05、1.78±0.04、1.00±0.02。早期組與對照組間差異無統計學意義,其余組間比較,P均<0.05。早期組、晚期組、對照組DcR2蛋白的相對表達量分別為1.00±0.01、1.98±0.09、1.00±0.05,早期組與對照組間差異無統計學意義,其余組間比較,P均<0.05。
3 討論
TRAIL是TNF家族的新成員,是一種凋亡誘導配體,它能夠選擇性地誘導腫瘤細胞凋亡,而使正常細胞逃逸其殺傷作用[6]。TRAIL可以與DR4、DR5相互作用,選擇性誘導多種組織來源的腫瘤細胞株發生凋亡; 而正常細胞因表達的 DcR1、DcR2無完整胞內死亡結構域,能抑制 TRAIL誘導的凋亡[7,8]。DR4 可以導致p53 非依賴性的凋亡,并伴有Caspase8、10和Caspase3、6、7 的剪切。DR4 可以通過不同的信號通路激活JNK和NF-κB ,NF-κB 的活化可以抵抗細胞凋亡,但它并不足以使細胞逃逸死亡的命運[9]。DR5 主要分布于外周血淋巴細胞和骨骼肌細胞。DR5 是p53 的下游靶位,其介導的p53 依賴性調節在人和鼠中有高度的保守性, 并可以在野生型p53 表達的細胞內被DNA 損傷劑誘導表達[10]。DR5 的表達受阿霉素、TNF-α和一些DNA 損傷劑的調節, 但與其他受p53 調節的基因不同的是,DR5 不受紫外線照射的的調節[11~13]。DR5 能夠以組織特異性方式激活NF-κB。DR4、DR5均可通過其胞外區與TRAIL結合并活化后,通過其胞內死亡區引發和傳導凋亡信號,通過激活Caspase蛋白酶解級聯反應而發生TRAIL 誘導的凋亡。DcR1 和DcR2 的基因都位于8p21~22。DcR1和DcR2 的胞外區均有兩個與DR4、DR5 高度同源的富含半胱氨酸的重復序列,能夠與TRAIL結合[14,15]。但是,DcR1 無胞內區; DcR2 的胞內死亡區不完整, 即呈無功能的截斷狀態。因此,DcR1 和DcR2 與TRAIL 結合后都不能傳導凋亡信號。DcR1 和DcR2 在多種組織有廣泛的表達, 它們通過與DR4、DR5 競爭性結合TRAIL 而使正常細胞逃逸TRAIL 介導的凋亡[16]。
本研究發現,早期組、晚期組、對照組TRAIL蛋白的相對表達量組間比較差異均無統計學意義,而TRAIL受體在卵巢腺癌的不同病理階段發生變化。早期卵巢腺癌組織中DR4、DR5表達降低,DcR1、DcR2表達水平無變化,可使腫瘤細胞凋亡發生免疫耐受,發生凋亡逃逸;晚期卵巢腺癌組織中DR4、DR5、DcR1、DcR2表達均升高,而TRAIL未見明顯變化。說明腫瘤組織中存在TRAIL及受體失衡,導致腫瘤細胞生長迅速,且易發生轉移,在卵巢腺癌的發生、發展中起重要作用。
[1] Jemal A, Bray F, Center MM, et al. Global cancer statistics [J]. CA Cancer J Clin, 2011,61(2):69-90.
[2] 閆曉華. TRAIL基因多態性與卵巢癌的相關性探討[J].山東醫藥,2012,52(19):4-6.
[3] Rogalska A, Marczak A. Epothilone B induces human ovarian cancer OV-90 cell apoptosis via external pathway[J]. Phytomedicine,2015,22(2):700-712.
[4] Lin JY, Ke YM, Lai JS, et al. Tanshinone IIA enhances the effects of TRAIL by downregulating survivin in human ovarian carcinoma cells[J]. Phytomedicine, 2015,22(10):929-938.
[5] Cullen SP, Martin SJ. Fas and TRAIL death receptors as initiators of inflammation: Implications for cancer[J].Anticancer Drugs, 2015,26(9):26-34.
[6] James MA, Seibel WL, Kupert E, et al. A novel, soluble compound, C25, sensitizes to TRAIL-induced apoptosis through upregulation of DR5 expression[J]. Anticancer Drugs, 2015,26(5):518-530.
[7] Khondoker MA, Nicola JL, Nicholas RF, et al. Alveolar epithelial cells in idiopathic pulmonary fibrosis display upregulation of TRAIL, DR4 and DR5 expression with simultaneous preferential over-expression of pro-apoptotic marker p53[J]. Int J Clin Exp Pathol, 2014,7(2):552-564
[8] Venhar G, Konac E, Nuray VL, et al. Effects of AG490 and S3I 201 on regulation of the JAK/STAT3 signaling pathway in relation to angiogenesis in TRAIL resistant prostate cancer cells in vitro [J]. Onocl Letter, 2014(7):755-763.
[9] 李曉蘭,孟運蓮.腫瘤壞死因子相關凋亡誘導配體及受體與妊娠[J].國際婦產科學雜志,2009,36(3):189-192.
[10] 李曉蘭,王倩倩,黎莉,等.沙眼衣原體感染后大鼠蛻膜中TRAIL及受體的表達[J].中國婦幼保健,2010,24(25):3477-3480.
[11] Hu JK, Yang K, Li CM, et al. The expression of TRAIL and its receptors in gastric cancer and the apoptotic effect of rh-TRAIL on SGC7901 cells [J]. Oncol Rep, 2009,21(3):681-688.
[12] Kang YH, Park MG, Noh KH, et al. Low serum TNF-related apoptosis-inducing ligand (TRAIL) levels are associated with acute ischemic stroke severity[J]. Atherosclerosis, 2015,240(1):228-233.
[13] Straughn J, Macco Jr P, Liver GO, et al. Ant-i tumor activity of TRA-8 ant-i death receptor 5 (DR5 ) monoclonal antibody in combination with chemotherapy and radiat ion therapy in a cervical cancer model[J] . Gynecol Oncol, 2006,101(1):46-54.
[14] Shin D, Kwon HY, Sohn EJ, et al. Upregulation of death receptor 5 and production of reactive oxygen species mediate sensitization of PC-3 prostate cancer cells to TRAIL induced apoptosis by vitisin A[J] . Cell Physiol Biochem, 2015,36(3):1151-1162.
[15] Liu H, Yang E, Lu X, et al. Serum levels of tumor necrosis factor-related apoptosis-inducing ligand correlate with the severity of pulmonary hypertension[J]. Pulm Pharmacol Ther, 2015,15(7):1094-1102.
[16] Zhang C, Liu S, Wu J. Association of the polymorphism of TRAIL with the risk and severity of lumbar disc degeneration in chinese han population[J]. Genet Test Mol Biomarkers, 2015(17):1151-1162.
湖北省自然科學基金面上項目(2015CFB574);湖北省宜昌市自然科學基金項目(A11301-39)。
10.3969/j.issn.1002-266X.2016.18.018
R737.31
B
1002-266X(2016)18-0053-02
2016-01-21).

