絕經后骨質疏松癥患者血漿SOST表達變化及其與基因甲基化的關系
時宇博,朱福良,李立軍,王云國,宗強,倪東馗
(天津醫科大學第二醫院,天津300211)
·臨床研究·
絕經后骨質疏松癥患者血漿SOST表達變化及其與基因甲基化的關系
時宇博,朱福良,李立軍,王云國,宗強,倪東馗
(天津醫科大學第二醫院,天津300211)
目的 觀察絕經后骨質疏松癥患者血漿SOST基因表達變化,并探討其與基因甲基化的關系。方法 選擇絕經后骨質疏松癥者60例(觀察組),絕經后無骨質疏松癥患者60例(對照組)。采集兩組空腹外周血,采用實時定量PCR法檢測血漿SOST mRNA相對表達量,甲基化特異性-PCR法檢測SOST基因甲基化情況,分析SOST mRNA表達與其基因甲基化的關系。結果 觀察組及對照組SOST mRNA相對表達量分別為(6.126±0.304)×10-5、(1.936±0.358)×10-5,兩組比較P<0.05;SOST基因甲基化陽性率分別為66.67%(40/60)、83.33%(50/60),兩組比較P<0.05。觀察組SOST基因甲基化陽性及陰性者mRNA相對表達量分別為(1.725±0.046)×10-5、(4.253±0.039)×10-5,SOST基因甲基化陽性陽性率與其mRNA表達呈負相關(r=-0.996,P<0.01)。對照組SOST基因甲基化陽性及陰性者mRNA相對表達量分別為(1.362±0.091)×10-5、(5.251±0.042)×10-5,SOST基因甲基化率與其mRNA表達呈負相關(r=-0.985,P<0.01)。結論 絕經后骨質疏松癥患者血漿SOST mRNA表達升高,可能與其基因低甲基化有關。
骨質疏松癥;SOST基因;甲基化;絕經;女性
骨質疏松癥是一種以骨量減少、骨的微觀結構退化為特征,致使骨的脆性增加,易于發生骨折的全身性骨骼疾病。骨質疏松癥是一種復雜的多基因遺傳病,其遺傳率為60%~80%[1]。SOST基因位于人類基因組的17q12-21,主要在骨細胞中表達,含有兩個外顯子和一個內含子,編碼硬化蛋白[2]。硬化蛋白能夠抑制骨分化和形成過程中的Wnt信號途徑,抑制硬化蛋白的表達能夠促進骨形成[3,4]。本研究觀察絕經后骨質疏松癥患者血漿SOST mRNA表達變化,并探討其與基因甲基化的關系。
1 資料與方法
1.1 臨床資料 選擇2015年5~8月我院收治的絕經后骨質疏松癥者60例(觀察組),年齡(57±2)歲;絕經后無骨質疏松癥患者60例(對照組),年齡(56±1)歲。骨質疏松癥參照WHO推薦的診斷標準。排除標準:①合并糖尿病、甲狀腺功能亢進、甲狀旁腺功能亢進等影響骨代謝的內分泌疾病者;②合并肝腎功能異常、胃炎、腸炎、類風濕性關節炎、派杰氏病或骨腫瘤等惡性腫瘤者;③半年內曾使用過激素或其他影響骨代謝的藥物者;④1年內發生骨折等導致肢體運動功能受限者。本研究通過醫院倫理委員會審查,且患者知情同意。
1.2 相關指標觀察
1.2.1 血漿SOST mRNA表達 采用實時定量PCR法。兩組空腹12 h以上,于次日清晨8~9點取靜脈血2 mL,均采用EDTA抗凝。采用TRIzol一步法快速提取細胞總RNA,反轉錄合成cDNA。以GAPDH為內參基因,實時定量PCR反應采用Platinum Quantitative PCR SuperMix-UDG試劑盒,使用ABI 7500 Sequence Detector儀器及分析系統進行擴增和分析。反應體系包括cDNA、Platinum Quantitative PCR SuperMix-UDG及上游引物、下游引物。PCR反應條件:95 ℃預變性3 min;95 ℃變性30 s,55 ℃退火30 s, 72 ℃延伸1 min,共35個循環。每個樣本重復檢測兩次。SOST mRNA相對表達量以2-ΔΔCT表示。
1.2.2 SOST基因甲基化情況 按照DNA提取試劑盒說明書進行操作,提取DNA后進行定量,根據甲基化試劑盒說明書對所提取的DNA進行亞硫酸鹽修飾和純化。采用甲基化特異性-PCR法檢測SOST基因甲基化情況,按試劑盒說明書操作。所用引物均由生工生物工程(上海)股份有限公司設計合成,反應體系:亞硫酸鹽處理的DNA,10×PCR buffer,上下游引物,2.5 mmol/L dNTP,Taq DNA Polymerase,加入ddH2O至總體積為25 μL。甲基化和非甲基化反應條件:95 ℃預變性3 min;95 ℃變性30 s,55 ℃退火30 s, 72 ℃延伸1 min,共45個循環。
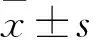
2 結果
2.1 兩組血漿SOST mRNA相對表達量比較 觀察組SOST mRNA相對表達量為(6.126±0.304)×10-5,對照組為(1.936±0.358)×10-5,兩組比較P<0.05。
2.2 兩組SOST基因甲基化情況比較 觀察組SOST基因甲基化陽性40例、陰性20例,甲基化陽性率為66.67%;對照組SOST基因甲基化陽性50例、陰性10例,甲基化陽性率為83.33%;兩組比較P<0.05。
2.3 SOST mRNA表達與甲基化的關系 觀察組SOST基因甲基化陽性者mRNA相對表達量為(1.725±0.046)×10-5,陰性者為(4.253±0.039)×10-5,SOST基因甲基化陽性率與其mRNA表達呈負相關(r=-0.996,P<0.01)。對照組SOST基因甲基化陽性者mRNA相對表達量為(1.362±0.091)×10-5,陰性者為(5.251±0.042)×10-5,SOST基因甲基化陽性率與其mRNA表達呈負相關(r=-0.985,P<0.01)。
3 討論
Loots等[5]研究顯示,骨肥大癥患者SOST基因下游35 kb處存在一個52 kb的缺失,表明SOST基因在成人骨骼中是必需的。Li等[6]以9~10周SOST基因敲除小鼠和野生型小鼠為研究對象,通過放射性技術檢測其骨折愈合程度,結果發現基因敲除更有利于胼胝體橋的形成,并增強骨和骨組織的形成。在治療骨質疏松癥和相關的低密度骨骼疾病的研究中,SOST基因逐漸受到越來越多的關注[7~9]。
SOST基因的表達具有特異性,胚胎時期可以在多種組織中表達,成年人或鼠中只在骨細胞特異性表達,是調控成骨細胞功能的一個重要基因[10]。本研究結果顯示,絕經后骨質疏松癥患者血漿SOST mRNA相對表達量明顯高于無骨質疏松癥者,但是其作用機制尚不清楚。骨質疏松癥是一種與年齡有關的疾病,隨著年齡的增長,基因甲基化的模式會發生變化,因此推測基因甲基化可能有助于骨質疏松癥的發生[11,12]。Delgado-Calle等[8]研究發現,SOST基因有兩個CpG富集區,其中一個區域臨近啟動區域外顯子1附近,在成骨細胞中的甲基化程度高于骨細胞。體外研究顯示,SOST基因CpG島的甲基化可阻礙蛋白結合到啟動子區,脫甲基后基因表達顯著上調,也提示基因表達在成骨細胞和骨細胞轉變過程中的作用[13]。
為探討SOST基因表達與其甲基化在絕經后骨質疏松癥發病中的作用,我們檢測了絕經后骨質疏松癥和無骨質疏松癥者血漿的SOST甲基化狀態,結果顯示前者的SOST甲基化陽性率明顯低于后者,與Reppe等[14]研究結論一致;相關性分析顯示,兩組SOST基因甲基化陽性率與其mRNA表達均呈顯著負相關,與Papathanasiou等[15]研究結論一致。提示SOST基因甲基化可引起其mRNA表達發生變化,直接或間接阻礙轉錄因子與啟動子結合,從而降低其轉錄水平,可能是骨質疏松癥發生的機制之一。
綜上所述,絕經后骨質疏松癥患者血漿SOST mRNA表達升高,可能與其低甲基化有關,二者的相互作用在絕經后骨質疏松癥的發生、發展中具有重要意義。本研究為揭示骨質疏松癥的發病機制提供依據,但是關于SOST基因甲基化如何調節其表達的分子機制尚需進一步研究。
[1] Suri P, Morgenroth DC, Hunter DJ. Epidemiology of osteoarthritis and associated comorbidities[J]. Pm R, 2012,4(5 Suppl):10-19.
[2] Delgado-Calle J, Riancho JA, Klein-Nulend J. Nitric oxide is involved in the down-regulation of SOST expression induced by mechanical loading[J]. Calcif Tissue Int, 2013,94(4):414-422.
[3] Bhadada SK, Rastogi A, Steenackers E, et al. Novel SOST gene mutation in a sclerosteosis patient and her parents[J]. Bone, 2013,52(2):707-710.
[4] Pascual-Carra MA. DNA methylation contributes to the regulation of sclerostin expression in human osteocytes[J]. J Bone Miner Res, 2014,27(8):372-381.
[5] Loots GG, Kneissel M, Keller H, et al. Genomic deletion of a long-range bone enhancer misregulates sclerostin in Van Buchem disease[J]. Genome Res, 2005,15(7):928-935.
[6] Li C, Ominsky MS, Tan HL, et al. Increased callus mass and enhanced strength during fracture healing in mice lacking the sclerostin gene[J]. Bone, 2011,49(6):1178-1185.
[7] Piters E, Culha C, Moester M, et al. First missense mutation in the SOST gene causing sclerosteosis by loss of sclerostin function[J]. Hum Mutat, 2010,31(7):1526-1543.
[8] Delgado-Calle J, Sanudo C, Bolado A, et al. DNA methylation contributes to the regulation of sclerostin expression in human osteocytes[J]. J Bone Miner Res, 2012,27(4):926-937.
[9] Lewiecki EM. Role of sclerostin in bone and cartilage and its potential as a therapeutic target in bone diseases[J]. Ther Adv Musculoskelet Dis, 2014,6(2):48-57.
[10] 姚琦,黃鵬,姜華,等.Sclerostin與骨質疏松研究進展[J].山東醫藥,2011,51(40):98-101.
[11] Johnson VL, Hunter DJ. The epidemiology of osteoarthritis[J]. Best Pract Res Clin Rheumatol, 2014,28(1):5-15.
[12] Jeffries MA, Donica M, Baker LW, et al. Genome-wide DNA methylation study identifies significant epigenomic changes in osteoarthritic cartilage[J]. Arthritis Rheumatol, 2014,66(10):2804-2815.
[13] Delgado-Calle J, Arozamena J, Perez-Lopez J, et al. Role of BMPs in the regulation of sclerostin as revealed by an epigenetic modifier of human bone cells[J]. Mol Cell Endocrinol, 2013,369(1-2):27-34.
[14] Reppe S, Noer A, Grimholt RM, et al. Methylation of bone SOST, its mRNA, and serum sclerostin levels correlate strongly with fracture risk in postmenopausal women[J]. J Bone Miner Res, 2015,30(2):249-256.
[15] Papathanasiou I, Kostopoulou F, Malizos KN, et al. NDNA methylation regulates sclerostin (SOST) expression in osteoarthritic chondrocytes by bone morphogenetic protein 2 (BMP-2)induced changes in Smads binding affinity to the CpG region of SOST promoter[J]. Arthritis Res Ther, 2015(17):160.
倪東馗(E-mail: chenlyx126@126.com)
10.3969/j.issn.1002-266X.2016.16.011
R174.4
B
1002-266X(2016)16-0035-03
2015-09-16)

