關于SO2學習中的一些問題(2)
關于SO2學習中的一些問題(2)
◇北京王篤年
5SO2與CO2有哪些異同點?
從酸堿反應的視角看,SO2和CO2都是氣態酸性氧化物,它們對應的酸都是二元酸,所以SO2與CO2在和堿反應時顯示出極其相似的化學性質.比如與燒堿溶液反應,會因酸堿比例不同形成正鹽、酸式鹽:
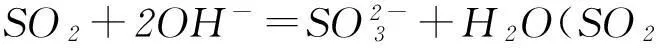
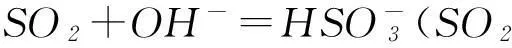
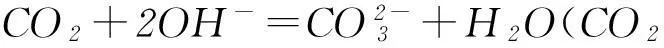
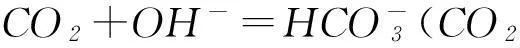
通入石灰水時,都可以先形成白色沉淀,氣體過量時則因形成溶解度大的酸式鹽而致沉淀溶解:
SO2+Ca2++2OH-=CaSO3↓+H2O,
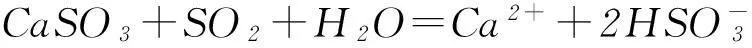
CO2+Ca2++2OH-=CaCO3↓+H2O,
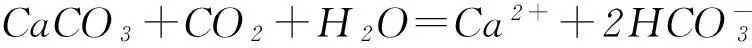
不同的是,SO2對應的酸亞硫酸(Ka1=1.3×10-2,Ka2=6.3×10-8)為中強酸,而CO2對應的碳酸(Ka1=4.2×10-7, Ka2=5.6×10-11)為弱酸,前者可以把后者從其鹽溶液中置換出來:
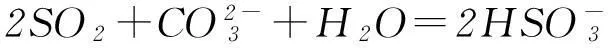
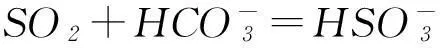
所以可利用飽和NaHCO3溶液除去混在CO2氣體中的SO2氣體.
(思考:NaHSO3能不能與NaHCO3溶液反應放出CO2呢?H2CO3能不能與Na2SO3溶液反應將其轉化為NaHSO3呢?請根據二者的電離平衡常數作出判斷.)
從氧化還原的視角來看,2種氣體都具有弱的氧化性,如:
SO2+2H2S=3S↓+2H2O,
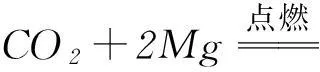
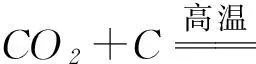
但是二者的還原性差異很大,SO2具有強的還原性:
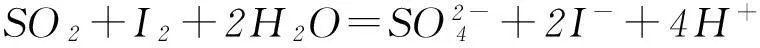
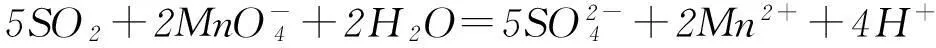
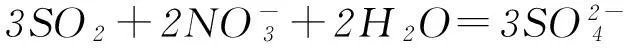
而CO2一般情況下難以顯示還原性(盡管理論上-2價的氧可以顯示還原性).
6如何除去混合在其他氣體中的SO2雜質?
這個問題看似簡單,其實要分很多種情況分別進行處理.如前面所述,一般情況下除去混在CO2中的SO2時,采用飽和碳酸氫鈉溶液洗氣的方法即可,這樣可以在除去雜質的同時增加主體物質CO2的量,可謂一舉兩得.
但是在有些特別的情境下,則不宜采用NaHCO3溶液洗氣的辦法.比如木炭與熱的濃硫酸作用,產生CO2、SO2的混合物,要想檢驗確認CO2,則需要先行除去其中的SO2,因為檢驗CO2只能利用石灰水,而SO2也會使石灰水變渾濁.此時若采用NaHCO3溶液洗氣的方法,SO2會與NaHCO3反應生成CO2,無法判斷使石灰水變渾濁的是原來的CO2還是由反應生成的CO2了.這種情況下,我們可以利用SO2的還原性,使用KMnO4溶液除去,如圖1所示.
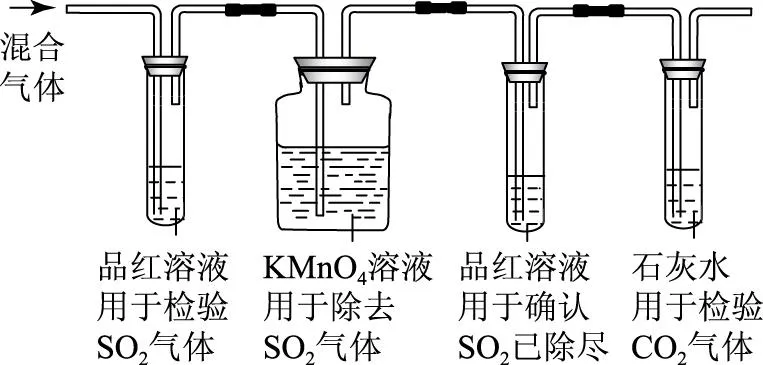
圖1
有機化學實驗中,采用濃硫酸使乙醇脫水制取乙烯時,硫酸被乙醇還原產生的副產物SO2對乙烯的性質有非常強的干擾作用(使溴水、KMnO4溶液褪色,而檢驗乙烯往往正是利用溴水或KMnO4溶液),因此需要將其除去.這里辦法倒是簡單,根據SO2的酸性,采用一定濃度的燒堿溶液洗氣即可.
需要說明的是,SO2可以與品紅溶液反應使其褪色,于是有人設想能否利用品紅溶液除去SO2氣體,答案是否定的.實際操作中一般不用品紅溶液除SO2,這是因為品紅與SO2的反應十分緩慢,很難在短時間內除盡,當然,也與該反應具有可逆性有關.
7為什么SO2通入CaCl2溶液不易形成沉淀?SO2通入任何鈣鹽、鋇鹽溶液都不會產生沉淀嗎?
這個問題與“為什么CO2和CaCl2溶液不形成沉淀?”相似.有些人給出的解釋是“假設產生CaSO3,由于反應生成鹽酸,而CaSO3溶于鹽酸,會反應回去”.這種解釋有些牽強,沒有揭示出問題的本質.因為沒有說明為什么CaSO3會溶于鹽酸.如果說因為CaSO3是弱酸鹽,就一定會溶于強酸溶液的話,是沒有道理的,因為CuS、HgS、Ag2S等也屬于弱酸鹽,但不能溶解于一般的強酸溶液.反應H2S+CuSO4=CuS↓+H2SO4可以順利發生.
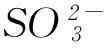
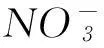
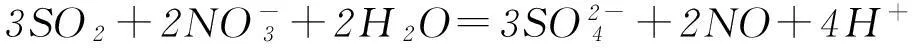
那么,能不能根據SO2通入CaCl2溶液不產生沉淀就簡單推論說“SO2通入一切可溶性強酸鹽溶液中都不會產生沉淀”呢?或者說,把SO2通入BaCl2溶液是否也不會產生BaSO3沉淀呢?已知BaSO3的Ksp=8.0×10-7,請讀者自己推算、驗證.
(作者單位:北京十一學校)
宇宙中的未解之謎——暗物質
美國女天文學家葳拉·羅賓依據已經發現的一些天文現象及人類已知的一些科學規律,提出宇宙中應該存在大量的暗物質,否則許多現象都無法解釋.暗物質可能是黑洞和矮星,但暗物質中的絕大多數應該是一些不發光、不反光、不擋光的透明物質,科學家們有的說是重子物質,有的說是光子,有的說是中微子,總之,宇宙間的暗物質還是個未解之謎.

