多角體包埋異源蛋白桿狀病毒表達系統的構建
郭建軍, 袁 林, 曾 靜, 魏國汶, 楊一兵
(江西省科學院微生物研究所,江西南昌 330096)
?
多角體包埋異源蛋白桿狀病毒表達系統的構建
郭建軍, 袁 林, 曾 靜, 魏國汶, 楊一兵
(江西省科學院微生物研究所,江西南昌 330096)
摘要[目的]探索多角體病毒的包裝特性,構建能形成多角體包裹外源蛋白的polyh+Bac-to-Bac表達系統。[方法] 通過酶切連接的方式,將4個元件片段:作為標記的綠色熒光基因EGFP,BmCPV自身的多角體蛋白基因,用于基因表達的H1信號肽柔性連接肽, 插入到質粒FastBacDual 中,利用AcMNPV Bac-to-Bac系統,得到整合表達重組Bacmid:Ac-polyh/EGFP。將其感染Sf9細胞后,檢測蛋白表達情況。[結果]利用該系統構建了一種能大量表達綠色熒光蛋白(EGFP)和能在胞質形成多角體的重組病毒vBmBac(polyh+)-EGFP。感染的Sf9細胞在熒光顯微鏡下觀察發現EGFP與多角體可以在同一細胞中同時表達;從感染的Sf9細胞中收集純化多角體,觀察到多角體能被激發出綠色熒光,進一步利用Western blot證實多角體中含有EGFP。[結論]該表達系統為解決活性蛋白長期保存提供了新方法,同時拓寬了桿狀病毒在開發含有毒素蛋白的新型生物殺蟲劑和新型疫苗的轉運載體等領域的應用前景。
關鍵詞桿狀病毒;多角體;異源包埋
昆蟲桿狀病毒在其生活史中存在2種結構和形態截然不同的病毒粒子,即芽生型病毒(budded virus,BV)和多角體型病毒(occlusion-derived virus,ODV)。ODV病毒主要在感染晚期被大量包涵入多角體蛋白結晶[1]。2種表型的病毒在形態、蛋白質組成和病毒囊膜的來源上都有所不同,導致在感染組織特異性以及病毒入侵宿主細胞方式上的差異[2]。關于質型多角體病毒(BmCPV)中多角體蛋白與病毒粒子之間相互作用的研究已有較多報道,但其包裝機制尚不清楚。有學者推測,多角體蛋白和病毒之間可能存在特殊的識別作用,使多角體對病毒粒子進行特異性的包埋[3]。目前在開發的桿狀病毒作為表達載體時,將多角體蛋白基因刪除,由外源目的基因替代,利用多角體強啟動子帶動外源基因的表達[4],重組病毒不能形成多角體。Mori 等[5]利用改良的桿狀病毒表達載體,在培養的昆蟲細胞內進行 BmCPV 多角體蛋白基因的體外表達,結果表明,BmCPV 的多角體蛋白可以進行自我包裝,在無其他病毒因子存在的情況下能夠組裝成多角體晶體結構。
研究發現,多角體不僅可以對異源病毒粒子進行包裝,還可以對一些異源蛋白進行包埋[6]。對 CPV 多角體蛋白分子晶體結構的研究表明,質型多角體是由同源結合的多角體蛋白分子三聚體相互作用組裝成的致密蛋白晶體結構[1],具有抗干燥、抗高溫的作用,以保護包埋其中的病毒粒子免受不良環境的破壞[7]。核型多角體病毒(BmNPV)能夠將感染細胞內表達的綠色熒光蛋白(EGFP)包埋進多角體中,對包埋其中的EGFP起到抗干燥等保護作用[8],并認為EGFP是隨機進入多角體中,且進入多角體內部的EGFP量很少。因此,筆者在昆蟲桿狀病毒表達系統(Bac-to-Bac)的基礎上,以多角體蛋白氨基端的 H1 α-螺旋序列作為多角體蛋白識別信號序列,將這種信號序列和綠色熒光蛋白基因gfp融合,并與 BmCPV 多角體蛋白基因共表達,實現綠色熒光蛋白能夠被包埋進多角體,為利用多角體固定外源蛋白提供技術平臺。
1材料與方法
1.1材料及主要試劑pFastBac Dual載體、大腸桿菌DH5α、DH10BacTM、Sf9昆蟲細胞,由江西省科學院微生物研究所分子生物學實驗室保存。Sf9 細胞用 Grace+10%胎牛血清(FBS),于 28 ℃培養;Grace 培養基、胎牛血清為GIBCO/BRL 公司產品;逆轉錄酶 M-MLV、限制性內切酶購自 Fermentas 公司;高保真 DNA 聚合酶、dNTPs、DNA凝膠回收試劑盒、T4 DNA 連接酶、MiniBest Bacterial Genomic DNA Extraction Kit、pMD18-T simple vector 載體等購自TaKaRa公司;DNA轉染試劑Cellfectin購自Invitrogen公司;Western blot所用EGFP抗體購自Bio Vision公司;蛋白質標準分子質量Marker、X-gal、IPTG 購自上海生工生物工程技術服務有限公司。
1.2BmCPVpolyh基因片段和EGFP基因的克隆 根據BmCPV 基因組polyh序列 ( GenBank 登錄號:GQ924589 )及Bac-to-Bac表達系統供體質粒pFastBacHTB中多克隆位點序列設計引物,引物由上海生工生物工程技術服務有限公司合成(表1)。
以江西省科學院微生物研究所分子生物學實驗室構建并保存的pGEM-T easy/EGFP質粒(帶有H1信號肽、柔性連接肽和EGFP的序列)為模板,用EGFP-F/EGFP-R引物擴增EGFP基因序列片段。PCR產物(EGFP)與pMD18-T simple vector連接反應按照說明書進行。重組質粒的轉化、質粒的抽提等基因操作參照文獻[3-7]進行。經BamH Ⅰ和Hind III 酶切鑒定含有外源片段的重組質粒pMD18-T- EGFP,送至上海生工生物工程技術服務有限公司測序。
以 BmCPV 中提取的 dsRNA 片段為模板,進行反轉錄合成 cDNA 第 1 鏈。以 CPV-1和CPV-2為引物,進行 PCR擴增多角體蛋白基因polhy。PCR 產物經瓊脂糖凝膠電泳分離純化后克隆進pMD18-T simple vector 載體獲得重組質粒 pMD18-T-polyh。

表1 引物序列及所加入的酶切位點
1.3重組轉座載體與Bacmid穿梭載體的構建將凝膠回收的polyh基因和pFastBac Dual質粒經過BamH I和Hind III雙酶切后分別回收,polyh基因定向克隆于FastBacDual的PH啟動子下游,構建的重組轉移載體pFastBac Dual-polyh轉化至DH5α,進行PCR和酶切鑒定。
將上述pFastBac Dual-polyh質粒和帶H1信號肽的EGFP基因的PCR產物經Smal I和KpnI雙酶切后分別回收,并將帶H1信號肽的EGFP基因定向克隆至pFastBac Dual-polyh的P10啟動子下游,獲得重組轉移載體pFastBac Dual-polyh-EGFP,最后轉化至DH5α,送上海生工生物工程技術服務有限公司測序鑒定。
利用AcMNPV Bac-to-Bac系統,根據產品說明書構建重組Bacmid (Invitrogen公司):分別將pFastBac Dual/polyh-EGFP和對照質粒pFastBac Dual轉化E.coliDH10BacTM感受態細胞,菌液涂于含有X-Gal(40 μg/mL)、IPTG (24 μg/mL)、卡那霉素(50 μg/mL)、慶大霉素(100 μg/mL)和四環素(30 μg/mL)的培養基平板上,經藍白斑篩選,48 h左右挑取白色菌落重新劃線,待長出白色菌落后接種于含相應抗生素的LB培養基中,提取重組Bacmid DNA,用M13引物(M13-F和M13-R)PCR鑒定正確后,得到重組Bacmid:Ac-polyh/EGFP。
1.4重組病毒的構建Ac-polyh/EGFP Bacmid DNA利用脂質體轉染Sf9細胞,具體操作過程參照Cellfectin轉染試劑說明書。以綠色熒光和多角體的出現判斷重組病毒的產生,出現病變后收集上清進行二次感染,獲得相應的重組病毒。用預冷的PBS清洗細胞數次,收集細胞。
1.5多角體的純化及包埋蛋白分析收集感染細胞,用30 mL PBS懸浮后超聲波破碎,15 000 r/min離心收集多角體。將Percoll與PBS按9∶1(V/V)混合,調pH至7.2,12 000 r/min離心20 min,收集純凈的多角體。最后將純化的多角體懸浮于含0.1% SDS的0.01 mmol/L PBS緩沖液中,室溫放置5 min,然后用PBS洗滌2次得到最終純化的多角體。
將純化后的多角體進行12% SDS-PAGE分析,再將蛋白轉移到PVDF膜,進行Western blot檢測。使用的一抗為兔抗EGFP多克隆抗體,二抗為HRP標記的山羊抗兔IgG抗體,最后使用TMB顯色。
2結果與分析
2.1重組轉移載體pFastBac Dual-polyh-eGFP的構建BmCPV片段polhy dsRNA反轉錄后克隆進pMD18-T,獲得重組質粒pMD18-T-polhy,測序比對結果證實克隆片段為多角體蛋白基因(polhy)。pMD18-T-polh 經BamH I和Hind III雙酶切后,克隆進經同樣酶切的pFastBac Dual載體獲得重組質粒 pFastBac Dual-polyh。以pGEM-T easy/EGFP質粒為模板,用EGFP-F/EGFP-B引物擴增帶H1信號肽的EGFP基因片段,克隆入供體質粒pFastBac Dual-polyh的P10啟動子下游,獲得重組轉移載體pFastBac Dual-polyh-EGFP。
2.2重組病毒的構建和多角體的形成以 pFastBac Dual-polyh-EGFP質粒轉化AcMNPV Bac-to-Bac系統的E.coliDH10BacTM感受態細胞,得到同時表達polyh和EGFP基因的重組Bacmid:Ac-polyh/EGFP。Ac-polyh/EGFP用M13F和 M13R 引物進行PCR鑒定和測序比對分析,結果表明外源基因片段插入至正確位置。將Bacmid DNA轉染Sf9 細胞,發現所有感染的細胞內都能觀察到大量的多角體,且發射出很強的綠色熒光(圖1)。從感染細胞中分離純化多角體,于熒光顯微鏡下觀察發現多角體能發射綠色熒光(圖2)。通過SDS-PAGE分析可見有29.0 ku左右的綠色熒光蛋白和31.0 ku左右的多角體蛋白同時得到表達,說明重組病毒構建正確(圖3A)。
2.3多角體中包埋融合蛋白的分析為了進一步驗證綠色熒光蛋白存在于多角體內部,對純化后的多角體進行SDS-PAGE和Western blot分析,結果表明,純化后的多角體中有29.0 ku左右的綠色熒光蛋白條帶能被綠色熒光蛋白的抗體所識別(圖3B、C)。表明綠色熒光蛋白與多角體蛋白可以同時表達,且綠色熒光蛋白都被包埋進入多角體中。這說明該研究構建的新系統不僅能夠形成多角體,外源基因也能夠得到較高水平的表達。
3結論與討論

注:A.正常光視野下;B.綠色熒光視野下。Note:A.Vision under normal light; B.Vision under green fluorescence.圖1 倒置熒光顯微鏡下的轉染Sf9細胞(×400)Fig.1 Transfected Sf9 cells under inverted fluorescence microscope

注:A.正常光視野下;B.綠色熒光視野下。Note:A.Vision under normal light; B.Vision under green fluorescence.圖2 重組病毒感染Sf9細胞后純化多角體的熒光分析(×400)Fig.2 Fluorescence analysis of purified polyhedra after recombinant virus infected Sf9 cells
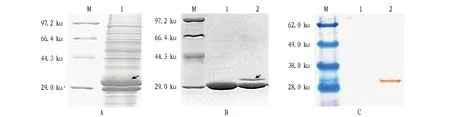
注:A.感染細胞Sf9的蛋白質分析,M.蛋白質分子量標準,1.感染細胞sf9;B.純化多角體的蛋白質分析,M.蛋白質分子量標準,1.vAc-polgh,2.vAC-polyh/EGFP;C.多角體的Western blot分析,M.蛋白質分子量標準,1.vAc-polyh,2.vAc-polyh/EGFP。Note:A.Protein analysis of Sf9 infected cells,M.Protein molecular standard,1.Infected Sf9 cells; B.Protein analysis of purified polyhedra,M.Protein molecular standard,1.vAc-polyh,2.vAc-polyh/EGFP; C.Western blot analysis of polyhedra;1.vAc-polyh,2.vAc-polyh/EGFP.圖3 進入多角體內部的外源蛋白EGFP的SDS-PAGE和Western blot分析Fig.3 SDS-PAGE and Western blot analysis of exogenous protein EGFP into the inner of polyhedra
該研究構建了一種能大量表達綠色熒光蛋白且可以形成多角體的重組病毒vAc-polyh/EGFP,當該重組病毒感染Sf9細胞時,發現綠色熒光蛋白與多角體蛋白可以在同一個細胞中同時表達,且所形成的病毒多角體中帶有一定量的綠色熒光蛋白。Ikeda等[9]和 Ijiri等[10]先后通過試驗證明了 BmCPV 病毒核衣殼蛋白 VP3 的 N末端42 ~ 93 區域的 52 個氨基酸殘基和 CPV 多角體蛋白氨基端的 H1α-螺旋序列可作為多角體蛋白識別信號序列,將這種信號序列同外源蛋白基因融合,當與多角體蛋白基因共表達時,外源融合蛋白能夠被包埋進多角體。曹翠平等[3]將不同截短的多角體蛋白基因與EGFP基因融合表達,結果以多角體蛋白 N 末端 100 個氨基酸和完整多角體蛋白序列作為信號固定 EGFP 的效率最高。將EGFP基因、蘇云金芽孢桿菌(Bacillusthuringiensis,Bt) 毒素基因與多角體蛋白基因按順序融合,構建了可以同時表達多角體蛋白和融合蛋白的重組桿狀病毒,證實多角體既可以包埋桿狀病毒粒子[11],又可以對 Bt 毒素和EGFP 進行包埋。
關于多角體包裹目的蛋白的技術手段多是通過構建2個重組桿狀病毒,即一個專一表達質型多角體病毒多角體蛋白(包裹蛋白)的桿狀病毒,另一個專一表達目的蛋白的桿狀病毒,通過調節2種病毒的比例混合感染Sf9昆蟲細胞,再從細胞中分離出多角體[3,6,11]。該方法不適合從昆蟲細胞中收集大量的多角體,由于很多細胞在混合感染時只感染了一種病毒,所以會形成較多空多角體,以致于包裹效率低。該研究利用桿狀病毒表達系統,同時將質型多角體蛋白基因和目的蛋白基因分別構建到pFastBacTMDual載體的PH與P10啟動子下,并在綠色熒光蛋白與信號肽之間引入柔性鏈接肽,通過與病毒骨架重組,獲得重組桿狀病毒。通過該單一病毒感染Sf9昆蟲細胞,直接可以在細胞內產生所需要的包裹型蛋白,且這種重組型病毒也同樣可以獲得擴增。相對于國外通過2種病毒按照比例進行混合感染相比[8-9],該研究工藝簡單,產生的包裹型蛋白效率更高,另外在產生包裹型蛋白的同時重組病毒粒子也獲得了擴增,更適合通過昆蟲細胞發酵大規模制備多角體包裹型蛋白。多角體形成的分子機制不僅能夠更全面地解釋桿狀病毒的生物學特性,并能有效地解決蛋白質不穩定和難于長期保存的問題,有望在固定毒素蛋白、開發新型生物殺蟲劑以及開發基因治療新型載體和新型納米技術等領域發揮重要作用。
參考文獻
[1] PAYNE C C,MERTENS P P C.Cytoplasmic polyhedrosis viruses[M]//JOKLIK W K.TheReoviridaeLondon:Plenum Press,1983:425-504.
[2] 黃永秀,齊義鵬,李曉鋒.昆蟲病毒多角體蛋白對病毒粒子的異源包裝[J].病毒學報,1995(1):88-92.
[3] 曹翠平,于少芳,郭愛芹,等.BmNPV多角體蛋白片段引導外源蛋白固定入多角體的研究[J].蠶業科學,2010(2):282-289.
[4] 楊凱,龐義.甜菜夜蛾核多角體病毒BAC-TO-BAC外源基因表達系統的建立[J].生物工程學報,2003(4):412-418.
[5] MORI H,曹廣力.利用桿狀病毒表達載體在昆蟲細胞中表達家蠶質型多角體病毒的多角體蛋白,蛋白包裝成多角體[J].國外農學(蠶業),1994(3):12-14.
[6] 張軼嶺,孟祥坤,朱越雄,等.BmCPV多角體蛋白對異源蛋白的包埋[J].蠶業科學,2011(4):676-681.
[7] MORI H,SHUKUNAMI C,FURUYAMA A,et al.The immobilization of bioactive FGF-2 into cubic proteinous micro-crystals (Bombyxmoricypovirus polyhedra) that are insoluble in a physiological cellular environment[J].Journal of biological chemistry,2007,282:17289-17296.
[8] 相興偉,楊銳,陳琳,等.家蠶BmNPV多角體蛋白與外源蛋白共包埋入多角體的研究[J].病毒學報,2011(4):366-371.
[9] IKEDA K,NAKAZAWA H,SHIMO-OKA A,et al.Immobilization of diverse foreign proteins in viral polyhedra and potential application for protein microarrays[J].Proteomics,2006,6(1):54-66.
[10] IJIRI H,NAKATANI T,IDO H,et al.Immobilization of protein kinase C into cypovirus polyhedra[J].Journal of insect biotechnology & sericology,2010,79:15-20.

Construction of Polyhedrin-plus Bac-to-Bac System for Embedded Exogenous Protein
GUO Jian-jun, YUAN Lin, ZENG Jing et al (Institute of Microbiology, Jiangxi Academy of Sciences, Nanchang,Jiangxi 330096)
Abstract[Objective] To make clear the packing mechanism of the BmNPV polyhedra,a polyhedrin-plus Bac-to-Bac expression system for application in silkworm was constructed. [Method] On the basis of plasmid FastBacDual,four components were integrated,which wereEGFPgene as resistant marker,H1 signal peptide,polyhedrin gene from BmCPV and a flexible linker peptide. After enzyme digestion and ligation,high copy recombinant expression vector pFastBac Dual/polyh-EGFP was constructed. pFastBac Dual/polyh-EGFP was linearized and Ac-polyh/EGFP transferred into Sf9 cells. [Result] Using this new system, vBmBac(polyh+)-EGFP was constructed that the foreign gene and polyhedrin were both expressed at higher level and large amount of polyhedra were formed.Fluorescent microscopic observation demonstrated that EGFP and polyhedrin were expressed simultaneously,and the EGFP expression and polyhedra formation occurred in most of the jointly infected cells.Analysis of the purified polyhedra from jointly infected Sf9 cells showed that the foreign proteins were present in the polyhedra. [Conclusion]The result provide a new inspiration for efficient preservation of active proteins and development of new biopesticide with toxin protein and new delivery vector system for vaccines.
Key wordsBaculovirus; Polyhedra; Heterogeneous embedding
收稿日期2015-12-24
作者簡介郭建軍(1984-),男,江西崇仁人,助理研究員,碩士,從事應用微生物學研究。
基金項目江西省重大科技創新項目(20124ACF01100);江西省科學院項目(H2014004)。
中圖分類號S 182
文獻標識碼A
文章編號0517-6611(2016)02-184-04

