體外沖擊波治療早中期膝關節骨性關節炎效果觀察及其機制
席立成,李宏宇,趙子星,郁少林,劉搏宇,田文
(廣西壯族自治區人民醫院,南寧530021)
體外沖擊波治療早中期膝關節骨性關節炎效果觀察及其機制
席立成,李宏宇,趙子星,郁少林,劉搏宇,田文
(廣西壯族自治區人民醫院,南寧530021)
目的 探討體外沖擊波(ESW)治療早中期膝關節骨性關節炎(KOA)的臨床療效及其可能的機制。方法選擇65例早中期KOA患者,與患者說明治療方案后按患者意愿分為觀察組33例和對照組32例。觀察組采用ESW治療(1次/周);對照組口服塞來昔布膠囊,200 mg/次,1次/d;兩組療程均為4周。兩組分別于治療前、治療后即刻及治療后2、6個月行疼痛視覺模擬評分(VAS)評價疼痛情況,采用 WOMAC骨性關節炎指數評分(簡稱WOMAC評分)評價膝關節功能,采用ELISA法檢測關節液IL-1β、IL-10和NO。結果與治療前比較,觀察組治療后即刻、治療后2個月、治療后6個月VAS及WOMAC評分均降低,對照組治療后即刻、治療后2個月VAS及WOMAC評分均降低(P均<0.05)。觀察組治療后2、6個月VAS及WOMAC評分均低于對照組(P均<0.05)。與治療前比較,觀察組治療后即刻、治療后2個月、治療后6個月關節液IL-1β和NO水平均降低,對照組治療后即刻、治療后2個月關節液IL-1β和NO水平均降低(P均<0.05)。觀察組治療后2、6個月關節液IL-1β和NO水平均低于對照組,治療后即刻及治療后2個月關節液IL-10水平均高于治療前及對照組治療后(P均<0.05)。結論ESW治療早中期KOA療效較好、作用時間長;降低關節液IL-1β、NO水平及升高IL-10水平可能是其作用機制。
骨性關節炎;中早期;膝關節;體外沖擊波;白細胞介素1β;白細胞介素10;一氧化氮
骨性關節炎(OA)是由于多種因素引起的關節軟骨病變,繼發關節間隙狹窄,從而引起關節功能障礙的一種疾病,以膝關節多發。OA的治療是目前臨床的一大難題,除晚期行人工關節置換外,其早中期治療尚缺乏有效的方法。體外沖擊波(ESW)具有刺激關節軟骨修復的作用,能夠調節關節液中致炎因子和抑炎因子的表達[1],以往多應用于動物實驗中,相關的臨床研究報道較少。本研究觀察ESW治療早中期膝關節骨性關節炎(KOA)的臨床療效,并探討其可能的機制。
1 資料與方法
1.1 臨床資料 選擇2013年12月~2015年2月我院收治的KOA患者65例,男30例、女35例,年齡(68.07±6.74)歲,病程(64.11±30.94)個月;Kellgren-Lawrence(K-L)分期為Ⅰ期28例,Ⅱ期37例。納入標準:①符合《骨關節炎診治指南(2007年版)》中的KOA診斷標準;②K-L分期為Ⅰ~Ⅱ期;③近3個月內未服用藥物或使用其他方式治療;④心、肺、肝、腎功能良好,能耐受ESW治療;⑤年齡50~75歲。排除標準:① K-L分期為0期或Ⅳ期;②患肢有血管神經疾病史或有嚴重膝關節內外翻畸形,或合并嚴重骨質疏松癥;③類風濕性關節炎、關節結核、風濕性關節炎、關節感染或局部有傷口;④合并有心腦血管、肺、腎或造血系統等系統性疾病,或安裝有心臟起搏器;⑤對非甾體類藥物過敏;⑥既往有消化道潰瘍或出血史。與患者說明治療方案后按患者意愿分為觀察組33例和對照組32例。兩組性別、年齡等一般資料均具有可比性。本研究通過醫院倫理委員會審核,患者均知情同意。
1.2 治療方法 觀察組于患處確定和標記痛點,包括患膝關節局部壓痛點、膝關節屈伸活動痛點;以痛點作為沖擊點,非麻醉狀態下行ESW治療:調整沖擊波碎石機(瑞士storz medical ag公司生產)能流密度為0.2 mJ/mm2、沖擊頻率為8 Hz、治療壓力為3 bar,每個部位沖擊2 000次,1次/周,共治療4周。對照組常規口服塞來昔布膠囊200 mg/次,1次/d,共治療4周。
1.3 相關指標觀察
1.3.1 疼痛和關節功能情況 兩組分別于治療前、治療后即刻及治療后2、6個月,采用疼痛視覺模擬評分(VAS)評價疼痛情況,總分10分,評分越高說明疼痛越嚴重;采用 WOMAC骨性關節炎指數評分(簡稱WOMAC評分)評價膝關節功能情況,總分96分,評分越高說明膝關節功能越差。
1.3.2 關節液IL-1β、IL-10及NO水平 兩組分別于治療前、治療后即刻及治療后2、6個月抽取患側膝關節液1 mL,離心后取上清液,置于-20 ℃冰箱中待檢。采用ELISA法檢測關節液IL-1β、IL-10和NO,嚴格按照試劑盒說明書操作(試劑盒均購自武漢博士德生物工程有限公司)。

2 結果
患者均完成治療,治療6個月后觀察組和對照組分別有1、2例患者因失訪而剔除研究,最終觀察組和對照組分別納入32、30例。
2.1 兩組治療前后VAS及WOMAC評分比較 與治療前比較,觀察組治療后即刻、治療后2個月、治療后6個月VAS及WOMAC評分均降低,對照組治療后即刻、治療后2個月VAS及WOMAC評分均降低(P均<0.05);對照組治療后6個月VAS及WOMAC評分與治療前比較差異均無統計學意義(P均>0.05)。觀察組治療后2、6個月VAS及WOMAC評分均低于對照組(P均<0.05)。見表1。
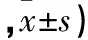
表1 兩組治療前后VAS及WOMAC評分比較(分
注:與同組治療前比較,*P<0.05;與對照組同時間點比較,#P<0.05。
2.2 兩組治療前后關節液IL-1β、IL-10和NO水平比較 與治療前比較,觀察組治療后即刻、治療后2個月、治療后6個月關節液IL-1β和NO水平均降低,對照組治療后即刻、治療后2個月關節液IL-1β和NO水平均降低(P均<0.05)。觀察組治療后2、6個月關節液IL-1β和NO水平均低于對照組,治療后即刻及治療后2個月關節液IL-10水平均高于治療前及對照組治療后(P均<0.05)。對照組治療前后關節液IL-10水平比較差異均無統計學意義(P均>0.05)。見表2。
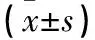
表2 兩組治療前后關節液IL-1β、IL-10及NO水平比較
注:與同組治療前比較,*P<0.05;與對照組同時間點比較,#P<0.05。
3 討論
ESW是一種非侵入性治療方法,最初被用于治療泌尿系結石,隨后逐步擴展到骨骼疾病的治療,并展現出良好的應用前景[2]。2005年國外學者將ESW用于治療馬OA模型,發現馬患側關節功能得到明顯改善[3],從而開創了ESW治療OA的先河。進一步研究發現,ESW能有效降低末梢神經敏感性,減少P物質等疼痛因子的釋放,抑制疼痛信號在神經細胞的傳遞[4],對多種骨骼疾病具有很好的鎮痛效應[5]。OA的早期病理改變主要是軟骨表面的機械磨損,而ESW能改善軟骨代謝和軟骨細胞的增殖分化,促進軟骨組織修復[6]。此外,ESW對局部骨組織的直接作用可以造成微骨折,改變局部生物學環境,促進大量具有成骨作用的細胞因子釋放,有利于軟骨下骨重塑,增加關節的承重能力[7]。本研究結果顯示,與治療前比較,觀察組治療后即刻、治療后2個月、治療后6個月VAS及WOMAC評分均明顯降低,對照組治療后即刻、治療后2個月上述指標均降低,但觀察組治療后2、6個月上述指標均明顯低于對照組,說明ESW治療KOA的遠期療效較好。
OA的具體發病機制目前尚不十分明確,主要由生物和力學因素共同導致的軟骨下骨、軟骨細胞和細胞外基質三者的降解和合成失衡所致[8]。細胞因子與炎性介質在OA的發生、發展中具有重要作用,目前以IL-1β相關研究最多。IL-1β是一種廣泛存在于組織細胞中的具有強大致炎作用的炎性因子,是促使OA關節軟骨破壞和軟骨基質降解最為關鍵的始動因子,在OA炎癥介導過程中起關鍵作用[9,10]。IL-1β能通過NF-κB通路促進金屬基質蛋白酶的合成與釋放,加速蛋白聚糖及Ⅱ型膠原的降解,破壞軟骨基質[11]。軟骨細胞在受到 IL-1β等細胞因子刺激下,能誘導一氧化氮合酶(iNOS)表達,合成高水平NO,關節液中NO水平是判斷 OA 關節軟骨損害的重要指標之一[12]。在OA疾病的進程中,高水平NO使細胞內外發生強烈的氧化應激反應,抑制軟骨細胞增殖和細胞外基質的合成,促進軟骨細胞凋亡,NO水平與炎癥的發展和轉歸關系密切[13]。IL-10是近年來發現的一個具有炎性抑制作用的細胞因子,對維持局部微環境的穩定具有重要意義,其可以通過反饋作用抑制 IL-1β、TNF-α等炎癥遞質的分泌[14];能阻斷NF-κB活性,參與對JAK-STAT信號通路的調控,抑制促炎細胞因子的合成;還能抑制軟骨降解蛋白酶和 iNOS 表達,從而抑制軟骨破壞,對OA患者軟骨和滑膜起到保護作用[15,16]。本研究結果顯示,與治療前比較,觀察組治療后即刻、治療后2個月、治療后6個月關節液IL-1β和NO水平均明顯降低,對照組治療后即刻、治療后2個月關節液IL-1β和NO水平均明顯降低,但觀察組治療后2、6個月關節液IL-1β和NO水平均明顯低于對照組,說明ESW和塞來昔布治療均能下調關節液IL-1β、NO水平,而ESW的遠期調控效果更明顯。本研究對照組治療前后關節液IL-10水平比較差異均無統計學意義,可能與塞來昔布治療OA可能主要是通過抑制NF-κB、JNK通路,從而抑制IL-1β、NO等炎性介質的產生有關[17,18]。本研究觀察組治療后即刻及治療后2個月關節液IL-10水平均明顯高于對照組,提示IL-10能反饋性抑制 IL-1β等炎癥遞質的分泌和iNOS 的表達;上調IL-10等抑炎因子表達,以抑制IL-1β和NO等致炎因子的分泌,可能是ESW治療OA的機制之一。
[1] Teunis T, Beekhuizen M, Van Osch GV, et al. Soluble mediators in posttraumatic wrist and primary knee osteoarthritis[J]. Arch Bone Jt Surg, 2014,2(3):146-150.
[2] Wang CJ. Extracorporeal shockwave therapy in musculoskeletal disorders[J]. J Orthop Surg Res, 2012(7):11.
[3] Revenaugh MS. Extracorporeal shock wave therapy for treatment of osteoarthritis in the horse: clinical applications[J]. Vet Clin North Am Equine Pract, 2005,21(3):609-625.
[4] Kawcak CE, Frisbie DD, McIlwraith CW. Effects of extracorporeal shock wave therapy and polysulfated glycosaminoglycan treatment on subchondral bone, serum biomarkers, and synovial fluid biomarkers in horses with induced osteoarthritis[J]. Am J Vet Res, 2011,72(6):772-779.
[5] Gollwitzer H, Saxena A, DiDomenico LA, et al. Clinically rele-
vant effectiveness of focused extracorporeal shock wave therapy in the treatment of chronic plantar fasciitis: a randomized, controlled multicenter study[J]. J Bone Joint Surg Am, 2015,97(9):701-708.
[6] Wang CJ, Sun YC, Wong T, et al. Extracorporeal shockwave therapy shows time-dependent chondroprotective effects in osteoarthritis of the knee in rats[J]. J Surg Res, 2012,178(1):196-205.
[7] Lyon R, Liu XC, Kubin M, et al. Does extracorporeal shock wave therapy enhance healing of osteochondritis dissecans of the rabbit knee: a pilot study[J]. Clin Orthop Relat Res, 2013,471(4):1159-1165.
[8] Berenbaum F. New horizons and perspectives in the treatment of osteoarthritis[J]. Arthritis Res Ther, 2008(10):S1.
[9] Santangelo KS, Nuovo GJ, Bertone AL. In vivo reduction or blockade of interleukin-1β in primary osteoarthritis influences expression of mediators implicated in pathogenesis[J]. Osteoarthritis Cartilage, 2012,20(12):1610-1618.
[10] Schepens SL, Kratz AL, Murphy SL. Fatigability in osteoarthritis: effects of an activity bout on subsequent symptoms and activity[J]. J Gerontol A Biol Sci Med Sci, 2012,67(10):1114-1120.
[11] Wang X, Li F, Fan C, et al. Effects and relationship of ERK1 and ERK2 in interleukin-1β-induced alterations in MMP3, MMP13, type Ⅱ collagen and aggrecan expression in human chondrocytes[J]. Int J Mol Med, 2011,27(4):583-589.
[12] EI Mansouri FE, Chabane N, Zayed N, et al. Contribution of H3K4 methylation by SET-1A to interleukin-1-induced cyclooxygenase 2 and inducible nitric oxide synthase expression in human osteoarthritis chondrocytes[J]. Arthritis Rheum, 2011,63(1):168-179.
[13] Tao R, Wang S, Xia X, et al. Pyrroloquinoline quinone slows down the progression of osteoarthritis by inhibiting nitric oxide production and metalloproteinase synthesis[J]. Inflammation, 2015,38(4):1546-1555.
[14] Paul A, Bishayee K, Ghosh S, et al. Chelidonine isolated from ethanolic extract of Chelidonium majus promotes apoptosis in HeLa cells through p38-p53 and PI3k/AKT signalling pathway[J]. Zhong Xi Yi Jie He Xue Bao, 2012,10(9):1025-1038.
[15] Schulze-Tanzil G, Zreiqat H, Sabat R, et al. Interleukin-10 and articular cartilage: experimental therapeutical approaches in cartilage disorders[J]. Curr Gene Ther, 2009,9(4):306-315.
[16] Rojas-Ortega M, Cruz R, Vega-López MA, et al. Exercise modulates the expression of IL-1β and IL-10 in the articular cartilage of normal andosteoarthritis-induced rats[J]. Pathol Res Pract, 2015,211(6):435-443.
[17] Tsutsumi R, Ito H, Hiramitsu T, et al. Celecoxib inhibits production of MMP and NO via down-regulation of NF kappaB and JNK in a PGE2 independent manner in human articular chondrocytes[J]. Rheumatol Int, 2008,28(8):727-736.
[18] Berenbaum F. Signaling transduction: target in osteoarthritis[J]. Curr Opin Rheumatol, 2004,16(5):616-622.
廣西科學研究與技術開發計劃項目(桂科攻1598012-10);廣西醫療衛生適宜技術研究與開發項目( S201313-05)。
李宏宇(E-mail: lihongyu36@sohu.com)
10.3969/j.issn.1002-266X.2016.48.020
R684.3
B
1002-266X(2016)48-0060-03
2016-05-04)

