堿性成纖維細胞生長因子對兔骨髓間充質干細胞向成骨細胞分化的影響
戶小偉,李巍,韋達隆,勞山
(廣西醫科大學第一附屬醫院,南寧530021)
堿性成纖維細胞生長因子對兔骨髓間充質干細胞向成骨細胞分化的影響
戶小偉,李巍,韋達隆,勞山
(廣西醫科大學第一附屬醫院,南寧530021)
目的 觀察堿性成纖維細胞生長因子(bFGF)對兔骨髓間充質干細胞(BMSCs)向成骨細胞分化的影響,并探討其最佳作用濃度。方法采用體外全血貼壁法培養兔BMSCs,進行表面抗原(CD29、CD44、CD45,采用流式細胞術)及成軟骨(HE染色和阿爾新藍染色)、成骨[茜素紅染色及堿性磷酸酶(ALP)染色]分化潛能鑒定。取第2代BMSCs,加入含0、1、5、10、50、100 ng/mL bFGF的成骨誘導液,分別于培養第4、7、10、14天采用PNP比色法檢測ALP表達,采用放射免疫分析法檢測骨鈣素(OC)表達。結果細胞表面抗原CD29陽性表達率為92.23%,CD44陽性表達率為80.01%,CD45陽性表達率為1.91%;HE染色見細胞形態為多角形或多邊形,有多個凸起,核周細胞質內可見黑色顆粒,阿爾新藍染色可見細胞間大量天藍色物質彌漫分布;茜素紅染色可見大量紅色鈣結節,ALP染色可見細胞質中出現棕褐色的顆粒和塊狀沉淀;證實分離培養的細胞為BMSCs,并具有成軟骨和成骨分化潛能。隨著作用時間的延長,BMSCs經不同濃度bFGF作用后ALP及OC表達均呈升高趨勢。相同作用時間下,BMSCs經50 ng/mL bFGF作用后ALP及OC表達均高于0、1、5、10、100 ng/mL bFGF作用后(P均<0.01)。結論bFGF能促進BMSCs向成骨細胞分化,并呈時間依賴性;其最佳作用濃度為50 ng/mL。
骨髓間充質干細胞;堿性成纖維細胞生長因子;成骨分化;兔
骨組織工程技術是目前治療骨壞死病變及修復骨缺損最有前景的方法,種子細胞作為組織工程的三要素之一,其選擇和培養更是該技術最基本的環節。骨髓間充質干細胞(BMSCs)有多向分化的能力,被認為是最具潛能的種子細胞[1]。但是自體BMSCs取材有限,因此如何短期內促進其增殖以達到治療數量并增強其成骨效果,是目前所面臨的問題。堿性成纖維細胞生長因子(bFGF)是骨修復再生過程中重要的生長因子,但是關于其對BMSCs成骨分化的影響及最佳作用濃度研究較少。為此,我們于2015年7~10月進行了如下研究。
1 材料與方法
1.1 材料 動物:出生2~3 d的新西蘭白兔10只,雌雄不限,均購于廣西醫科大學實驗動物中心。主要試劑:培養基(DMEM-LG、DMEM-HG)購于美國Gibco公司,胎牛血清購于杭州四季清生物工程材料有限公司,β-甘油磷酸鈉、地塞米松、抗壞血酸均購于美國Sigma公司,TritonX-100購于北京Solarbio公司,轉化生長因子β1(TGF-β1)、胰島素樣生長因子1(IGF-1)、bFGF均購于美國Peprotech公司,CD44抗體、CD45抗體、二抗sc-2010均購于美國Santa Cruz 公司,CD29-FITC購于美國Millipore公司,堿性磷酸酶(ALP)測定試劑盒購于南京建成生物科技有限公司。主要儀器:倒置生物顯微鏡購于日本Olympus公司,酶標光度計(MK3型)購于美國Thermo Labsystems公司,流式細胞儀購于美國BD公司,紫外可見光分光光度計購于上海棱光技術有限公司,CO2恒溫培養箱購于美國SHEL LAB公司。
1.2 兔BMSCs分離培養及鑒定 取10只出生2~3天的新西蘭白兔,予頸椎脫臼處死,無菌條件下取出雙側股骨。在含15% FBS的DMEM-LG培養基中反復沖洗髓腔,將沖出物及培養基復合液以1 000 r/min離心5 min,棄上清液。用含15% FBS的DMEM-LG培養基重懸細胞,吹打均勻,按1×106/mL接種于培養瓶中,置于37 ℃、5% CO2培養箱中進行培養。當細胞融合至80%以上,棄去培養液,用PBS沖洗2遍,加入0.25%胰酶1 mL消化約3 min。待顯微鏡下發現細胞團縮后,用含15% FBS的DMEM-LG培養基終止消化。充分吹打,1 000 r/min離心5 min,棄上清液。加入培養基吹打均勻,按1∶2接種于培養瓶中進行傳代培養。40倍倒置相差顯微鏡下觀察細胞生長及形態學變化。結果顯示,原代BMSCs接種24 h可見貼壁細胞,為梭形或三角形,呈集落樣生長,接種7~9天可融合至80%以上。傳代BMSCs細胞生長迅速,多數在接種12 h內貼壁生長,接種3~4天可融合至80%以上,為典型的長梭型,呈魚群狀生長。
1.2.1 BMSCs表面抗原鑒定 采用流式細胞術。取融合至90%以上的第3代BMSCs,用含Ca2+、Mg2+的PBS沖洗2遍,胰酶消化,1 000 r/min離心5 min,棄上清,FACS buffer沖洗2遍[2]。再次1 000 r/min離心5 min,FACS buffer重懸細胞。取4支EP管,分別編號為A、B、C、D,均加入200 μL細胞懸液。A管加入10 μL CD44抗體,B管加入10 μL CD45抗體,D管加入10 μL PBS作為陰性對照,4 ℃避光孵育40 min。離心后3管予FACS buffer重懸細胞,并加入20 μL熒光二抗。C管加入10 μL用FITC標記的CD29抗體,4管在4 ℃條件下避光孵育20 min,1 000 r/min離心5 min,FACS buffer重懸細胞。上流式細胞儀檢測BMSCs表面CD29、CD44、CD45表達情況,以cot fit軟件分析結果。BMSCs鑒定標志為CD29、CD44高表達,CD45低表達。結果顯示,細胞表面抗原CD29陽性表達率為92.23%、CD44陽性表達率為80.01%,CD45陽性表達率為1.91%,證實其為BMSCs。
1.2.2 成軟骨分化潛能鑒定 取融合至90%以上的第2代BMSCs,給予成軟骨分化誘導液2 mL(含10% FBS的DMEM-HG培養基,加入10 ng/mL TGF-β1、10 ng/mL IGF-1、37.5 μg/mL維生素C、6.25 μg/mL轉鐵蛋白)進行培養,14天后常規進行HE染色和阿爾新藍染色,400倍光學顯微鏡下觀察染色情況并拍照記錄。HE染色顯示核周細胞質內出現黑色顆粒、阿爾新藍染色顯示細胞間出現天藍色物質則表明BMSCs出現軟骨分化。結果顯示,HE染色可見細胞形態為多角形或多邊形,有多個凸起,核周細胞質內可見黑色顆粒;阿爾新藍染色可見細胞間大量天藍色物質彌漫分布;證實BMSCs具有成軟骨分化潛能。見插頁Ⅰ圖1。
1.2.3 成骨分化潛能鑒定 取融合至90%以上的第2代BMSCs,給予成骨分化誘導液(含10% FBS的DMEM-HG培養基,加入4×10-6g/L地塞米松、0.5 g/L維生素C、1 g/L β-磷酸甘油鈉)進行培養,14天后常規行茜素紅染色及ALP染色,200倍光學顯微鏡下觀察染色情況并拍照記錄。茜素紅染色顯示紅色鈣結節,ALP染色顯示細胞呈粉紅色或紅色、細胞核為藍色則表明BMSCs出現成骨分化。結果顯示,茜素紅染色可見大量紅色鈣結節,ALP染色可見細胞質中出現棕褐色的顆粒和塊狀沉淀;證實BMSCs具有成骨分化潛能。見插頁Ⅰ圖2。
1.3 bFGF對BMSCs成骨分化的影響 取第2代BMSCs,調整細胞密度為1×104/L,接種于24孔板,每孔200 μL。常規培養細胞貼壁融合至90%以上,將細胞隨機分為6組,分別加入含0、1、5、10、50、100 ng/mL bFGF的成骨誘導液(成分同1.2.3)。分別于培養第4、7、10、14天抽取培養液200 μL,采用PNP比色法檢測ALP表達,放射免疫分析法檢測骨鈣素(OC)表達,嚴格按照試劑盒說明書操作。

2 結果
隨著作用時間的延長,BMSCs經不同濃度bFGF作用后ALP及OC表達均呈升高趨勢。相同作用時間下,BMSCs經50 ng/mL bFGF作用后ALP及OC表達均高于0、1、5、10、100 ng/mL bFGF作用后(P均<0.01)。見表1、2。
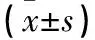
表1 BMSCs經不同濃度bFGF作用后ALP表達
注:與0、1、5、10、100 ng/mL bFGF作用后相同時間比較,*P<0.01。
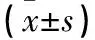
表2 BMSCs經不同濃度bFGF作用后OC表達
注:與0、1、5、10、100 ng/mL bFGF作用后相同時間比較,*P<0.01。
3 討論
BMSCs具有干細胞的共同特性,能夠自我增殖并具有多向分化潛能;其在特定條件和細胞因子誘導下,可分化為中胚層成骨細胞、軟骨細胞、脂肪細胞和肌細胞等,也可跨越胚層界限,向外胚層神經元樣細胞、神經膠質細胞分化[2, 3]。同時BMSCs滿足了組織工程種子細胞的基本要素:①具有良好的成骨能力,增殖能力強;②容易建立較穩定的標準細胞系,易于分離培養;③取材方便,抗原性低,對機體損傷小[4]。將體外培養的BMSCs植入體內可修復骨組織缺損,為骨缺損、骨疾病的再生修復開辟新途徑。Ma等[5]建立股骨頭缺血性壞死的動物模型,將骨形成蛋白2和血管生長因子修飾后的自體BMSCs植入病灶,發現有明顯的新骨形成。但單獨使用BMSCs取材數量有限,且難以達到滿意的成骨效果。本研究分離兔BMSCs后采用體外全血貼壁法進行培養,鑒定結果顯示其高表達CD29、CD44,低表達CD45,且染色結果顯示其具有成軟骨和成骨分化潛能,證實分離的細胞為BMSCs。生長因子是一類具有控制細胞生長和活性,促進或抑制細胞增殖、分化、遷移和基因表達等生物效應的多肽類物質[6]。目前發現的骨生長因子主要包括骨形成蛋白、轉化生長因子、酸性成纖維細胞生長因子(aFGF)和bFGF、血小板源生長因子、胰島素生長因子等[7]。bFGF可刺激成纖維母細胞的生成,是目前發現的最有效的血管生成因子之一,能促進骨、軟骨、神經和軟組織修復[8,9];可激發促進BMSCs向脂肪細胞、成骨細胞和軟骨細胞分化的潛能,具有體內外誘導成骨和成血管作用,因此可以促進骨修復[10,11]。Kuroda等[12]研究發現,bFGF能明顯增加BMSCs的增殖速度。鄭磊等[13]研究也證實,bFGF可增加骨髓基質細胞的貼壁率,隨著bFGF濃度(0~10 ng/mL)的上升,細胞貼壁率逐漸升高。
ALP在多種人體組織細胞內均有表達,當細胞成骨活動時,其ALP水平和活力均升高,可作為反映細胞成骨活性的相關指標[14]。OC是由成骨細胞分泌的一種活性多肽,在骨代謝調節中起重要作用,其水平亦能反映成骨細胞活性。本研究結果顯示,隨著作用時間的延長,BMSCs經不同濃度bFGF作用后ALP及OC表達均呈升高趨勢,說明bFGF促進BMSCs成骨分化的作用呈時間依賴性;但相同作用時間下BMSCs經50 ng/mL bFGF作用后ALP及OC表達均高于0、1、5、10、100 ng/mL bFGF作用后,說明bFGF的最佳作用濃度為50 ng/mL。Varkey[15]研究發現,bFGF的濃度以10 ng/mL為分界,低于10 ng/mL可促進鈣鹽沉積,而高于10 ng/mL則表現為抑制作用。在對人牙組織干細胞的研究中發現,bFGF對ALP的表達有抑制作用[16]。因此,bFGF的濃度可能會對BMSCs的生物特性和分化能力產生不同影響;低濃度時可促進鈣鹽沉積,而高濃度時則可抑制成骨活性[17]。
綜上所述,bFGF能促進BMSCs向成骨細胞分化,并呈時間依賴性;其最佳作用濃度為50 ng/mL。bFGF與BMSCs的相互作用過程相當復雜,加入因子的時間、劑量、作用持續時間等目前尚不明確,仍需進一步研究。
[1] Fong EL, Chan CK, Goodman SB. Stem cell homing in musculoskeletal injury[J]. Biomaterials, 2011,32(2):395-409.
[2] Bahat-Stroomza M, Barhum Y, Levy YS, et al. Induction of adult human bone marrow mesenchymal stromal cells into functional astrocyte-like cells: potential for restorative treatment in Parkinson′s disease[J]. J Mol Neurosci, 2009,39(1-2):199-210.
[3] Kaka GR, Tiraihi T, Delshad A, et al. In vitro differentiation of bone marrow stromal cells into oligodendrocyte-like cells using triiodothyronine as inducer[J]. Int J Neurosci, 2012,122(5):237-247.
[4] Ruiz-Iban MA, Diaz-Heredia J, Garcia-Gomez I, et al. The effect of the addition of adipose-derived mesenchymal stem cells to a meniscal repair in the avascular zone: an experimental study in rabbits[J]. Arthroscopy, 2011,27(12):1688-1696.
[5] Ma XW, Cui DP, Zhao DW. Vascular endothelial growth factor/bone morphogenetic protein-2 bone marrow combined modification of the mesenchymal stem cells to repair the avascular necrosis of the femoral head[J]. Int J Clin Exp Med, 2015,8(9):15528-15534.
[6] Sogabe Y, Abe M, Yokoyama Y, et al. Basic fibroblast growth factor stimulates human keratinocyte motility by Rac activation[J]. Wound Repair Regen, 2006,14(4):457-462.
[7] Hoffmann A, Gross G. BMP signaling pathways in cartilage and bone formation[J]. Crit Rev Eukaryot Gene Expr, 2001,11(1-3):23-45.
[8] Ma SY, Feng ZQ, Lai RF, et al. Synergistic effect of RhBMP-2 and bFGF on ectopic osteogenesis in mice[J]. Asian Pac J Trop Med, 2015,8(1):53-59.
[9] Yang C, Liu Y, Li C, et al. Repair of mandibular defects by bone marrow stromal cells expressing the basic fibroblast growth factor transgene combined with multi-pore mineralized Bio-Oss[J]. Mol Med Rep, 2013,7(1):99-104.
[10] Chiou M, Xu Y, Longaker MT. Mitogenic and chondrogenic effects of fibroblast growth factor-2 in adipose-derived mesenchymal cells[J]. Biochem Biophys Res Commun, 2006,343(2):644-652.
[11] Farhadi J, Jaquiery C, Barbero A, et al. Differentiation-dependent up-regulation of BMP-2, TGF-beta1, and VEGF expression by FGF-2 in human bone marrow stromal cells[J]. Plast Reconstr Surg, 2005,116(5):1379-1386.
[12] Kuroda S, Kondo H, Ohya K. et al. Bone increase in rat tibiae by local administration of amino-terminally truncated rhFGF-4(73-206)[J]. Tissue Eng, 2007,13(2):415-422.
[13] 鄭磊,王前,魏寬海,等.堿性成纖維細胞生長因子對成骨細胞粘附特性影響的實驗研究[J].中國修復重建外科雜志,2000,14(5):305-307.
[14] Zhao W. Embryonic stem cell markers[J]. Molecules, 2012,17(6):6196-6236.
[15] Varkey M. In vitro osteogenic response of rat bone marrow cells to bFGF and BMP-2 treatments[J]. Clin Orthop Relat Res, 2006(443):113-123.
[16] Osathanon T, Nowwarote N, Manokawinchoke J, et al. bFGF and JAGGED1 regulate alkaline phosphatase expression and mineralization in dental tissue-derived mesenchymal stem cells[J]. J Cell Biochem, 2013,114(11):2551-2561.
[17] 范紅旗,孫輝生.骨髓間充質干細胞體外誘導分化研究進展[J].臨床軍醫雜志,2006,34(3):349-351.
Influence of basic fibroblast growth factor on differentiation of rabbit bone marrow mesenchymal stem cells into osteoblasts
HUXiaowei1,LIWei,WEIDalong,LAOShan
(FirstAffiliatedHospitalofGuangxiMedicalUniversity,Nanning530021,China)
Objective To investigate the effects of basic fibroblast growth factor (bFGF) on differentiation of the rabbit′s bone marrow mesenchymal stem cells (BMSCs) into osteoblasts, and to explore the optimal concentration of bFGF. Methods The BMSCs were cultured by the whole blood adherent method and then surface antibody (CD29, CD45 and CD45 by flow cytometry) and osteoblasts (by HE staining and alcian blue staining), and cartilage cells [by alizarin red staining and alkaline phosphatase (ALP) staining] were identified. The 2nd generated BMSCs were cultured with different concentrations (0, 1, 5, 10, 50, and 100 ng/mL) of bFGF. detecting alkaline phosphatase (ALP) with PNP colorimetric method and osteocalcin (OC) expression with radioimmunoassay (RIA) method on day 4, 7, 10 and 14 of culture. Results The positive rate of cell surface antigen CD29 was 92.23%, CD44 was 80.01%, and CD45 was 1.91%. HE staining showed that the cell morphology became polygonal or polygonal and there were multiple protrusions, the black particles could be seen within perinuclear cytoplasm. Alcian blue staining showed that a large number of azure materials diffused. A large number of red calcium nodules were seen by Alizarin red staining. The brown granules and massive precipitation in the cytoplasm were seen by ALP staining, which confirmed the cells were BMSCs with the potential of differentiating into cartilages and osteoblasts. The expression of ALP and OC in the 2nd generation of BMSCs was increased with different concentrations of bFGF as the time passes by. The expression of ALP and OC in BMSCs treated with 50 ng/mg bFGF was higher than that of BMSCs treated with 0, 1, 5, 10 and 100 ng/mL bFGF at the same time (allP<0.01). Conclusion The bFGF promotes BMSCs differentiating into osteoblasts which is in a time-dependent manner and the optimal concentration is 50 ng/mg.
bone marrow mesenchymal stem cells; basic fibroblast growth factor; osteoblast differentiation; rabbit
廣西中醫藥民族醫藥自籌經費科研課題(GZZC15-33)。
戶小偉(1982-),男,主治醫師,研究方向為骨髓間充質干細胞的誘導分化及骨壞死修復。E-mail: huxiaowei555@qq.com
李巍(1984-),男,主治醫師,研究方向為退行性關節炎的發病機制、骨髓間充質干細胞對骨壞死及軟骨損傷的修復。E-mail: lw5hj@163.com
10.3969/j.issn.1002-266X.2016.48.003
R329
A
1002-266X(2016)48-0008-04
2016-02-15)

