膝關節骨性關節炎患者關節液miRNAs表達變化及意義
穆尚強,孫爽,王宇,梅繼文
(吉林醫藥學院附屬醫院,吉林吉林132013)
膝關節骨性關節炎患者關節液miRNAs表達變化及意義
穆尚強,孫爽,王宇,梅繼文
(吉林醫藥學院附屬醫院,吉林吉林132013)
目的 探討膝關節骨性關節炎(KOA)患者關節液中差異表達的微小RNA(miRNAs)及其臨床意義。方法選擇KOA患者和體檢健康者各33例,均為女性。采集受試者關節液標本,隨機從中各選擇3例份,采用miRNA芯片技術檢測差異表達的miRNAs(差異表達的標準定義為上調或下調≥2倍)。采用Real-time PCR法檢測剩余KOA患者和體檢健康者關節液(各30例份)中差異表達miRNAs的相對表達量,對芯片檢測結果進行驗證。結果與體檢健康者比較,KOA患者關節液中上調≥2倍的miRNAs有3個(miR-9、miR-155、miR-98),下調≥2倍的miRNAs有4個(miR-140、miR-27a、miR-146a、miR-138)。KOA患者關節液miR-9、miR-155、miR-98相對表達量均高于體檢健康者,miR-140、miR-27a、miR-146a和miR-138相對表達量均低于體檢健康者(P均<0.05)。結論KOA患者關節液miR-9、miR-155、miR-98表達升高,miR-140、miR-27a、miR-146a和miR-138表達降低;上述miRNAs表達變化可能與KOA的發病有關。
骨性關節炎;膝關節;關節液;微小RNA芯片
膝關節骨性關節炎(KOA)是一種多發于中老年人的慢性退行性骨關節疾病,多發生于女性,其發病率隨著年齡增長呈上升趨勢,60歲以上人群KOA發病率高達50%[1,2]。目前KOA的確切發病機制尚未完全闡明,性別(女性多見)、肥胖、營養、氣候、生物力學等均與KOA的發生和發展有關[3]。最新研究發現,微小RNA(miRNAs)在骨與關節疾病的發病中發揮重要調節作用[4,5]。本研究觀察KOA患者和正常人關節液中差異表達的miRNAs,旨在為KOA的早期診斷和基因治療提供依據。
1 資料與方法
1.1 臨床資料 選擇2014年6月~2015年12月吉林醫藥學院附屬醫院骨科收治的33例KOA患者,均為女性,年齡58~69歲;病程1.5~5.4年;骨關節炎Kellgren-Lawrence影像學分級[6]:Ⅱ級7例,Ⅲ級18例,Ⅳ級8例。患者均符合美國風濕病學會推薦的KOA診斷標準[2]。排除標準:①合并感染性關節炎或有膝關節創傷及手術史;②合并類風濕性關節炎等自身免疫性疾病;③合并其他關節疾病;④合并糖尿病;⑤檢查前兩周曾服用糖皮質激素或非甾體類抗炎藥。選擇同期與KOA患者年齡匹配的女性體檢健康者33例。本研究通過醫院倫理委員會批準,受試者均知情同意。
1.2 關節液miRNAs差異表達檢測 受試者均取平臥位,膝關節局部消毒麻醉后,于髕上外側入路行膝關節腔穿刺,注射器抽取關節液約2 mL。室溫條件下靜置1 h,置于離心機上,2 000 r/min離心20 min。去除細胞和關節組織殘存碎片,取上清置于新的EP管中,-80 ℃冰箱保存待測。于KOA患者和體檢健康者的關節液標本(均為33例份)中各隨機選擇3例份行miRNAs芯片檢測:關節液標本中加入TRIzol試劑混合進行裂解,提取總RNA,紫外分光光度計檢測RNA純度,計算OD260/OD280,瓊脂糖凝膠電泳檢測其完整性。采用miRCURYTMArray Power 標記試劑盒,用標記酶將Hy3TM熒光基團標記miRNAs,制備熒光標記探針。將標記好的探針和miRCURYTM芯片放入PhalanxTM的熱收縮雜交袋進行雜交反應。miRNAs基因芯片購于丹麥Exiqon公司,包含超過1 700個miRNAs捕獲探針,芯片檢測由上海康成生物工程有限公司完成。使用GenePix 4000B生物芯片掃描儀對芯片進行原始圖像掃描,并將結果轉換成數字型數據進行保存。采用GenePix pro V6.0軟件對芯片相關數據進行聚類分析,計算兩種檢測信號的比值(log2)及其倍數變化。差異表達的標準定義為上調或下調≥2倍。
1.3 差異表達miRNAs相對表達量檢測 采用Real-time PCR法。選擇剩余KOA患者和體檢健康者的關節液標本各30例份,對基因芯片結果顯示上調或下調≥2倍的miRNAs相對表達量進行檢測:參照1.2的方法提取總RNA,逆轉錄合成cDNA。逆轉錄反應條件:16 ℃、30 min,42 ℃、40 min,85 ℃、5 min。差異表達miRNAs及內參基因U6引物序列由天根生化科技(北京)有限公司設計合成。PCR反應條件:95 ℃、3 min,95 ℃、15 s,60 ℃、20 s,72 ℃、20 s,77 ℃、20 s,共40個循環。實驗重復3次。以2-ΔΔCT法計算差異表達miRNAs相對表達量。

2 結果
2.1 關節液差異表達miRNAs篩選 與體檢健康者比較,KOA患者關節液中上調≥2倍的miRNAs有3個,分別為miR-9、miR-155、miR-98;下調≥2倍的miRNAs有4個,分別為miR-140、miR-27a、miR-146a、miR-138。見表1。

表1 KOA患者與體檢健康者關節液中差異表達的miRNAs
2.2 差異表達miRNAs相對表達量比較 PCR反應擴增曲線及熔解曲線圖顯示曲線圓滑,熔解曲線可擴增出單峰,擴增效果滿意,表明擴增的特異性和重復性良好。Real-time PCR檢測結果顯示,KOA患者關節液miR-9、miR-155、miR-98相對表達量均高于體檢健康者,miR-140、miR-27a、miR-146a和miR-138相對表達量均低于體檢健康者(P均<0.05)。見表2。
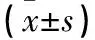
表2 KOA患者與體檢健康者關節液中差異表達的miRNAs相對表達量比較
注:與體檢健康者比較,*P<0.05。
3 討論
KOA早期臨床表現多為膝關節腫脹、疼痛,隨著疾病發展,患者出現膝關節活動受限,嚴重者可導致關節畸形[7,8],不僅嚴重影響生活質量,也給家庭和社會造成沉重的負擔[9,10]。KOA的病因、發病機制還不完全清楚,目前臨床上針對KOA的藥物治療效果有限,并不能逆轉關節軟骨病變過程,進一步研究KOA的病理生理和調控機制對于從基因層面上治療KOA具有重要意義。miRNAs為近年來新發現的一類長度為18~25 nt的內源性單鏈小分子RNA。由于miRNAs通過堿基互補配對的方式與靶基因的3′UTR部分或完全互補,剪切靶基因的轉錄產物或者抑制轉錄產物的翻譯,從而調控靶基因的表達[11,12]。目前專家預測超過30%的人類基因受miRNAs的調節,一個miRNA可以調控多個mRNA,而一個mRNA又可以受到多個miRNAs的調控。miRNAs的發現揭示了一種新的基因表達調控方式,即miRNAs的異常表達可調控疾病的發生和發展[13]。
關節液主要由關節滑囊和腱鞘的滑液膜分泌,如膝關節出現病理改變,會導致分泌的關節液中出現病變代謝產物,并潴留于關節腔。目前研究表明,KOA患者關節液中相關細胞因子和蛋白酶表達水平出現異常,且與軟骨損傷程度和疾病嚴重程度有關[14,15]。關節液分子標志物的檢測仍是目前KOA診斷、療效檢測和預后評估的有效手段[16]。隨著高敏感性基因芯片和PCR技術的應用,目前已知多個miRNAs表達水平的異常改變與疾病的發生、發展密切相關[17,18]。但miRNAs芯片檢測價格昂貴,目前只能用于小樣本的miRNAs篩查。本研究miRNAs芯片檢測結果顯示,與體檢健康者比較,KOA患者關節液中上調≥2倍的miRNAs有3個(miR-9、miR-155、miR-98),下調≥2倍的miRNAs有4個(miR-140、miR-27a、miR-146a、miR-138)。經檢測,上述異常表達miRNAs在KOA患者關節液中的表達變化與芯片檢測結果一致。
綜上所述,KOA患者關節液miR-9、miR-155、miR-98表達上調,miR-140、miR-27a、miR-146a和miR-138表達下調;上述miRNAs表達變化可能與KOA的發病有關。通過對關節液中KOA特異性miRNAs進行檢測有利于早期診斷KOA;未來需進一步對其發病中起關鍵調控作用的miRNAs進行早期干預,以期為其治療提供依據。
[1] Ikeuchi M, Izumi M, Aso K, et al. Clinical characteristics of pain originating from intra-articular structures of the knee joint in patients with medial knee osteoarthritis[J]. Springerplus,2013(2):628.
[2] Salih S, Sutton P. Obesity, knee osteoarthritis and knee arthroplasty: a review[J]. BMC Sports Sci Med Rehabil, 2013,5(1):25.
[3] Iqbal MN, Haidri FR, Motiani B, et al. Frequency of factors associated with knee osteoarthritis[J]. J Pak Med Assoc, 2011,61(8):786-789.
[4] Iliopoulos D, Malizos KN, Oikonomou P, et al. Integrative microRNA and proteomic approaches identify novel osteoarthritis genes and their collaborative metabolic and inflammatory networks[J]. PLoS One, 2008,3(11):e3740.
[5] Xu JF, Zhang SJ, Zhao C, et al. Altered microRNA expression profile in synovial fluid from patients with knee osteoarthritis with treatment of hyaluronic acid[J]. Mol Diagn Ther, 2015,19(5):299-308.
[6] Emrani PS, Katz JN, Kessler CL, et al. Joint space narrowing and Kellgren-Lawrence progression in knee osteoarthritis: an analytic literature synthesis[J]. Osteoarthritis Cartilage, 2008,16(8):873-882.
[7] van der Esch M, Knol DL, Schaffers IC, et al. Osteoarthritis of the knee: multicompartmental or compartmental disease[J]. Rheumatology (Oxford), 2014,53(3):540-546.
[8] Kim HS, Yun DH, Yoo SD, et al. Balance control and knee osteoarthritis severity[J]. Ann Rehabil Med, 2011,35(5):701-709.
[9] Farr IJ, Miller LE, Block JE. Quality of life in patients with knee osteoarthritis: a commentary on nonsurgical and surgical treatments[J]. Open Orthop J, 2013(7):619-623.
[10] Winters JD, Rudolph KS. Quadriceps rate of force development affects gait and function in people with knee osteoarthritis[J]. Eur J Appl Physiol, 2014,114(2):273-284.
[11] David R. Small RNAs: miRNA machinery disposal[J]. Nat Rev Mol Cell Biol, 2013,14(1):4-5.
[12] Jethwa K, Wei J, Mcenery K, et al. miRNA-mediated immune regulation and immunotherapeutic potential in glioblastoma[J]. Clin Investig (Lond), 2011,12(1):1637-1650.
[13] Filip A. MiRNA--new mechanisms of gene expression control[J]. Postepy Biochem, 2007,53(4):413-419.
[14] Mabey T, Taleongpong P, Udomsinprasert W, et al. Plasma and synovial fluid autotaxin correlate with severity in knee osteoarthritis[J]. Clin Chim Acta, 2015(444):72-77.
[15] Yuan PW, Liu DY, Chu XD, et al. Effects of preventive administration of juanbi capsules on TNF-alpha, IL-1 and IL-6 contents of joint fluid in the rabbit with knee osteoarthritis[J]. J Tradit Chin Med, 2010,30(4):254-258.
[16] Martinez DA, Forriol F. Changes in synovial fluid in different knee-joint diseases[J]. Rev Esp Cir Ortop Traumatol, 2012,56(2):140-148.
[17] Wauters J, Martens A, Pille F, et al. Viability and cell death of synovial fluid neutrophils as diagnostic biomarkers in equine infectious joint disease: a pilot study[J]. Res Vet Sci, 2012,92(1):132-137.
[18] Burgos KL, Javaherian A, Bomprezzi R, et al. Identification of extracellular miRNA in human cerebrospinal fluid by next-generation sequencing[J]. RNA, 2013,19(5):712-722.
Altered expression levels of miRNAs in joint fluid of knee osteoarthritis patients
MUShangqiang,SUNShuang,WANGNing,MEIJiwen
(TheAffiliatedHospitalofJilinMedicalUniversity,Jilin132013,China)
Objective To investigate the differential expression of miRNAs in joint fluid of patients with knee osteoarthritis (KOA) and its clinical significance. Methods Thirty-three female KOA patients and 33 female health people were chosen. Three cases of each group were randomly selected and the joint fluid samples of these study subjects were collected. The miRNA microarray was used to assess the level and composition of miRNAs in joint fluid. The differences criteria in screening expression of miRNA: up-regulated or down-regulated expression of miRNAs ≥ 2 folds. Real-time PCR was used to assess the relative expression of miRNAs in joint fluid of the remaining KOA patients and healthy subjects (30 cases in group). Results Compared with normal controls, 3 miRNAs in which the up-regulated expression was ≥ 2 folds (miR-9, miR-155, and miR-98) and 4 miRNAs in which the down-regulated expression was ≥ 2 folds (miR-140, miR-27a, miR-146a, and miR-138) were found in the KOA group. The expression levels of miR-9, miR-155 and miR-98 were higher in KOA patients than those in healthy subjects, while the expression levels of miR-140, miR-27a, miR-146a and miR-138 were lower in KOA patients than those in healthy subjects (allP<0.05). Conclusion The expression of miR-9, miR-155 and miR-98 in joint fluid of KOA patients is up-regulated, and the expression of miR-140, miR-27a, miR-146a and miR-138 is down-regulated, and these differentially expressed miRNAs may be related to the pathogenesis of KOA.
osteoarthritis; knee; joint fluid; micro RNA microarray
吉林省教育廳“十二五”科學技術研究項目(吉教科合字[2012]第332號);吉林省衛生廳科研項目(2011ZC024);吉林醫藥學院附屬醫院院內基金資助項目。
穆尚強(1979-),男,副教授,研究方向為運動醫學。E-mail: 214145905@qq.com
梅繼文(1966-),男,副主任醫師,研究方向為關節及脊柱疾病、創傷。E-mail: MJW19660108@163.com
10.3969/j.issn.1002-266X.2016.48.002
R684.3
A
1002-266X(2016)48-0005-03
2016-03-26)

