藍莓原漿聯合益生菌灌胃治療大鼠非酒精性脂肪肝的效果及其機制
趙珮伶,任婷婷,祝娟娟,程明亮,王珺
(1貴州醫科大學,貴陽 550004;2貴州醫科大學附屬醫院)
藍莓原漿聯合益生菌灌胃治療大鼠非酒精性脂肪肝的效果及其機制
趙珮伶1,任婷婷1,祝娟娟1,程明亮1,王珺2
(1貴州醫科大學,貴陽 550004;2貴州醫科大學附屬醫院)
目的 觀察藍莓原漿聯合益生菌灌胃治療大鼠非酒精性脂肪肝的效果,并探討其機制。 方法 選取50只雄性SD大鼠,隨機分為正常組(NC組)、模型組(MC組)、藍莓原漿益生菌低劑量組(BPL組)、藍莓原漿益生菌中劑量組(BPM組)、藍莓原漿益生菌高劑量組(BPH組)。除NC組外其余4組均喂養高脂飼料制備非酒精性脂肪肝模型。BPL、BPM、BPH組造模后給予藍莓原漿原漿0.25、0.5、1.0 mL/100g和益生菌0.53×107、1.05×107、2.10×107CFU灌胃,1次/d。共12 周。第12周末觀察各組大鼠一般情況,然后處死大鼠,取血分離血清,檢測血清ALT、AST、TG、TC、LDL、HDL;取肝組織行HE及油紅O染色,光鏡下觀察肝組織病理變化;用TUNEL法檢測肝組織肝細胞凋亡指數(AI);用免疫組化法和Western blotting法檢測肝組織Fas、FasL蛋白;用實時熒光定量PCR法檢測肝組織Fas、FasL mRNA 。 結果 與MC組相比,BPL、BPM、BPH組大鼠血清中HDL、TG、TC、ALT、AST降低(P均<0.05)、LDL升高(P均<均0.05), 肝組織脂肪沉積減少, 肝細胞AI降低(P均<0.05), Fas、FasL蛋白和mRNA表達均降低(P均<0.05)。與BPL、BPM組相比,BPH組上述變化下降較為顯著。結論 藍莓原漿聯合益生菌治療高脂飲食誘導的大鼠非酒精性脂肪肝,能改善肝功能,減輕肝組織病理損傷,其機制可能與藍莓原漿聯合益生菌抑制肝細胞Fas、FasL表達繼而抑制肝細胞凋亡有關。
藍莓原漿;益生菌;非酒精性脂肪性肝病;脂肪酸合成酶;脂肪酸合成酶配體;細胞凋亡
非酒精性脂肪性肝病(NAFLD)包括非酒精性脂肪肝(NAFL)、非酒精性脂肪性肝炎(NASH)及其相關肝硬化。病理性氧化應激致使肝細胞受損,進一步誘發肝細胞過度凋亡是NAFLD發生發展的關鍵[1,2]。NAFLD發生過程中,細胞凋亡是肝細胞損傷和炎癥與脂肪化的樞紐,持續氧化應激加劇炎癥反應及肝細胞變性,進一步損傷肝細胞并誘發凋亡,加快NAFLD發展[3]。脂肪酸合成酶(Fas)及其配體FasL參與細胞凋亡相關受體信號轉導過程[4]。益生菌可改善腸道內菌群失調,減輕腸道內毒素水平及肝細胞凋亡。本課題組前期研究表明, 藍莓原漿有顯著的抗氧化效能且可預防大鼠的NAFLD。但未見將藍莓原漿和益生菌聯合治療大鼠NAFL的報道。本研究觀察了藍莓原漿聯合益生菌灌胃對NAFL大鼠肝功能、肝臟病理損傷程度、肝細胞凋亡程度和肝組織Fas、FasL表達的影響,評價藍莓原漿聯合益生菌治療大鼠NAFL的效果并探討其機制。現報告如下。
1 材料與方法
1.1 材料 SD大鼠50只, 清潔級, 體質量(155±20)g,購自貴州醫科大學動物實驗中心(批號SYXK黔2012-0001)。藍莓原漿購自貴州省麻江縣藍莓原漿基地。益生菌(含嗜酸乳桿菌、雙歧桿菌、腸球菌活菌)購自上海信誼藥業有限公司,規格: 210 mg /膠囊,含活菌5×107CFU/g。高脂飼料成分為88.2%普通飼料+10%豬油+1.5%膽固醇+0.2%膽酸鈉,購自江蘇美迪森生物有限公司,批號MD1205。Tunnel試劑盒購自武漢博士德生物技術有限公司,兔抗鼠Fas、FasL多克隆抗體購自Abcam公司,兔抗鼠Fas、FasL多克隆抗體(Abcam公司),兔抗鼠一抗和β-actin購自博士德生物技術有限公司,羊抗兔二抗標記物辣根過氧化物酶購自上海基因工程部,BCA定量蛋白試劑盒購自Biomiga公司,ECL化學發光試劑購自百樂公司,總RNA提取純化試劑盒購自Biomiga公司,SYBR PremixEx Taq Ⅱ(Tli RNaseH Plus)、RT reagent Kitwith gDNA Eraser(Perfect Real Time)購自寶生物工程有限公司(批號RR047A),Fas、FasL、β-actin引物購自寶生物工程有限公司,ViiA7 Real-time PCR System購自美國Applied 公司,NANO-drop 2000超微量分光光度計購自美國Thermal scientific公司,EPS-601電泳儀購自美國Amersham公司,SynergyH4多功能酶標儀購自美國Biotek公司,Olympus BX41顯微鏡圖像采集系統購自日本Olympus公司。
1.2 大鼠分組及藍莓原漿、益生菌應用 將50只大鼠隨機分為正常組(NC組)、模型組(MC組)、藍莓原漿益生菌低劑量組(BPL組)、藍莓原漿益生菌中劑量組(BPM組)、藍莓原漿益生菌高劑量組(BPH組),每組10只。除NC組外其余4組均喂養高脂飼料制備NAFL模型。BPL、BPM、BPH組造模后給予藍莓原漿原漿0.25、0.5、1.0 mL/100 g[5]和益生菌0.53×107、1.05×107、2.10×107CFU灌胃,1次/d。共12 周。NC和MC組每天給予等量生理鹽水灌胃,共12 周。
1.3 各組大鼠一般情況觀察 觀察記錄第12周各組大鼠一般情況,包括精神、反應、活動。
1.4 各組大鼠血清肝功能、血脂指標檢測 第12周末處死各組大鼠,眼動脈放血取血,分離血清,用全自動生化分析儀檢測血清ALT、AST、TG、TC、LDL、HDL。
1.5 各組大鼠肝組織脂肪變性情況及肝細胞內脂滴觀察 第12周末處死各組大鼠,提取肝上葉組織用4%甲醛固定,常規制作切片,行HE染色,光鏡下觀察肝組織損傷情況;行油紅O染色觀察肝細胞內脂滴。
1.6 各組大鼠肝組織肝細胞凋亡指數(AI)測算 取上述切片,常規脫蠟,蛋白酶K 修復,滴加TUNEL 混合液標記DNA片段,行DAB 顯色、復染,常規脫水透明,中性樹膠封片,普通顯微鏡下觀察。細胞核中有棕黃色顆粒者為凋亡細胞。每張蓋玻片隨機選取5 個400 倍不連續視野,每個視野計數100個細胞,計算各視野凋亡細胞占計數細胞總數的百分比,取其平均數為AI。
1.7 各組大鼠肝組織Fas、FasL蛋白檢測 ①免疫組化法:取上述肝組織切片行修復抗原、滅活內源性酶,滴加一抗1∶1 000(山羊抗鼠Fas、FasL多克隆抗體),滴加通用型二抗1∶2 500,行DAB 顯色和復染,常規封片。在每張蓋玻片隨機選取5 個400 倍不連續視野,觀察 Fas、FasL蛋白表達。Fas、FasL蛋白表達于肝細胞胞質中會呈現棕褐色顆粒。肝細胞胞質呈棕褐色為陽性染色。用Image-Pro Plus6.0系統分析圖像,Fas、FasL蛋白表達量用平均積分光密度值(AIOD)表示。②Western blotting法: 取各組大鼠肝組織,參照TRIzol試劑盒說明提取胞質蛋白, 加熱變性后行SDS-PAGE電泳,印記至PVDF 膜,一抗1∶2 000雜交4 ℃過夜, 二抗1∶10 000避光室溫雜交1 h, 化學發光劑曝光顯影, Gel DocEQ儀器掃描, Quantity One軟件分析結果。以β-actin為內參照,結果用目標蛋白表達量用其蛋白灰度值與內參蛋白灰度值的比值表示。
1.8 各組大鼠肝組織Fas、FasL mRNA檢測 采用逆轉錄實時定量PCR法。取各組大鼠肝組織,采用一步法提取100 g肝組織中的總RNA并純化,分析其完整性,測定RNA的濃度及純度,按First Stmnd cDNA synthesis Kit說明書進行逆轉錄合成cDNA后行qRT-PCR。以β-actin為內參照。Fas上游引物為5′- CTGGAATCCCAAGTCCTGAA-3′, 下游引物為5′- TAAAGCTTGACACGCACCAG-3′;FasL上游引物為5′- TAAAGCTTGACACGCACCAG-3′, 下游引物為5′- CAATGGGACACTGGCTTTTT-3′;β-actin上游引物為5′-TCCTCCTGAGCGCAAGTACTCT-3′,下游引物為5′-GCTCAGTAACAGTCCGCCTAGAA-3′。用2-ΔΔCt表示各組大鼠肝組織Fas、FasL mRNA相對表達量。

2 結果
NC組大鼠精神充沛、反應敏捷、活動正常,其余組大鼠精神萎靡、反應愚鈍、活動減少。與MC組相比,BPL、BPM、BPH組大鼠精神可,反應稍好,活動稍多。
2.1 各組大鼠血清肝功能和血脂指標比較 各組大鼠血清肝功能和血脂見表1。由表1可見,與NC組相比,MC、BPL、BPM、BPH組大鼠血清ALT、AST、TG、TC、LDL高(P均<0.05),HDL低(P均<0.05)。與MC組相比,BPL、BPM、BPH組大鼠血清ALT、AST、TG、TC、LDL低(P均<0.05),HDL高(P均<0.05)。BPL組和BPM組上述指標相比,P均>0.05。與BPL組和BPM組相比,BPH組大鼠血清ALT、AST、TG、TC、LDL低(P均<0.05),HDL高(P均<0.05)。
2.2 各組大鼠肝組織脂肪變性情況及肝細胞內脂滴比較 HE染色顯示NC組大鼠肝小葉和細胞無異常。MC組大鼠肝實質脂肪廣泛變性,其小葉結構紊亂,細胞彌漫性脂肪樣變,胞質有不同形狀的脂滴空泡,核變性或偏于一側,門管區及腺泡內可見細胞碎屑樣壞死和炎性浸潤。BPL組和BPM組脂肪變性程度較MC組略有差異,BPH組肝組織脂肪變性較輕,小葉形態和肝索布局欠完整,肝細胞輕度脂肪變,細胞內的炎性浸潤和壞死明顯減少。油紅O染色顯示NC組肝細胞正常;MC組肝細胞邊沿稍融合,核多呈印戒狀損傷且形狀不規則,胞質聚集橘紅色脂滴。BPL、BPM、BPH組較MC組肝細胞形態有所改善,脂滴沉積相對減少,其中BPH組改善最為明顯。
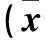
表1 各組大鼠肝功能指標和血脂水平比較±s)
注:與NC組相比,△P<0.05;與MC組相比,▲P<0.05;與BPL、BPM組相比,#P<0.05。
2.3 各組大鼠肝組織AI比較 NC、MC、BPL、BPM、BPH組肝組織AI分別為4.82%±1.13%、30.10%±2.67%、25.38%±1.79%、22.32%±3.14%、14.93%±2.45%。與NC組相比,MC、BPL、BPM、BPH組肝組織AI高(P均<0.05);與MC組相比,BPL、BPM、BPH組肝組織AI低(P均<0.05);與BPH組相比,BPM、BPL組肝組織AI低(P均<0.05);BPM、BPL組肝組織AI相比,P>0.05。
2.4 各組大鼠肝組織Fas、FasL蛋白比較 各組大鼠肝組織Fas、FasL蛋白AIOD和相對表達量見表2。與NC組相比,MC、BPL、BPM、BPH組肝組織Fas、FasL蛋白AIOD和相對表達量高(P均<0.05);與MC組相比,BPL、BPM、BPH組肝組織Fas、FasL蛋白AIOD和相對表達量低(P均<0.05);與BPH組相比,BPM、BPL組肝組織Fas、FasL蛋白AIOD和相對表達量低(P均<0.05);BPM、BPL組肝組織Fas、FasL蛋白AIOD和相對表達量相比,P均>0.05。
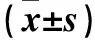
表2 各組大鼠肝組織Fas、FasL蛋白AIOD和相對表達量比較
注:與NC組相比,△P<0.05;與MC組相比,▲P<0.05;與BPL、BPM組相比,#P<0.05。
2.6 各組大鼠肝組織Fas、FasL mRNA比較 各組大鼠肝組織Fas、FasL mRNA見表3。與NC組相比,MC、BPL、BPM、BPH組肝組織Fas、FasL mRNA較高(P均<0.05);與MC組相比,BPL、BPM、BPH組肝組織Fas、FasL mRNA較低(P均<0.05);與BPH組相比,BPM、BPL組肝組織Fas、FasL mRNA較低(P均<0.05);BPM、BPL組肝組織Fas、FasL mRNA相比,P均>0.05。
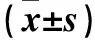
表3 各組大鼠肝組織Fas、FasL mRNA比較
注:與NC組相比,△P<0.05;與MC組相比,▲P<0.05;與BPL、BPM組相比,#P<0.05。
3 討論
NAFLD與肥胖、糖尿病、脂肪代謝紊亂、內毒素顯著相關,疾病發展由NAFL、NASH向其相關硬化和癌癥演變[7,8]。凋亡在NAFLD中是觸發NAFL向可能發展為肝纖維化和肝癌的 NASH進展的關鍵[9,10]。在NAFLD病程中,肝臟中大量的游離脂肪酸(FFAs)堆積將誘發肝細胞凋亡[11]。研究表明,其凋亡的歷程能趨化中性粒細胞并釋放TNF-α等炎癥因子,通過NF-κB和JNK等信號通路觸發炎癥,加重炎癥反應[12]。凋亡小體通過激活肝星狀細胞HSC或者Kuffer細胞,促肝纖維化形成,導致NAFLD病程進展[12、13]。
在細胞凋亡中,Fas/ FasL 系統主導凋亡性死亡受體信號轉導通路。FasL誘導Fas 結合后形成三聚體,使死亡結構域的Fas相關蛋白(FADD)在細胞內受體區域募集,形成死亡誘導信號復合體(DISC),觸發半胱天冬家族酶鏈反應,最終破壞細胞微結構,導致細胞凋亡[14]。
目前調整飲食和生活方式的是治療NAFLD的主要手段[7]。藍莓原漿具有強大的抗氧化效果,可清除生物體內的超氧陰離子自由基和減少炎癥損傷。本課題組前期研究發現[15],藍莓原漿調控HO-1、Nrf2蛋白的表達可增強肝細胞的抗氧化性,抑制細胞脂質過氧化,治療NAFLD。藍莓原漿還可以上調Bcl-2/bax的表達,阻遏NAFLD啟動程序性死亡[16]。益生菌具有修復腸道保護性屏障,降低腸源性內毒素水平和提升免疫系統活性等生理功能。NAFLD疾病嚴重程度同腸道菌群失調以及代謝變化密切相關[18]。Esposito等[18]研究表明益生菌通過減少高脂飲食誘導的小鼠肝脂質過氧化,降低TNF-α和NF-κB表達和的增強抗炎作用,緩解NAFLD小鼠的癥狀。
本研究結果顯示,與NC組相比,MC組大鼠精神情況欠佳;血清LDL、ALT、AST、TG、TC高,HDL低;肝小葉結構紊亂,有炎性浸潤、肝實質細胞脂肪變性及壞死;肝組織有紅色脂滴聚集;肝組織AI高;肝組織Fas、FasL表達高。說明高脂飲食致使大鼠代謝紊亂,肝臟脂質堆積,肝細胞炎性聚集及壞死,上調Fas、FasL表達,進一步誘導大量細胞凋亡,可促發大鼠NAFLD病情進展。與MC組相比,BPL、BPM、BPH組大鼠血清LDL、ALT、AST、TG、TC低,HDL高,肝組織,小葉結構較完整,肝索清晰,肝組織中脂肪變性、壞死和炎性浸潤減少。提示藍莓原漿聯合益生菌能糾正NAFLD大鼠體內糖脂代謝紊亂,減少肝臟脂肪沉淀,對抗氧化和炎癥損傷,對肝有一定的保護作用。但BPL和BPM組大鼠血清學指標、肝組織病理學改變無明顯差異性改變,表明藍莓原漿聯合益生菌對NAFL的治療效果無明顯量效關系。與BPL組和BPM組相比,BPH組大鼠肝組織AI及Fas、FasL表達下降最為明顯,且有統計學意義,說明高劑量的藍莓原漿聯合益生菌的干預作用效果顯著。與BPL組相比,BPM組大鼠肝組織AI及Fas、FasL表達差異無統計學意義,說明藍莓原漿聯合益生菌中低劑量干預效果相當。
綜上所述,藍莓原漿聯合益生菌治療高脂飲食誘導的大鼠NAFL,能改善肝功能,減輕肝組織病理損傷,其機制可能與藍莓原漿聯合益生菌抑制肝細胞Fas、FasL表達繼而抑制凋亡有關。
[1] Watanabe S, Hashimoto E, Ikejima K, et al. Evidence-based clinical practice guidelines for nonalcoholic fatty liver disease/nonalcoholic steatohepatitis[J]. J Gastroenterol, 2015,50(4):364-377.
[2] Eguchi Y, Hyogo H, Ono M, et al. Prevalence and associated metabolic factors of nonalcoholic fatty liver disease in the general population from 2009 to 2010 in Japan: a multicenter large retrospective study[J]. J Gastroenterol, 2012,47(5):586-595.
[3] Awad AS, A Haleem EN, El-Bakly WM,et al. Thymoquinone alleviates nonalcoholic fatty liver disease in rats via suppression of oxidative stress, inflammation, apoptosis[J]. Naunyn-Schmiedeberg's Arch Pharmacol,2016,389(4):381-391.
[4] Zhou Y, Xu JC, Jia YF, et al. Role of death receptors in the regulation of hepatocyte proliferation and apoptosis during rat liver regeneration[J]. GMR, 2015,14(4):14066-14075.
[5] Wang YP, Zhang BF. Protective effect of blueberry against acute hepatic injury in rats[J]. Chin Hepatol, 2009,14(1):33-35.
[6] 李延玲, 張懷宏, 翟玉峰. 益生菌對肝硬化大鼠肝細胞凋亡的干預作用[J]. 中國老年學雜志,2014,34(3):708-710.
[7] Younossi ZM, Koenig AB, Abdelatif D, et al. Global epidemiology of non-alcoholic fatty liver disease-meta-analytic assessment of prevalence, incidence and outcomes[J]. Hepatology, 2016,64(1):73-84.
[8] Pataky Z, Genton L, Spahr L, et al. Impact of hypocaloric hyperproteic diet on gut microbiota in overweight or obese patients with nonalcoholic fatty liver disease: a pilot study[J]. Digest Dis Sci, 2016,61(9):2721-2731.
[9] Li CP, Li JH, He SY, et al. Roles of Fas/Fasl, Bcl-2/Bax, and Caspase-8 in rat nonalcoholic fatty liver disease pathogenesis[J]. Genet Molecul Res, 2014,13(2):3991-3999.
[10] Ivey R, Desai M, Green K, et al. Additive effects of nicotine and high-fat diet on hepatocellular apoptosis in mice: involvement of caspase 2 and inducible nitric oxide synthase-mediated intrinsic pathway signaling[J]. Hormone Metab Res, 2014,46(8):568-573.
[11] Egnatchik RA, Leamy AK, Noguchi Y, et al. Palmitate-induced activation of mitochondrial metabolism promotes oxidative stress and apoptosis in H4IIEC3 rat hepatocytes[J]. Metab Clin Exp, 2014,63(2):283-295.
[12] Carter-Kent C, Zein NN, Feldstein AE. Cytokines in the pathogenesis of fatty liver and disease progression to steatohepatitis: implications for treatment[J].Am J Gastroenterol, 2008,103(4):1036-1042.
[13] Zhan SS, Jiang JX, Wu J, et al. Phagocytosis of apoptotic bodies by hepatic stellate cells induces NADPH oxidase and is associated with liver fibrosis in vivo[J]. Hepatology, 2006,43(3):435-443.
[14] Mollinedo F, Gajate C. Lipid rafts and clusters of apoptotic signaling molecule-enriched rafts in cancer therapy[J]. Future Oncol,2010,6(5):811-821.
[15] Huang W, Zhu Y, Li C, et al. Effect of blueberry anthocyanins malvidin and glycosides on the antioxidant properties in endothelial cells[J]. Oxidat Med Cellul Long, 2016,2016(2):1-10..
[16] 禹萍,任婷婷,程明亮,等.藍莓原漿對非酒精性脂肪性肝病大鼠Bcl-2、Bax表達的影響[J].世界華人消化雜志, 2016, 24 (6):842-850.
[17] Wu KT, Kuo PL, Su SB, et al. Nonalcoholic fatty liver disease severity is associated with the ratios of total cholesterol and triglycerides to high-density lipoprotein cholesterol [J]. J Clin Lipidol, 2016,10(2):420-450.
[18] Esposito E, Iacono A, Bianco G, et al. Probiotics reduce the inflammatory response induced by a high-fat diet in the liver of young rats[J]. J Nutrition, 2009,139(5):905-911.
國家自然科學基金資助項目(81560100);貴州省科技廳攻關項目(20103017);黔東南苗族侗族自治州林業局科研基金資助項目(LYJZFCG-2012-7)。
程明亮(E-mail: chengml@21cn.com)
10.3969/j.issn.1002-266X.2016.47.009
R575.5
A
1002-266X(2016)47-0032-04
2016-07-24)

