轉染miR-214抑制物的口腔鱗癌細胞SCC15增殖、遷移、侵襲能力變化及其機制
許馳強,肖金剛
(西南醫科大學附屬口腔醫院,四川瀘州646000)
轉染miR-214抑制物的口腔鱗癌細胞SCC15增殖、遷移、侵襲能力變化及其機制
許馳強,肖金剛
(西南醫科大學附屬口腔醫院,四川瀘州646000)
目的 觀察轉染miR-214抑制劑的口腔鱗癌SCC15細胞增殖、遷移、侵襲能力的變化,并探討其機制。方法 取體外培養的口腔鱗癌SCC15細胞,分為觀察組、陰性對照組和空白對照組,觀察組和陰性對照組分別用Lipofectamine2000轉染miR-214 抑制物、無關序列,空白對照組不轉染。采用實時熒光定量PCR法檢測轉染24 h時各組細胞中miR-214的表達,用CCK-8法觀察轉染24、48、72 h各組細胞增殖情況,用劃痕實驗觀察轉染24 h時各組細胞遷移能力,用Transwell實驗觀察轉染24 h時各組侵襲能力,用Western blotting法檢測轉染24 h時各組細胞中的Wnt通路拮抗因子Dickkopf 相關蛋白-3(DKK-3)及Wnt通路關鍵基因β-catenin蛋白。結果 轉染24 h時,與陰性對照組和空白對照組相比,觀察組細胞miR-214相對表達量低,劃痕愈合百分比低,穿膜細胞數少,β-catenin蛋白相對表達量低,DKK-3蛋白相對表達量高(P均<0.05)。轉染48、72 h觀察組OD值低于陰性對照組和空白對照組(P均<0.05)。結論 轉染miR-214抑制物的口腔鱗癌SCC15細胞增殖、遷移及侵襲能力下降。其機制可能是因為轉染miR-214抑制物能抑制Wnt/β-catenin信號通路相關蛋白DKK-3、β-catenin蛋白表達。
微小RNA;miR-214;口腔鱗狀細胞癌;細胞增殖;細胞遷移;細胞侵襲;Wnt信號通路;Dickkopf 相關蛋白-3;β-catenin蛋白
口腔癌是頭頸部較常見的惡性腫瘤之一,以鱗狀細胞癌最為常見,約占全身惡性腫瘤的3%[1],雖然近年來醫療水平不斷提高,新型藥物不斷開發應用,但口腔癌患者總生存率卻沒有得到明顯的提高[2、3],腫瘤侵襲及轉移是口腔癌患者死亡的重要原因。微小RNA(miRNAs)是一種單鏈非編碼RNA,與惡性腫瘤關系密切[4]。miR-214在口腔鱗癌中表達增高[5]。近期有研究報道miR-214通過Wnt信號通路影響食管癌[6]和肺癌[7]細胞的增殖、侵襲、轉移,但miR-214在口腔鱗癌增殖、侵襲、轉移過程中發揮的作用及機制尚不明確。本研究觀察了轉染miR-214 抑制物的口腔鱗癌SCC15細胞增殖、遷移、侵襲能力及Wnt通路拮抗因子Dickkopf相關蛋白-3(DKK-3)和Wnt通路關鍵蛋白β-catenin蛋白的表達變化,旨在明確轉染miR-214抑制物的口腔鱗癌SCC15細胞增殖、侵襲、轉移能力的變化及其可能機制。
1 材料與方法
1.1 材料 miR-214抑制物及陰性對照無關序列均購自廣州銳博生物科技公司,TRIzol試劑和脂質體2000(Lipofectamine2000)購自美國Invitrogen公司,實時熒光定量PCR相關試劑購自北京Promega公司,引物由上海生工公司設計合成,Transwell購自美國Corning公司,基質膠購自美國BD公司,CCK-8試劑盒購自上海東仁化學科技公司,β-catenin、DKK-3單克隆抗體和HRP標記羊抗鼠二抗購自美國Abcam公司。人口腔鱗狀細胞癌細胞系SCC15購自中國科學院典型培養物保藏細胞庫,人正常口腔黏膜角化細胞系HOK購自美國Sciencell公司。
1.2 細胞分組及轉染方法 口腔鱗癌SCC15細胞用含10%胎牛血清的RPMI1640培養基在37 ℃、5%CO2培養箱中常規傳代,取對數生長期細胞進行實驗。設觀察組、陰性對照組和空白對照組。觀察組和陰性對照組分別轉染轉染miR-214抑制物、無關序列,操作按Lipofectamine2000試劑盒說明書進行。空白對照組不轉染。
1.3 各組miR-214檢測 轉染24 h時采用實時熒光定量PCR法檢測各組miR-214相對表達量,TRIzol法提取細胞總RNA, 測RNA濃度,按逆轉錄試劑盒說明書逆轉錄合成cDNA。以2 μL cDNA配置PCR體系,PCR反應條件: 94 ℃ 2 min,94 ℃ 20 s,60 ℃ 30s,40個循環。以U6作為內參基因。每次實驗至少重復3次,miR-214表達量采用2-ΔΔCt法計算。
1.4 各組細胞增殖情況觀察 采用CCK-8法。 取轉染24、48、72 h各組細胞,將細胞接種于96孔板,向每孔加入10 μL CCK-8溶液,培養箱孵育2 h,用酶標儀測定450 nm處的光密度(OD)值。每組細胞設6個復孔,實驗重復3次。
1.5 各組細胞遷移能力觀察 采用細胞劃痕實驗。取轉染24 h各組細胞,將細胞接種于6孔板中,細胞生長完全融合后,用10 μL槍頭在孔板中心軸處沿直線輕輕劃痕,PBS沖洗去除漂浮細胞后繼續培養,培養24 h后在顯微鏡下觀察拍照,以細胞劃痕愈合百分比表示細胞遷移能力,細胞愈合百分比=(實驗前劃痕寬度-培養24 h后劃痕寬度)/實驗前劃痕寬度×100%。
1.6 各組細胞侵襲能力觀察 采用Transwell實驗。用Matrigel基質膠包被Transwell小室基底膜。收集轉染24 h各組細胞,重懸于無血清培液中饑餓培養16 h,向上室加入含1×105個細胞的細胞懸液,下層加入含10%FBS的培養基,37 ℃和5%CO2下孵箱培養24 h后取出,擦凈上層小室內未遷移的細胞,4%多聚甲醛固定,0.5%結晶紫染色,隨機選取顯微鏡下選5個視野,計數穿膜細胞數,取平均值。
1.7 各組SCC15細胞中DKK-3、β-catenin檢測 采用Western blotting法。收集轉染24 h各組細胞,加入配置預冷的RIPA裂解液,充分勻漿裂解提取總蛋白,BCA法測定蛋白樣品濃度。每組取30 μg蛋白上樣,SDS-聚丙烯酰胺凝膠上電泳30 min,5%脫脂牛奶室溫封閉1 h,加入適當濃度一抗,4 ℃過夜,次日洗膜后,加入HRP標記的二抗,室溫孵育1 h,洗膜后,將膜置于ECL中,于凝膠成像系統中曝光并采集圖像。結果以目的基因條帶灰度值與GAPDH條帶灰度值的比值表示。

2 結果
2.1 各組細胞轉染24 h miR-214相對表達量比較 觀察組、陰性對照組、空白對照組miR-214相對表達量分別為0.41±0.07、1.03±0.02、1.04±0.05。觀察組細胞miR-214相對表達量低于陰性對照組和空白對照組(P均<0.05);陰性對照組和空白對照組miR-214相對表達量差異無統計學意義。
2.2 各組轉染24、48、72 h細胞增殖情況比較 各組轉染24、48、72 h時OD值見表1。轉染48、72 h觀察組OD值低于陰性對照組和空白對照組(P均<0.05);陰性對照組和空白對照組OD值差異無統計學意義。轉染24 h各組OD值差異無統計學意義。
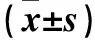
表1 不同時點各組OD值比較
2.3 各組轉染24 h細胞遷移能力比較 觀察組、陰性對照組、空白對照組劃痕愈合百分比分別為41.5%±3.1%、80.1%±5.0%、83.1%±6.1%。觀察組劃痕愈合百分比低于陰性對照組和空白對照組(P均<0.05),陰性對照組和空白對照組劃痕愈合百分比差異無統計學意義。
2.4 各組轉染 24 h細胞侵襲能力比較 觀察組、陰性對照組、空白對照組穿膜細胞數分別為(54±10)、(185±24)、(191±26)個/HP。觀察組穿膜細胞數少于陰性對照組和空白對照組(P均<0.05),陰性對照組和空白對照組穿膜細胞數差異無統計學意義。
2.5 各組轉染24 h細胞中DKK-3、β-catenin 蛋白表達比較 觀察組、陰性對照組、空白對照組DKK-3蛋白相對表達量分別為0.61±0.11、0.12±0.03、0.11±0.04,β-catenin 蛋白相對表達量分別為0.54±0.12、0.95±0.14、0.93±0.16。觀察組DKK-3蛋白相對表達量高于陰性對照組和空白對照組(P均<0.05),β-catenin蛋白相對表達量低于陰性對照組和空白對照組(P均<0.05);陰性對照組和空白對照組DKK-3、β-catenin 蛋白相對表達量差異無統計學意義。
3 討論
miR-214位于人1號染色體長臂(1q24.3)非編碼基因Dnm3os內[8],參與機體的細胞發育、細胞衰老及血管形成等生理過程[9、10]。近年研究發現miR-214在在多種惡性腫瘤中表達異常,與腫瘤發生發展關系密切[6]。Zhang等[11]發現miR-214在鼻咽癌組織和細胞中高表達,抑制鼻咽癌細胞miR-214的表達能夠促進癌細胞的凋亡并抑制其增殖。Penna等[12]報道miR-214在惡性黑色素瘤中表達增高,并且通過對抑癌基因TFAP2C的抑制促進腫瘤的進展。Zhang等[13]發現胰腺癌中miR-214的表達較癌旁組織明顯增高,上調胰腺癌細胞miR-214的表達能夠降低癌細胞對吉西他濱的敏感性,并且可能與miR-214對Wnt通路相關基因Wnt3A的調控有關。目前研究證實在多數惡性腫瘤中miR-214高表達,但Derfoul等[14]發現,乳腺癌組織中miR-214的表達較癌旁組織顯著下降。Wang等[15]發現miR-214在胃癌組織和胃癌細胞中表達下調,miR-214通過靶向CSF1影響癌增殖、侵襲和轉移。以上結果說明miR-214在不同的惡性腫瘤中存在異質性,可能與miR-214在不同惡性腫瘤中通過不同的靶基因參與惡性腫瘤的進展有關。Scapoli等[16]發現口腔鱗癌組織miR-214表達顯著增高,但未進行機制方面的研究。腫瘤的侵襲及轉移是腫瘤患者死亡的主要原因之一,研究證實miR-214通過不同的機制影響癌細胞的增殖、侵襲及轉移[6,7,11~15]等生物學行為。本研究結果顯示,觀察組口腔鱗癌SCC15細胞轉染miR-214 抑制物后,miR-214表達下調,細胞增殖、遷移、侵襲能力下降,說明miR-214在口腔鱗癌的進展中起著促癌基因的作用。
Wnt信號通路是多細胞真核生物中高度保守的信號通路[17],調控細胞的增殖、凋亡、分化等生理過程,Wnt/β-catenin通路是經典Wnt通路,也是目前研究最多、最深入的Wnt通路,Wnt/β-catenin通路主要通過激活β-catenin在核內的功能來調節靶基因,Wnt信號通路的異常激活是以細胞內β-catenin的積聚為特征,激活許多下游靶基因[18]參與多種惡性腫瘤的發生發展[19~22]。DKK-3是Wnt信號通路拮抗因子DDK家族成員之一,能夠阻止LRP-5、LRP-6與Wnt、Fz配體或受體復合物的結合,從而影響β-catenin在細胞質內的積聚,抑制經典Wnt信號通路[23,24]。已有研究表明miR-214在食管癌[6]、肺癌[7]、胰腺癌[13]等腫瘤中發揮的作用均與Wnt通路有關。本研究發現觀察組轉染miR-214抑制物下調SCC15細胞miR-214表達后,細胞內DDK-3表達上升,β-catenin的表達下降,說明miR-214對口腔鱗癌細胞增殖、遷移及侵襲行為的影響與Wnt/β-catenin通路的調控有關,miR-214可能通過對DDK-3及β-catenin表達的調控影響口腔鱗癌細胞的生物學行為,miR-214調控Wnt/β-catenin通路具體的機制尚需在后面的實驗中進一步研究證實。
[1] 鄭家偉,李金忠,張志愿,等.口腔鱗狀細胞癌臨床流行病學研究現狀[J].中國口腔頜面外科雜志,2007,5(2):83-90.
[2] Cannon TL,Lai DW,Hirsch D,et al.Squamous cell carcinoma of the oral cavity in nonsmoking women:a new and unusual complication of chemotherapy for recurrent ovariancancer[J]. Oncologist, 2012,17(12):1541-1546.
[3] Dibble EH,Alvarez AC,Truong MT,et al.18F-FDG metabolic tumor volume and totalglycolytie activity of oral cavity and oropharyngeal squamous cell cancer:adding value to clinical staging[J].J Nucl Med, 2012,53(5):709-715.
[4] Penna E, Orso F, Taverna D. miR-214 as a key hub that controls cancer networks: small player, multiple functions [J]. J Clin Investig Dermatol, 2015,135(4):960-969.
[5] Scapoli L,Palmieri A,Lo Muzio L,et al. MicroRNA expression profiling of oral carcinoma identifies new markers of tumor progression[J]. Int J Immunopathol Pharmacol, 2010,23(4):1229-1234.
[6] Xu Y,Lu S. Regulation of β-catenin-mediated esophageal cancer growth and invasion by miR-214[J] . Am J Transl Res, 2015,7(11):2316-2325.
[7] Qi W,Chen J,Cheng X,et al. Targeting the Wnt-regulatory protein CTNNBIP1 by microRNA-214 enhances the stemness and self-renewal of cancer stem-like cells in lung adenocarcinomas [J]. Stem Cells, 2015,33(12):3423-3436.
[8] Bar-Eli M. Searching for the 'melano-miRs': miR-214 drives melanoma metastasis[J]. EMBO J, 2011, 30(10):1880-1881.
[9] Chen H,Shalom-Feuerstein R,Riley J,et al. miR-7 and miR-214 are specifically expressed during neuroblastoma differentiation,cortical development and embryonic stem cells differentiation,and control neurite outgrowth in vitro[J]. Biochem Biophys Res Commun, 2010,394(4):921-927.
[10] Van Balkom BW,De Jong OG,Smits M,et al. Endothelial cells require miR-214 to secrete exosomes that suppress senescence and induce angiogenesis in human and mouse endothelial cells[J]. Blood, 2013,121(19):3997-4006.
[11] Zhang Z,Li Y,Wang H,et al. Knockdown of miR-214 promotes apoptosis and inhibits cell proliferation in nasopharyngeal carcinoma[J]. PLoS One, 2014,9(1):86149.
[12] Penna E,Orso F,Cimino D,et al. microRNA-214 contributes to melanoma tumour progression through suppression of TFAP2C[J]. EMBO J, 2011,30(10):1990-2007.
[13] Zhang XJ, Ye H, Zeng CW,et al. Dysregulation of miR-15a and miR-214 in human pancreatic cancer [J]. J Hematol Oncol, 2010,3(22):46.
[14] Derfoul A, Juan AH, Difilippantonio MJ, et al. Decreased microRNA -214 levels in breast cancer cells coincides with increased cell proliferation, invasion and accumulation of the Polycomb Ezh2 methyltransferase [J]. Carcinogen, 2011,32 (11):1607-1614.
[15] Wang Y, Shi D, Chen X,et al. Clinicopathological significance of microRNA-214 in gastric cancer and its effect on cell biological behaviour[J]. PLoS One, 2014,9(3):91307.
[16] Scapoli L,Palmieri A,Lo-Muzio L,et al. MicroRNA expression profiling of oral carcinoma identifies new markers of tumor progression[J]. Int J Immunopathol Pharmacol, 2010,23(4):1229-1234.
[17] Tian W,Han X,Yan M,et al.Structure-based discovery of a novel inhibitor targeting theβ-catenin/Tcf 4 interaction[J].Biochemistry,2012,51(2):724-731.
[18] Giles RH,van Es JH,Clevers H. Caught up in a Wnt storm: Wnt signaling in cancer[J]. Biochim Biophys Acta,2003,1653(1):1-24.
[19] Monin MB,Krause P,Stelling R,et al. The anthelmintic niclosamide inhibits colorectal cancer cell lines via modulation of the canonical and noncanonical Wnt signaling pathway[J]. J Surg Res, 2016,203(1):193-205.
[20] He J,Zhou M,Chen X,et al. Inhibition of SALL4 reduces tumorigenicity involving epithelial-mesenchymal transition via Wnt/β-catenin pathway in esophageal squamous cell carcinoma[J]. J Exp Clin Cancer Res, 2016,35(1):98.
[21] Ahmed RA,Alawin OA,Sylvester PW. γ-Tocotrienol reversal of epithelial-to-mesenchymal transition in human breast cancer cells is associated with inhibition of canonical Wnt signalling[J]. Cell Prolif, 2016,49(4):460-470.
[22] 楊莉,楊志宏. Wnt信號通路成分Wnt-5a和β-連接蛋白在卵巢癌組織中的表達及意義[J]. 山東醫藥,2015,55(36):61-63..
[23] Pannone G,Bufo P,Santoro A,et al.WNT pathway in oral cancer: epigenetic inactivation of WNT-inhibitors[J].Oncol Rep,2010,24(4):1035-1041.
[24] Yue W, Sun Q, Dacic S, et al. Downregulation of Dkk3 activates beta-catenin/TCF-4 signaling in lung cancer[J].Carcinogenesis,2008,29(1):84-92.
Changes in proliferation, migration and invasion abilities of oral squamous-cell carcinoma SCC15 cells transfected by miR-214 inhibitor and its mechanism
XUChiqiang,XIAOJingang
(TheAffiliatedOralHospitalofSouthwestMedicalUniversity,Luzhou646000,China)
Objective To investigate the changes in proliferation, migration and invasion abilities of oral squamous-cell carcinoma SCC15 cells transfected by miR-214 inhibitor, and to explore the mechanism. Methods The oral squamous-cell carcinoma SCC15 cells cultured in vitro were randomly divided into the observation group, negative control group and blank control group. SCC15 cells in the observation group and negative control group were transfected with miR-214 inhibitor and inhibitor-NC in vitro by using Lipofectamine2000, respectively, and SCC15 cells in the blank control group were not given any intervention. The real-time PCR was used to detect the expression of miR-214 at 24 h after transfection. CCK-8 assay was used to observe the proliferation of the cells at 24, 48 and 72 h after transfection. Scratch test and Transwell assay were used to observe the migration and invasion abilities of the cells at 24 h after transfection. Western blotting was used to explore the expression of Dikkopf-related protein-3 DKK-3 and β-catenin protein at 24 h after transfection. Results At 24 h after transfection, compared with the negative control group and blank control group, the expression of miR-214 and β-catenin protein and wound healing rate was significantly lower, the number of penetrating cells was significantly less and the expression of DKK-3 protein was significantly higher in the observation group (allP<0.05). The A450 in the observation group was lower than that in the negative control group and blank control group at 48 and 72 h after transfection (allP<0.05).Conclusion The proliferation, migration and invasion abilities of oral squamous-cell carcinoma SCC15 cells transfected with miR-214 inhibitor decrease, and the mechanism may be that the transfection of miR-214 inhibitor can inhibit the expression of DKK-3 andβ-catenin protein in Wnt/β-catenin signaling pathway.
micro RNA; miR-214; oral squamous-cell carcinoma; cell proliferation; cell migration; cell invasion; Wnt signal; Dickkopf-related protein-3; β-catenin protein
國家自然科學基金資助項目(81371125);四川省科技廳科研基金資助項目(2014JY0044);四川省教育廳科研基金資助項目(10ZB030);四川省衛計委科研基金資助項目(80170);西南醫科大學重點項目(201207);西南醫科大學科研基金資助項目(2014070)。
許馳強(1983-),男,醫學碩士,主治醫師,主要研究方向為口腔腫瘤的分子生物學機制。E-mail: dr_xcq@yeah.net
簡介:肖金剛(1975-),男,醫學博士,主任醫師,教授,碩士研究導師,主要研究方向為口腔頜面修復重建。E-mail: xjgkqk@yeah.net
10.3969/j.issn.1002-266X.2016.47.003
R739.8
A
1002-266X(2016)47-0009-04
2016-08-11)

