利用AhMITEI轉座子分子標記鑒定栽培花生雜交F1代種子真偽
2016-02-05 09:31:21尹亮任艷石延茂李雙鈴王輝袁美
山東農業科學
2015年12期
尹亮++任艷++石延茂++李雙鈴++王輝++袁美
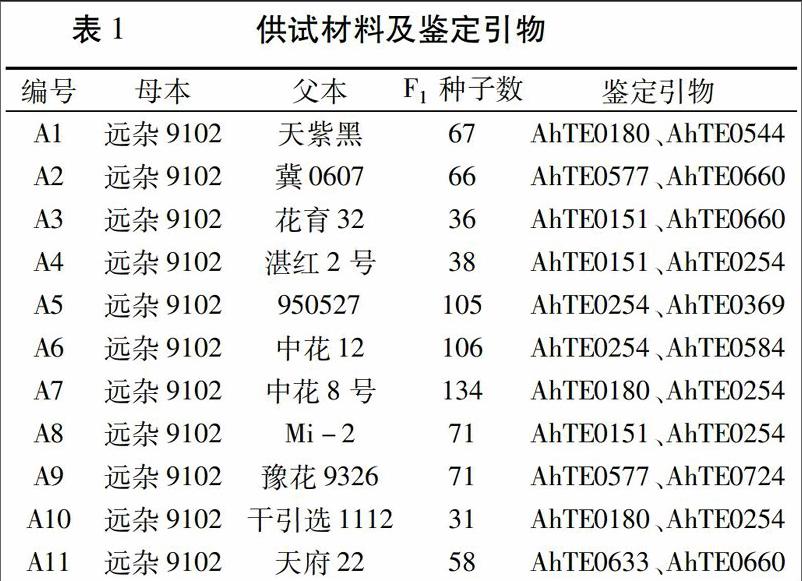

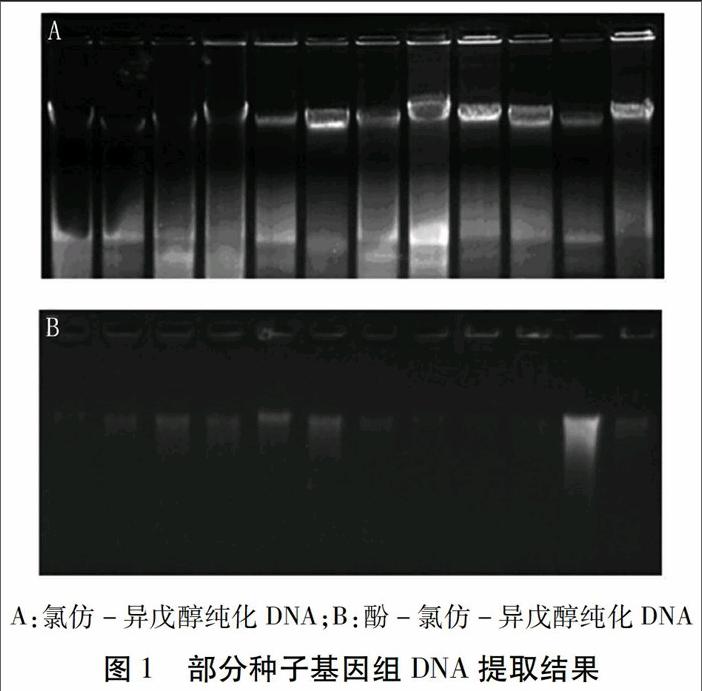
摘要:雜交育種是花生品種改良的主要方法之一,鑒定F1代雜交種子真偽并去除假雜種是雜交育種成功的前提。本研究建立起一套在不影響花生種子活力前提下提取花生F1代雜交種子子葉DNA,并結合Ah-MITE1分子標記鑒定技術,在播種前對花生F1代雜交種子真偽進行鑒定的技術,顯著提高了去除假雜種的準確性,將有助于提高花生品種選育的效率。
關鍵詞:花生;種子;雜種鑒定;轉座子;AhMITE1;分子標記
中圖分類號:S565.203.7 文獻標識號:A 文章編號:1001-4942(2015)12-0001-05
花生常規育種方法主要包括引種、系統育種、雜交育種和誘變育種等,其中雜交育種是目前最重要、最有效的育種方法。為培育適宜不同地區種植的優良花生品種,需要采用雜交轉育的方法使一些種質的優異性狀更加有效地得以利用。理論上講,通過現有的人工去雄授粉雜交技術獲得品種間真雜種F1的概率應該很大,但在實際操作過程中,由于花生花器結構較小、母本去雄不徹底以及自交花未摘除完全等原因導致母本自交形成偽雜種的情況難以避免。隨著分子生物學技術的不斷發展,利用分子標記對雜種F1代進行鑒定的技術已在花生育種及遺傳群體構建中得到廣泛應用,提高了育種效率。
微型反向重復轉座元件(Miniature Inverted-repeat Transposable Element, MITE)最早由Bureau等在玉米基因組中發現,后續研究證實其廣泛分布于單子葉及雙子葉植物基因附近或內部。MITE結構與非自主元件相似,具有TIR或TSD結構,但又具有反轉錄轉座元件的高拷貝性。……
登錄APP查看全文

