血漿miR-142-5p在肺癌早期診斷中的價值研究*
汪奇云,劉和錄,華建江,吳雄君,徐志康,劉 瓊
(廣州醫科大學附屬深圳沙井醫院檢驗科,廣東深圳 518104)
肺癌是最常見的惡性腫瘤之一,其病死率在各種惡性腫瘤中居首[1]。肺癌的早期診斷及早期治療至關重要。因臨床新發病例中大多屬于晚期肺癌,所以如果能早期診斷對肺癌的治療和預后具有非常重要的意義。現有檢查手段如X光敏感性低,難實現早期診斷;支氣管鏡檢法對于中央型肺癌的診斷比較有效,但是其缺點是一種侵入性檢查手段;CT掃描為廣泛非侵入性檢查方法,但其不能高效區分良性病變及肺癌。目前臨床肺癌早期診斷上缺乏高特異度、高靈敏度的血清學檢查辦法,因此如果能尋求早期特異的診斷方法,對提高患者的生存率具有重要意義。本研究通過實時熒光定量PCR檢測比較早期肺癌患者和健康成人血漿中游離miR-142-5p的表達水平,從而探討其作為肺癌患者早期診斷指標的臨床價值。
1 材料與方法
1.1 研究對象 在患者知情同意下,我們在廣州醫科大學附屬深圳沙井醫院和廣州醫科大學呼吸疾病研究所收集標本。挑選2014年4月~10月未經治療且處于疾病I,II期的新發病例,經病理學或細胞學確診的55例肺癌患者作為研究組(C),其中I期患者25例、II期30例,年齡60.71±10.62;53例健康成人作為對照組(N),年齡57.11±12.09。病人入選標準包括疾病局限于胸部,沒有遠端轉移的證據。標本采集前一年內沒有外科手術史和放射治療史。案例跟蹤兩年。癌癥和非癌癥樣本根據年齡、性別匹配,經統計學分析,差異無統計學意義(P>0.05)。
1.2 試劑與儀器 ABI stepone plus熒光PCR儀購自美國ABI公司;MiScrip ReverseTranscription Kit試劑盒購自德國Qiagen公司;普通PCR儀(SLAN-96P)購自上海宏石。
1.3 實驗方法
1.3.1 血漿收集:用EDTA-K2抗凝管抽取靜脈血液5.0 ml并混勻抗凝,30 min內于4℃,3 000 r/min離心10 min。上層血漿分裝至1.0 ml冷凍管,每管0.5 ml,置-80℃貯存備用。
1.3.2 miRNA提取:用miReasy Mini Kit試劑盒(Qiagen,德國)提取血漿中的miRNA。主要步驟如下:①向400 μl血漿中加入5倍體積的QIAzol試劑,室溫放置5 min;②加入等體積100%(v/v)氯仿,放置2~3min;③4℃,12 000 r/min離心15 min后將離心機調至室溫;④取上層水相300 μl,加入1.5倍體積100 g/dl乙醇,充分混勻;⑤將混合液依次轉移至RNeasy Mini spin column柱子中,12 000 r/min室溫下離心15 s,棄廢液;⑥加700 μl Buffer RWT,離心 (同上),棄廢液;⑦加500 μl RPE,離心(同上),棄廢液;⑧重復步驟⑦;⑨換新2 ml收集管,空轉2 min;用30 μl的RNease-free water溶解RNA。置于-70℃低溫冰箱備用。為將RNA提取效率及PCR數據標準化,在每個提取標本中加入25 fmol的合成線蟲miR-54(Cel-miR-54)。
1.3.3 RT-qPCR體系建立:應用miScript Reverse Transcription Kit 試劑盒(Qiagen,德國)于普通PCR儀上進行miRNA的逆轉錄。設計特異性引物:采用Primer5.0軟件設計,Cel-miR-54作為內參照,引物序列為TACCCGTAATCTTCATAATCCGAG,miR-142-5p引物序列為CATAAAGTAGAAAGCACTACT。由于血漿中miRNA的濃度較低,按照試劑盒說明書,取15 μl模板RNA+4 μl Buffer RT+1 μl Mix,反應體系為20 μl,反應條件為:37℃1 h,95℃5 min。qPCR反應采用miScript SYBR Green PCR Kit試劑盒,按照試劑盒說明書依次加入反應所需的cDNA模板和試劑:①1 μl cDNA+0.4 μl miRNA特異性引物+10 μl Mix+2 μl UP+6.6 μl H2O;②1 μl cDNA+0.4 μl U6 F/R+10 μl Mix+8.2 μl H2O。反應體系均為20 μl。反應條件為:95℃15 min,94℃30 s,55℃15 s,70℃30 s,設置2個重復孔,40個循環結束。反應在qPCR儀上進行(ABI step one plus)。
1.3.4 分析RT-qPCR數據:應用RT-qPCR技術檢測肺癌血漿中游離miR-142-5p的表達水平。miR-142-5p為目的基因,Cel-miR-54作為內參基因作數據的標準化處理。肺癌樣本作為研究組C,健康成人作為對照組N。目的基因的相對表達量(Re)應用2-△Ct公式進行計算,ΔCtc=Ctc目-Ctc內,ΔCtn=Ctn目-Ctn內,ΔCt值越小,表示基因相對表達量越高,對目的基因的相對表達量進行對數處理后,符合正態分布規律。
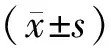
2 結果
2.1 肺癌患者與健康成人血漿中miR-142-5p結果比較 miR-142-5p在肺癌患者組的相對表達量為8.878 2±2.251 2,健康成人組相對表達量為12.000 0±3.694 4,肺癌組明顯高于健康成人組,差異有統計學意義(t=-5.325,F=13.561,P=0.000,P<0.01),同時測得FC值為8.704 7,數值>1,也表示miR-142-5p在肺癌組中高表達。
2.2 miR-142-5p在早期診斷肺癌的價值評估 為了更好地評價miR-142-5p在肺癌早期診斷的診斷價值,采用SPSS17.0軟件制作miR-142-5p的受試者ROC曲線圖,分析結果顯示,miR-142-5p診斷肺癌的ROC曲線下面積(AUC)為0.749,95%置信區間為0.657~0.841,同時得到臨床診斷臨界值為10.050,靈敏度為66.0%,特異度為83.6%,見圖1。
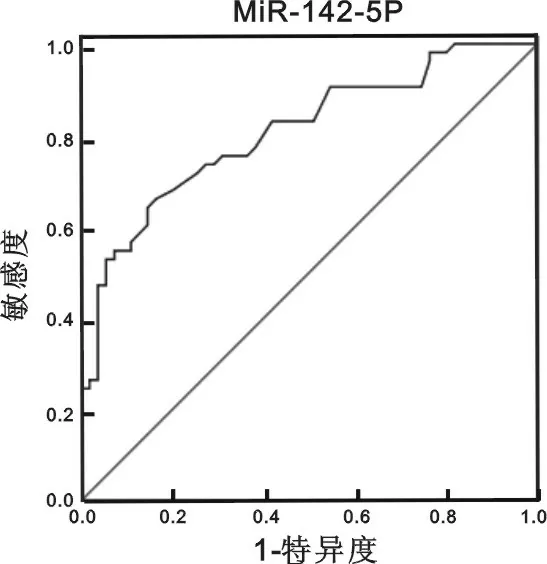
圖1 miR-142-5p的ROC分析
3 討論
3.1 微小RNA(microRNA或miRNA)是一類長度為18~24個核糖核苷酸組成的非編碼小分子RNA。它主要通過與靶標基因完全或不完全配對,降解靶標基因mRNA或抑制其翻譯,從而參與調控個體發育、細胞凋亡、增殖及分化等生命活動,并參與包括腫瘤在內的多種疾病過程[2,3]。Mitchell等[4]研究證實,miRNAs在血清或血漿中非常穩定,在高溫、驟冷,還有強酸、強堿條件下都不會被降解,特別是能夠抵抗RNA酶的降解,表明血清或血漿miRNAs可以作為足夠穩定的生物標記物來應用于臨床。近年來miRNA在腫瘤的診斷上價值也越來越受重視,Chen等[5]采用Solexa測序法對健康人血清、非小細胞肺癌血清的miRNA進行測序分析,結果顯示,肺癌患者血清miRNA分子譜與健康對照者明顯不同。miRNA還被發現可能成為新的肺癌早期診斷和癌癥進程相關的標記物,有助于肺癌的早期診斷和個性化治療[6]。有研究發現在某些常見腫瘤如膀胱癌[7]、食管鱗狀細胞癌[8]等某些miRNA存在異常表達。miRNA已經成為現代腫瘤學的研究熱點,為腫瘤的早期診斷、治療、預后提供了可靠的依據和新的方向。
3.2 miR-142位于人類17號染色體上,其含有兩個亞單位:miR-142-3p和miR-142-5p,分別為前體的3’端和5’端加工而來。有研究[9,10]發現, miR-142-5p在腎癌組織中表達量明顯高于癌旁組織,在特應性皮炎患者外周血單個核細胞中存在高表達。但關于miR-142-5p與肺癌關系的相關文獻報道較少,為探討miR-142-5p與肺癌關系我們采用RT-qPCR檢測肺癌及健康成人血漿中的miR-142-5p表達水平。RT-qPCR經證實為檢測miRNA最常用且有效的方法[11]。本研究結果發現miR-142-5p在肺癌組的相對表達量明顯高過健康成人組(P<0.01),提示miR-142-5p可能在肺癌的發生發展中起到重要作用。
3.3 ROC曲線是腫瘤標志物臨床應用中一種全面、準確評價診斷實驗的非常有效的方法。面積在0.5以下時無診斷價值;面積在0.5~0.7時有較低的準確性;面積在0.7~0.9時有較高的準確性;面積在0.9以上時準確性最高。我們通過ROC曲線對miR-142-5p對肺癌的診斷價值進行分析評價,發現ROC曲線下面積為0.749,由此可見,miR-142-5p對早期肺癌有一定的診斷價值。miR-142-5p診斷肺癌的特異度較高但敏感度不夠,可作為排除指標。由于尚無法進行大樣本研究,所以miR-142-5p診斷早期肺癌的特異度、靈敏度、準確度以及建立正常人群參考范圍等問題尚需進一步研究。可以預見,隨著臨床相關研究的開展,miR-142-5p作為肺癌的早期診斷指標將有更廣闊的應用前景。
[1] Jemal A,Siegel R,Xu J,et al.Cancer statistice,2010[J].CA Cancer J Clin,2010,60(5):277-300.
[2] Vasudevan S,Tong Y,Steitz JA.Switching from repression to activation:microRNAs can up-regulate translation[J].Science,2007,318(5858):1931-1934.
[3] Lin PY,Yu SL,Yang PC.MicroRNA in lung cancer[J].Rr J Cancer,2010,103(8):1144-1148.
[4] Mitchell PS,Parkin RK,Kroh EM,et al.Circulating microRNAs as stable blood-based markers for cancer detection[J].Proc Natl Acad Sci USA,2008,105(30):10513-10518.
[5] Chen X,Ba Y,Ma L,et al.Characterization of microRNAs in serum:a novel class of biomarkers for diagnosis of cancer and other diseases[J].Cell Res,2008,18(10):997-1006.
[6] Olson P,Lu J,Zhang H,et al.MicroRNA dynamics in the stages of tumorigenesis correlate with hallmark capabilities of cancer[J].Genes Dev,2009,23(18):2152-2165.
[7] 謝小娟,朱 娜,潘晶晶,等.miRNA-148a在膀胱癌組織中的表達及生物信息學分析[J].現代檢驗醫學雜志.2015,30(4):6-9,13.
Xie XJ,Zhu N,Pan JJ,et al.Expression of miRNA-148a in bladder carcinoma tissues and its bioinformatics analysis[J].Journal of Modern Laboratory Medicine,2015,30(4):6-9,13.
[8] 王 靜,王 成,張春妮.血清miR-25和miR-100作為食管鱗狀細胞癌診斷和預后標志物研究[J].現代檢驗醫學雜志.2015,30(5):17-21.
Wang J,Wang C,Zhang CN.Study on serum miR-25 and miR-100 as diagnostic and prognostic markers for esophageal squamous cell carcinoma[J].Journal of Modern Laboratory Medicine,2015,30(5):17-21.
[9] 趙 爽,王海峰,劉凌琪,等.miRNA-142-5p在腎細胞癌中高表達的研究[J].山東醫藥,2008,48(41):12-14.
Zhao S,Wang HF,Liu LQ,et al.Study on over-expression of miRNA-142-5p in renal cell carcinoma[J].Shandong Medical Journal,2008,48(41):12-14.
[10] 肖能鑫,史丙俊,刁慶春,等.miRNA-142-5p在特應性皮炎中的表達及其靶基因預測[J].重慶醫學,2013,42(15):1701-1702,1705.
Xiao NX,Shi BJ,Diao QC,et al.Expression of miRNA-142-5P in atopic dermatitis and its target gene prediction[J].Chongqing Medicine,2013,42(15):1701-1702,1705.
[11] Pall GS,Hamilton AJ.Improved northern blot method for enhanced detection of small RNA[J].Nat Protoc,2008,3(6):1077-1084.

