顯微鏡下全切或次全切術治療腦膠質瘤的綜合療效及預后影響因素分析
顯微鏡下全切或次全切術治療腦膠質瘤的綜合療效及預后影響因素分析
陳波,陳謙學
作者單位: 430060武漢大學人民醫院神經外科
通信作者: 陳謙學,E-mail:2775250843@qq.com
【摘要】目的探討顯微手術對腦膠質瘤的療效及患者術后1年預后的影響因素。方法2012年9月—2014年9月收治的80例腦膠質瘤患者按隨機數字表法分為研究組和對照組各40例,研究組在顯微鏡下行全切或次全切術,對照組行常規開顱切除手術;比較2組患者手術前1 d、術后3個月、術后6個月認知功能(MMSE評分)和日常生活能力(ADL評分),并檢測腦脊液精氨酸加壓素(AVP)、催產素(OT)、β-內啡肽(β-EP)、腫瘤壞死因子-α(TNF-α)水平。患者術后隨訪1年,分析患者性別、年齡、腫瘤分級、瘤體大小等一般資料與預后的關系。結果研究組術后1年MMSE評分明顯高于對照組,ADL評分顯著低于對照組(t=9.372、5.100,P<0.05);2組患者術后AVP、OT、β-EP、TNF-α水平均顯著降低(P<0.05),其中術后3個月、6個月研究組AVP、OT、β-EP顯著高于同時段對照組(P<0.05),而TNF-α水平比較差異無統計學意義(P>0.05)。研究組術后偏癱5例,失語癥2例,并發癥發生率為17.5%(7/40);對照組偏癱5例,失語癥1例,感染3例,并發癥發生率為22.5%(9/40),2組患者術后并發癥發生率比較差異無統計學意義(χ2=0.781,P>0.05)。多因素分析顯示病理分級、腫瘤大小是腦膠質瘤預后的危險因素,術后放化療是預后的保護因素(RR=1.094、1.387、0.513,P均<0.05)。結論顯微手術可改善腦膠質瘤患者認知、生活能力和提高神經肽水平;病理分級、腫瘤大小是腦膠質瘤預后的危險因素,術后放化療是預后的保護因素。
【關鍵詞】腦膠質瘤;顯微鏡手術;大骨瓣開顱術;神經肽;瘤壞死因子-α;預后
DOI【】10.3969 / j.issn.1671-6450.2015.08.007
收稿日期:(2015-04-14)
Comprehensive clinical effect of total removal or subtotal resection under microscope of gliomas and prognosis influencing factorsCHENBo,CHENQianxue.DepartmentofNeurosurgery,RenminHospitalofWuhanUniversity,Wuhan430060,China
Correspondingauthor:CHENQianxue,E-mail:2775250843@qq.com
Abstract【】Objective To investigate the effect of the surgical treatment for gliomas and the risk factors for 1 years after surgery prognosis.MethodsFrom September 2012 to September 2014, 80 cases of brain glioma patients were enrolled, according to the random number table method, they were divided into study group and control group, each group with 40 cases, the study group underwent total resection and subtotal resection, and the control group received routine craniotomy, 1 d before surgery, 3 months, 6 months after surgery,the cognitive function (MMSE score) and activities of daily living (ADL) were compared between the two groups, and detected cerebrospinal fluid (CSF) and arginine vasopressin (AVP) and oxytocin (OT), beta endorphin (β-EP), tumor necrosis factor alpha (TNF-α) levels. The patients were followed up for 1 year, and the relationship between gender, age, tumor grade, tumor size, and prognosis was analyzed.ResultsAfter 1 year’s MMSE score in study group was significantly higher than that of control group, ADL score was significantly lower than that of control group (t=9.372,t=5.100,P<0.05); two groups of patients’ postoperative AVP, OT, beta EP, TNF-α level were significantly decreased (P<0.05). The postoperative 3 months, 6 months’ AVP, OT, β-EP in study group were significant higher than the same time’s control group (P<0.05), and TNF-α level’s difference had no statistical significance (P>0.05). After operation, study group had hemiplegia in 5 cases, 2 cases of aphasia, complication rate was 17.5% (7/40); control group had hemiplegia in 5 cases, 1 cases of aphasia, 3 cases of infection, complication rate was 22.5% (9/40), two groups of patients’ postoperative complication rate did not show statistically significant differences (χ2=0.781,P>0.05). Multivariate analysis showed that pathological grading and tumor size are the risk factors of prognosis of gliomas, postoperative radiotherapy and chemotherapy are the protective factors for prognosis (RR=1.094, RR=1.387, RR=0.513,P<0.05).ConclusionSurgical microscope in improving cerebral glioma patients cognition, life ability and level of the neuropeptide aspects have a significant advantage; pathological grading and tumor size are risk factors for prognosis of glioma, postoperative radiotherapy and chemotherapy are the protective factor for prognosis.
Keywords【】Brain glioma; Microsurgical operation; Standard large trauma craniotomy; Neuropeptide; Tumor necrosis factor alpha; Prognosis
腦膠質瘤是主要的顱內惡性腫瘤,調查顯示其占顱內腫瘤的40%[1],發病率高、復發率高、預后差是該病的主要特點。手術是治療腦膠質瘤的主要方法,既往多采用傳統大骨瓣開顱術治療,雖然可將病灶組織切除,但對正常腦組織功能也會造成嚴重影響。隨著顯微外科的快速發展,顯微手術逐漸引入腦膠質瘤的治療。但是該術式要求較高,國內此項技術也剛起步,顯微手術對腦膠質瘤認知功能、作用機制的相關報道依然較少。本研究分別采用顯微手術與大骨瓣開顱術治療腦膠質瘤,比較2種術式的療效及可能作用機制,并進一步探討術后1年的預后影響因素,旨在為腦膠質瘤術式的選擇、預后的判定提供依據,報道如下。
1資料與方法
1.1臨床資料選擇2012年9月—2014年9月我院收治的腦膠質瘤患者80例作為研究對象,所有患者均經MR或CT檢查證實。男52例,女28例;年齡23~71(43.7±8.4)歲;病程1~13(5.3±1.9)個月;腫瘤長徑(多個病灶以各病灶最大徑之和計算)0.6~8.7(3.9±1.4)cm。參考WHO腦膠質瘤分類、分級標準[2]:I~II級45例,III~IV級35例。排除中樞神經系統疾病、免疫缺陷性疾病、全身嚴重感染、合并有其他惡性腫瘤者,術前常規檢查顯示患者肝、腎功能正常,無凝血功能異常。將80例患者按隨機數字表法分為研究組和對照組各40例,2組患者性別、年齡、腫瘤分級等基線資料比較差異無統計學意義(P>0.05),具有可比性。本研究經醫院倫理委員會批準,患者及家.屬同意并簽署知情同意書。
1.2手術方法術前行MR和CT檢查,根據檢查結果確定腫瘤位置,按照腫瘤位置選擇3種入路方式:功能區、重要血管區和非功能區。研究組:顯微鏡下行全切或次全切術;對照組行常規開顱術,再根據瘤體的類型選擇全切或次全切除。術后I~II級患者未經特殊處理,次全切除者術后給予放射治療;III~IV級者同時聯合放、化療,放療選擇直線加速器(西門子公司primns雙光子直線加速器),劑量40~60 Gy,共計28~32次;化療采用替莫唑胺(江蘇天士力帝益藥業有限公司)單藥化療方案:患者放療后口服替莫唑胺化療(劑量75 mg·m-2·d-1),共計42 d;對所有患者均進行常規隨訪12個月。
1.3檢測指標
1.3.1腦脊液神經肽指標、腫瘤壞死因子-α(TNF-α)水平: 手術前1 d、術后3個月、術后6個月抽取患者腦脊液3 ml,12 000 r/min離心5 min,取上清液并于-80℃冰箱中保存。TNF-α采用酶聯免疫吸附試驗檢測,試劑盒購自上海凱博生化試劑有限公司。神經肽:精氨酸加壓素(arginine vasopressin,AVP)、催產素(oxytocin,OT)、β-內啡肽(β-endorphin,β-EP)均采用放射免疫分析法檢測,試劑盒購自上海研謹生物科技有限公司。
1.3.2神經功能評價方法: (1)認知功能采用簡易精神狀態檢查表(minimum mental state examination,MMSE)[3]評價,MMSE包括定向力、記憶力、注意力和計算力、回憶能力、語言能力等5個大項,滿分30分,得分越高代表說明認知功能越好。(2)生活能力采用日常生活能力量表(activity of daily living scale,ADL)[4]評價,ADL包括軀體生活自理量表和工具性日常生活能力量表,一共14項,按照4度評價:自己完全可以做為1分,有些困難為2分,需要幫助為3分,根本無法做為4分,得分越高說明日常生活能力越低。
1.3.3預后隨訪: 從手術之日起隨訪至術后1年,統計1年生存率:自行設計調查表,將患者性別、年齡、腫瘤分級、瘤體大小等一般資料錄入調查表,分別采用單因素和多因素方法分析患者資料與1年生存率的關系。1年生存率=(1年后存活病例數/治療總病例數)×100%。
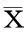
2結果
2.1神經肽指標、TNF-α水平比較術前2組患者AVP、OT、β-EP、TNF-α水平比較差異無統計學意義(P>0.05);術后4項指標均顯著降低(P<0.05),且術后3個月、6個月研究組AVP、OT、β-EP顯著高于同時點對照組(t=5.948、6.659、4.391;5.194、3.194、9.048,P<0.05);而術后3個月、6個月 2組TNF-α水平相比差異均無統計學意義(t=1.031、0.948,P>0.05)。見表1。
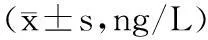
表1 2組患者手術前后腦脊液神經肽、TNF-α
2.2MMSE、ADL評分比較術后1年2組MMSE得分明顯高于術前,ADL顯著低于術前(P<0.05);研究組MMSE評分和ADL評分改善程度優于對照組(P<0.05)。見表2。
2.3并發癥比較研究組術后偏癱5例,失語癥2例,并發癥發生為17.5%(7/40);對照組偏癱5例,失語癥1例,感染3例,并發癥發生率為22.5%(9/40),2組比較差異無統計學意義(χ2=0.781,P=0.377)。
2.4預后影響因素分析術后1年死亡7例,1年生存率為82.5%;單因素分析顯示患者年齡、術前KPS評分、術式選擇、病理分級、腫瘤大小、術后放化療是影響腦膠質瘤預后主要影響因素,見表3。將具有統計學意義的單因素分析結果引入Logistic回歸方程,結果顯示病理分級、腫瘤大小是腦膠質瘤預后的危險因素,術后放化療是預后的保護因素。見表4。
3討論
目前手術是治療腦膠質瘤的主要方法,其中術者所應遵循的原則是將病變部位盡可能完全切除且對腦功能影響程度最低。傳統開顱術主要依賴于醫生對瘤體和正常腦組織的視覺定位,然而在實際操作中,手術者難以準確識別正常腦組織和瘤體的界限,導致手術效果不佳。蘇祖祿等[5]報道稱傳統手術治療腦膠質瘤其復發率較高,主要原因為開顱術難以完全切除瘤體。桂松柏等[6]還證實過度切除腦組織會損傷腦功能區,給患者神經功能造成影響,即使手術完成也可能給患者遺留嚴重的神經功能障礙。另外傳統開顱術由于需要開闊的手術視野,導致手術創面較大,正常腦組織長時間暴露也會影響患者的神經功能。隨著顯微外科技術的不斷發展,顯微手術逐漸開始應用于腦膠質瘤切除。理論上,顯微手術對瘤體能夠精準切除,且能夠避免正常腦組織的暴露,對患者的效果更佳。然而也有學者認為顯微技術難以準確區分腦組織和瘤體的界限,部分間變性星形細胞瘤難以完全切除,而部分切除又極易導致術后復發[7]。
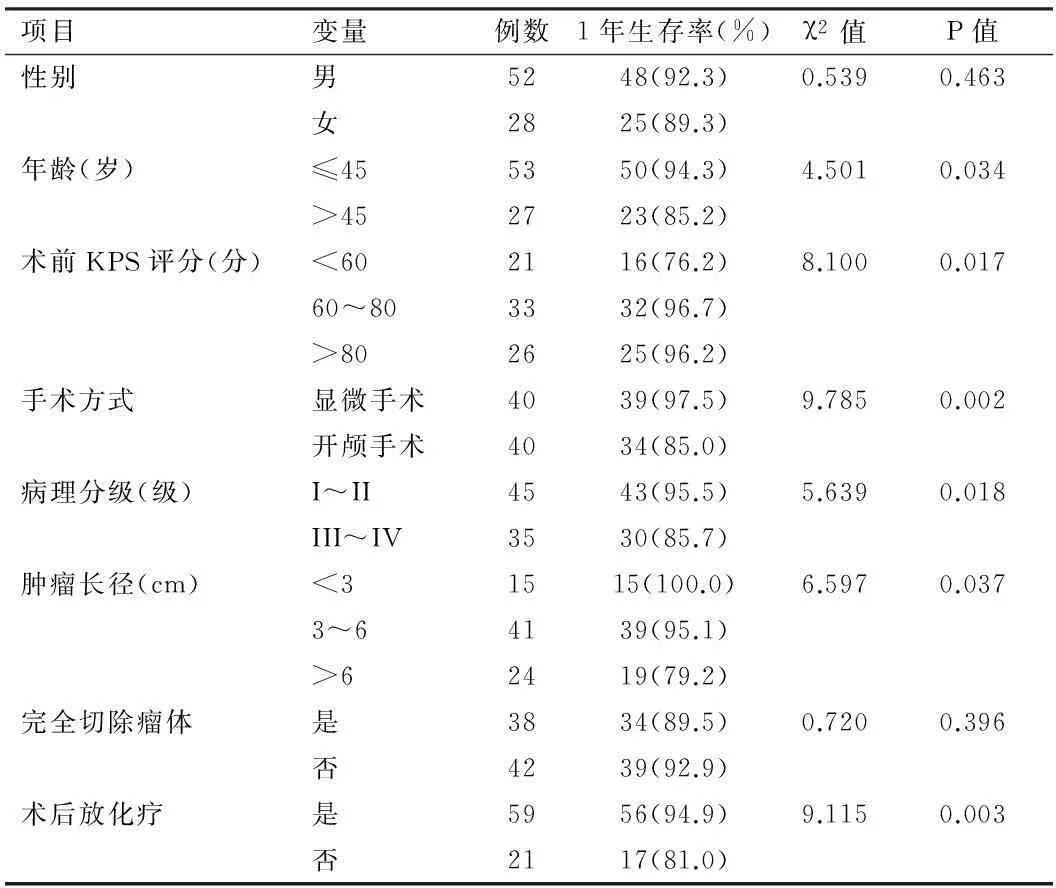
表3 預后影響因素單因素分析
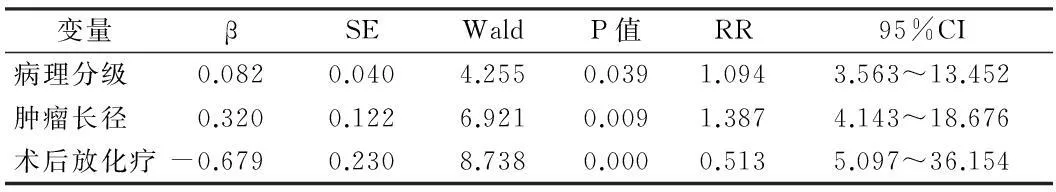
表4 腦膠質瘤預后影響多因素分析
本研究對腦膠質瘤患者分別采用顯微手術和傳統大骨瓣開顱術,結果顯示2組患者術后并發癥發生率相比差異無統計學意義。而術后神經功能相比,研究組MMSE得分顯著高于對照組,ADL顯著低于對照組,提示顯微手術在改善患者認知和生活能力方面具有明顯的優勢,這與Prabhu等[8]報道結論一致。神經肽是泛指存在于神經組織并參與神經系統功能作用的內源性活性物質,它在恢復腦神經細胞功能方面發揮著重要作用[9,10]。H?ring等[11]證實腦膠質瘤患者術后神經肽水平顯著降低,這是因為手術等侵襲性操作抑制了神經肽再生,導致患者術后神經功能受損。本研究顯示術后3個月、6個月研究組AVP、OT、β-EP顯著高于對照組,提示顯微手術后患者神經肽水平恢復更快,有利于改善患者神經功能。目前對于腫瘤患者體內TNF-α來源仍存在爭議,國外報道稱腫瘤患者體內TNF-α來源較多,包括巨噬細胞、腫瘤細胞或二者共同產生[12]。中樞神經系統屬于免疫豁免部位,但在腦膠質瘤等病理狀態下,仍可能存在細胞免疫或體液免疫[13,14]。本研究顯示,術前患者腦脊液TNF-α水平較高,這可能是腫瘤自身分泌或腫瘤負荷引起巨噬細胞分泌TNF-α;術后TNF-α水平顯著降低,我們推測可能與解除了荷瘤狀態有關,這一結論也被Gon?alves等[15]所證實。在此,我們做了進一步猜想:TNF-α能否作為腦膠質瘤預后的評價指標,以及不同病理分級下TNF-α水平是否存在差異,值得以后做進一步研究。
表2 2組患者術后認知功能、生活能力比較 ±s,分)
雖然手術聯合放、化療治療腦膠質瘤取得了一定效果,但患者的預后仍不容樂觀。羅飛[16]報道腦膠質瘤綜合治療后1、3、5年生存率分別為90.8%、54.8%和43.9%,說明影響腦膠質瘤預后的因素較多,需要對預后的相關因素深入研究。本組中,多因素分析顯示年齡、病理分級、腫瘤長徑、術后輔助放/化療是影響腦膠質瘤預后的主要因素。年輕的患者可能機體功能較好,術后恢復更佳。梁博等[17]報道稱腦膠質瘤患者年齡與生存時間呈負相關,即年齡越小,生存時間越長。低分級的腦膠質瘤惡性程度較低,腫瘤生長速度較慢,其病灶浸潤程度有限,術中容易完全切除。張杰等[18]也證實腦膠質瘤病理分級越高,其預后越差。饒良俊等[19]對腦膠質瘤直徑、體積和雙徑乘積的對數圖進行研究后發現,瘤體直徑與腫瘤細胞數量密切相關,因此在療效評價中多以腫瘤的長徑作為療效評估的標準。本研究顯示,腫瘤直徑越小,患者預后越好。雖然腫瘤的完整切除是外科手術的目標,但是實際操作中很難做到這一點,因此腦膠質瘤術后聯合放化療已成為專家的共識。Janssens等[20]報道稱術后聯合放療能夠使腦膠質瘤5年生存率提高15%以上。本研究亦顯示術后輔助放化療者1年生存率為94.9%,而未接受放/化療者僅為81.0%,提示術后聯合放化療者是一種較為滿意的治療方式。但是本研究存在一定局限性:(1)在研究術后腦脊液TNF-α水平時還需要考慮到手術的創傷給患者免疫功能造成的影響,其中應激性反應也會導致TNF-α升高[21~24]。(2)受時間限制,本研究隨訪僅為1年,因此單純從研究角度上看,所得出的預后影響因素還存在一定誤差,將會在接下來的長期隨訪中進一步分析。(3)病例數較少也是本研究的局限之一。
綜上所述,顯微手術在改善患者認知、生活能力和提高神經肽水平方面具有顯著優勢;病理分級、腫瘤大小是腦膠質瘤預后的危險因素,術后放化療是預后的保護因素。
參考文獻
1Kounelakis MG,Dimou IN,Zervakis ME,et al.Strengths and weaknesses of 1.5T and 3T MRS data in brain glioma classification[J].IEEE Trans Inf Technol Biomed,2011,15(4):647-654.
2楊桂芬,張龍江,盧光明,等.2007年WHO中樞神經系統新增腫瘤及腫瘤亞型的影像學表現(附6例報告)[J].放射學實踐,2010,25(1):29-32.
3Scazufca M,Almeida OP,Vallada HP,et al.Limitations of the mini-mental state examination for screening dementia in a community with low socioeconomic status: results from the Sao paulo ageing & health study[J].Eur Arch Psychiatry Clin Neurosci,2009,259(1):8-15.
4Garrod R,Bestall JC,Paul EA,et al.Development and validation of a standardized measure of activity of daily living in patients with severe COPD: the London Chest Activity of Daily Living scale (LCADL)[J].Respir Med,2000,94(6):589-596.
5蘇祖祿,陳浩皓,蘇海,等.顯微手術對87例腦膠質瘤患者認知、生活能力及血流灌注和神經肽水平的影響[J].重慶醫學,2014,43(5):534-536.
6桂松柏,白吉偉,于洮,等.成人單側丘腦膠質瘤手術技術探討[J].中華神經外科雜志,2013,29(3):251-254.
7陳曉豐,楊光,滕雷,等.熒光引導下腦膠質瘤邊界的組織病理學研究[J].中華神經外科疾病研究雜志,2012,11(2):145-148.
8Prabhu RS,Won M,Shaw EG,et al.Effect of the addition of chemotherapy to radiotherapy on cognitive function in patients with low-grade glioma: secondary analysis of RTOG 98-02[J].J Clin Oncol,2014,32(6):535-541.
9Gurkoff GG,Feng JF,Van KC,et al.NAAG peptidase inhibitor improves motor function and reduces cognitive dysfunction in a model of TBI with secondary hypoxia[J].Brain Res,2013,1515:98-107.
10Han RW,Zhang RS,Xu HJ,et al.Neuropeptide S enhances memory and mitigates memory impairment induced by Mk801,scopolamine or Aβ1-42 in mice novel object and object location recognition tasks[J].Neuropharmacology,2013,70:261-267.
11H?ring E,Harter PN,Seznec J,et al.The "go or grow" potential of gliomas is linked to the neuropeptide processing enzyme carboxypeptidase E and mediated by metabolic stress[J].Acta Neuropathol,2012,124(1):83-97.
12Tewari R,Choudhury SR,Ghosh S,et al.Involvement of TNFα-induced TLR4-NF-κB and TLR4-HIF-1α feed-forward loops in the regulation of inflammatory responses in glioma[J].J Mol Med (Berl),2012,90(1):67-80.
13秦麗娟,王東春,張田,等.熱療降低膠質瘤侵襲性的作用與TNF-α和Cx-43的關系[J].神經解剖學雜志,2012,28(3):268-272.
14Afanador L,Mexhitaj I,Diaz C,et al.The role of the neuropeptide somatostatin on methamphetamine and glutamate-induced neurotoxicity in the striatum of mice[J].Brain Res,2013,1510:38-47.
15Gon?alves J,Baptista S,Olesen MV,et al.Methamphetamine-induced changes in the mice hippocampal neuropeptide Y system: implications for memory impairment[J].J Neurochem,2012,123(6):1041-1053.
16羅飛.WHOⅢ級膠質瘤患者放療或聯合化療治療的預后因素分析[J].重慶醫科大學學報,2012,37(11):976-979.
17梁博,王新軍,周少龍.膠質瘤組織中 CPEB4和 Bcl-xL 的表達及預后影響因素分析[J].鄭州大學學報:醫學版,2013,(5):605-609.
18張杰,施慶余,羅愛林.麻醉期間目標導向液體治療對膠質瘤開顱切除術患者預后的影響[J].華中科技大學學報:醫學版,2012,41(1):99-102.
19饒良俊,張祥松,王曉燕,等.PET-CT多種顯像劑的應用與MRI對膠質瘤診斷價值對比分析[J].中華神經外科雜志,2013,29(10):1009-1012.
20Janssens GO,Gidding CE,Van Lindert EJ,et al.The role of hypofractionation radiotherapy for diffuse intrinsic brainstem glioma in children: a pilot study[J].Int J Radiat Oncol Biol Phys,2009,73(3):722-726.
21Deverse JS,Sandhu AS,Mendoza N,et al.Shear stress modulates VCAM-1 expression in response to TNF-α and dietary lipids via interferon regulatory factor-1 in cultured endothelium[J].Am J Physiol Heart Circ Physiol,2013,305(8):H1149-H1157.
22Di Tomo P,Canali R,Ciavardelli D,et al.β-Carotene and lycopene affect endothelial response to TNF-α reducing nitro-oxidative stress and interaction with monocytes[J].Mol Nutr Food Res,2012,56(2):217-227.
23Han CB,Ding ZN,Fan J,et al.Comparison of the stress response in patients undergoing gynecological laparoscopic surgery using carbon dioxide pneumoperitoneum or abdominal Wall-Lifting methods[J].Journal of Laparoendoscopic & Advanced Surgical Techniques,2012,22(4):330-335.
24張綠明,韓國慶,楊旭,等.大腦膠質瘤病10例臨床特點分析[J].疑難病雜志,2014,13(3):245-248.
論著·臨床
論著·臨床

