沙眼衣原體主要外膜蛋白21-387的原核表達及其免疫原性
劉巧瓊,涂建欣,林曉云,熊一融,朱珊麗,陳韶,張麗芳
(溫州醫科大學 分子病毒和免疫研究所、微生物學和免疫學教研室,浙江 溫州 325035)
·論 著·
沙眼衣原體主要外膜蛋白21-387的原核表達及其免疫原性
劉巧瓊,涂建欣,林曉云,熊一融,朱珊麗,陳韶,張麗芳
(溫州醫科大學 分子病毒和免疫研究所、微生物學和免疫學教研室,浙江 溫州 325035)
目的:探討沙眼衣原體(Ct)E血清型主要外膜蛋白(MOMP21-387)的原核表達及其免疫原性。方法:利用PCR方法擴增Ct E血清型MOMP第21至第387氨基酸的基因序列,克隆至pET21a(+)原核表達載體構建重組質粒pET21a(+)/MOMP21-387,并進行原核表達和純化,經SDS-PAGE和Western blot法分析鑒定后,通過BALB/c小鼠免疫檢測MOMP21-387蛋白的免疫原性,即通過ELISA法檢測小鼠血清IgG和生殖道分泌物IgA抗體反應,乳酸脫氫酶(LDH)法檢測其脾細胞的特異性殺傷作用。結果:在原核表達系統成功表達了MOMP21-387融合蛋白,經SDS-PAGE及Western blot法鑒定在相對分子質量(Mr)約44 000處出現特異性條帶;并經Ni-NTA親和層析的方法獲得了純化的MOMP21-387融合蛋白,免疫BALB/c小鼠可誘導產生特異性血清IgG抗體和生殖道分泌物IgA抗體,至第6周達到高峰,MOMP21-387組的IgG和IgA抗體較PBS組差異均有統計學意義(P<0.05);LDH檢測結果顯示,MOMP21-387組小鼠脾細胞對靶細胞的殺傷率,在10∶1、20∶1和40∶1和80∶1時均明顯高于PBS組,差異有統計學意義(P<0.05)。結論:Ct E型MOMP21-387融合蛋白具有良好的免疫原性,為基于MOMP21-387的Ct的ELISA法檢測方法的開發和疫苗研究奠定了基礎。
沙眼衣原體;主要外膜蛋白;原核表達;免疫原性
沙眼衣原體(Chlamydia trachomatis,Ct)是全球最常見的性傳播疾病(sexually transmitted diseases,STDs)病原體之一,通過性傳播感染可致不孕和不育[1],而E型Ct是目前泌尿生殖道感染最常見的血清型之一[2-3]。盡管有抗生素可供治療,但由于Ct耐藥性的增加及其潛伏感染、慢性遷延等特點[4],全球每年生殖道Ct感染的新發病例超過9 000萬[5]。因此,如何防治Ct感染是現在的研究熱點之一。主要外膜蛋白(major outer membrane protein,MOMP)是各型Ct的主要結構蛋白,含有豐富的抗原表位,是目前Ct疫苗及基于此的亞單位疫苗和表位疫苗研究的最佳靶抗原之一[6-8]。我們通過原核表達系統制備了Ct E血清型的MOMP21-387融合蛋白,并對其免疫原性進行了研究。
1 材料和方法
1.1 材料 Ct E型株購自美國典型物保藏中心(ATCC:VR.348B),由本實驗室保存傳代。P815細胞由本實驗室保存。6~8周齡雌性BABL/c小鼠18只,由上海實驗動物中心提供(No.WYDW2012-0041)。E.coli BL21(DE3)、DH5α菌株和質粒pET21a(+)表達載體購自Novagen公司。限制性內切酶、T4 DNA連接酶購自MBI公司。Taq Mix購自天根公司。IPTG、DNA marker、小規模質粒提取試劑盒、瓊脂糖膠DNA純化回收試劑盒均購自上海捷瑞公司。預染蛋白質分子質量(Mr)標準購自Fermentas公司。辣根過氧化酶(HRP)標記山羊抗鼠二抗購自上海聯科生物技術公司。小鼠抗His標簽的單克隆抗體(mAb)購自上海聯科生物技術有限公司,HRP-ECL顯色試劑盒購于碧云天公司。MOMP的CTL表位肽(SYVNVNMGL)由上海生工生物公司合成。LDH釋放試劑盒購于Promega公司。MOMP21-387基因引物設計與合成:以E 型Ct的MOMP基因為基礎,設計合成了兩條引物,正向引物為第21個氨基酸編碼的核苷酸起始,同時根據pET21a(+)質粒引入酶切位點。正向引入的酶切位點為BamHI,反向引入的酶切位點為SacI。正向引物:引物由上海生工生物公司合成。
1.2 方法
1.2.1 MOMP21-387基因的擴增:以Ct E型標準株為模板,PCR反應體系為:2×Taq Mix 10 μL,模板2 μL,正向引物(10 μmol/L)0.1 μL,反向引物(10 μmol/L)0.1 μL,ddH2O補齊20 μL。PCR反應條件:95 ℃預變性5 min;95 ℃變性30 s,58 ℃退火30 s,72 ℃延伸2 min,循環35次;再72 ℃延伸10 min。10 g/L瓊脂糖凝膠電泳鑒定PCR產物,并用DNA產物回收試劑盒純化PCR產物。
1.2.2 pET21a(+)/MOMP21-387重組質粒的構建和鑒定:將純化的PCR產物與pET21a(+)載體分別BamHI和SacI雙酶切,回收后經T4 DNA連接酶16 ℃酶連過夜,并轉化至DH5α感受態中,提取質粒,酶切和測序鑒定。
1.2.3 pET21a(+)/MOMP21-387重組質粒的原核表達:將鑒定好的pET21a(+)/MOMP21-387重組質粒轉化入E.coli BL21(DE3)感受態細胞中,37 ℃,250 r/ min培養過夜,按1∶100的比例接種入Amp+LB培養基中,37 ℃,250 r/min振蕩搖菌3 h,至吸光度(A)= 0.6~0.8。取出加入IPTG至終濃度為0.6 mmol/L,37 ℃,250 r/min誘導表達4 h,收集細菌。
1.2.4 MOMP21-387融合蛋白的純化:將收集的細菌用PBS洗滌并重懸,100 W 3 s、工作3 s、間歇超聲10 min;12 000 r/min 室溫離心10 min,棄去上清,5 mL 2 mol/L尿素重懸,室溫靜置30 min;12 000 r/min室溫離心10 min,5 mL 2 mol/L尿素洗滌1次,棄去上清,用包涵體溶解液(8 mol/L尿素)10 mL,4 ℃溶解包涵體沉淀3 h;12 000 r/min 4℃離心10 min,棄去沉淀,收集包涵體溶解液進一步用Ni-NTA親和層析法純化MOMP21-387融合蛋白,并用SDS-PAGE和Western blot法分析鑒定。鑒定成功的MOMP21-387融合蛋白加入蛋白復性液后,置于4 ℃PBS透析過夜。
1.2.5 MOMP21-387融合蛋白的SDS-PAGE電泳和Western blot法分析:將經誘導的細菌離心破碎后用120 g/L SDS-PAGE分離蛋白,考馬斯亮藍染色,分析蛋白表達情況。同時將另一塊SDS-PAGE膠轉至PVDF膜。用含50 g/L脫脂奶粉4 ℃封閉過夜,TBST洗膜5次,TBST中加入小鼠抗His標簽的mAb(1∶10 000),37℃搖床,孵育3 h;TBST洗膜5次,TBST中加入HRP標記的山羊抗小鼠IgG(1∶8 000)作為二抗,37 ℃孵育2 h;TBST洗膜5次,用ECL試劑盒中顯色液顯色,條帶出現后膠片壓片。
1.2.6 小鼠免疫程序及標本的收集:6~8周的雌性BABL/c小鼠18只隨機分為3組,即MOMP21-387組、Ct滅活組和PBS對照組,每組6只。MOMP21-387組用含弗氏佐劑的MOMP21-387蛋白以每只100 μg的劑量于實驗的第1、第3、第5周,分3次,多點皮下注射免疫小鼠。Ct滅活組以IFU(inclusion-forming unit)106/mL的劑量,于65 ℃滅活10 min后,和PBS對照組均取100 μL分別與弗氏佐劑等體積混合后免疫小鼠。實驗的第0、第2、第4、第6周小鼠分別采集陰道分泌物和斷尾采血。用無菌的PBS沖洗小鼠陰道,每次50 μL,沖洗4次,將沖洗液收集至滅菌的1.5 mL EP管中,加入蛋白酶抑制劑,-80 ℃冰箱保存。斷尾取血裝入1.5 mL EP管,37 ℃水浴靜置1 h,4 ℃,3 000 r/min,離心10 min,小心吸取上層血清于1.5 mL EP管中,-80 ℃冰箱保存。
1.2.7 ELISA法檢測體液免疫效應:Ct全菌體于65℃滅活10 min后,超聲破菌獲得Ct全菌體蛋白(IFU 104/mL)包被96孔酶標板,每孔100 μL,置于4 ℃過夜;洗滌,3 g/L BSA 37 ℃封閉1 h;洗去封閉液后,再分別加入1∶5稀釋的待檢測的小鼠陰道分泌物100 μL和1∶100的稀釋待檢測小鼠血清100 μL,37 ℃孵育1 h;PBST反復洗滌后,分別對應加入辣根過氧化物酶標記的山羊抗小鼠IgA(1∶1 000)和辣根過氧化物酶標記的山羊抗小鼠IgG(1∶2 000),37 ℃孵育1 h,酶標儀下于450 nm處讀取A值,用以檢測小鼠局部黏膜分泌型IgA和血清IgG的表達水平。所有的血清及分泌物標本均重復3孔檢測,并設計標準的陽性對照和陰性對照以及本底對照。
1.2.8 LDH釋放法檢測細胞CTL活性:于動物免疫的第8周,小鼠斷頭處死,無菌取脾細胞,加入10 μg/mL的MOMP21-387的CTL表位肽(SYVNVNMGL)體外刺激脾細胞4 d得效應細胞;取P815細胞與MOMP21-387的CTL表位肽20 μg/mL置于37 ℃培養箱,50 mL/L CO2共同孵育3 h得靶細胞;將效應細胞與靶細胞按效靶比10∶1、20∶1、40∶1和80∶1加入96孔板中,同時設定效應細胞自發釋放孔、靶細胞自發釋放孔、靶細胞最大釋放孔、培養基背景對照孔和體積校正孔,每種對照設3個平行孔。37 ℃,50 mL/L培養箱共同孵育5 h后,按照LDH釋放試劑盒說明書檢測CTL活性,以490 nm測得的A值,按以下方法計算。特異性細胞殺傷率=(A實驗孔-A靶細胞自發釋放-A效應細胞自發釋放+A培養基背景對照)/(A靶細胞最大釋放-A體積校正-A靶細胞自發釋放+A培養基背景校正)×100%。
1.3 統計學處理方法 采用SPSS13.0統計學軟件進行統計學處理。所有計量數據資料以±s表示,3組之間的抗體水平差異及特異性細胞殺傷率差異進行兩因素的方差分析(Two-way ANOVA),2組之間行兩獨立樣本的t檢驗分析。P<0.05為差異有統計學意義。
2 結果
2.1 pET21a(+)/MOMP21-387重組質粒鑒定 構建的pET21a(+)/MOMP21-387重組質粒經Bam HI和Sac I雙酶切,得到MOMP21-387重組基因片段為1 107 bp,與特異性引物擴增出的PCR產物大小一致,與預期一致(見圖1);將酶切鑒定正確的重組質粒進行測序分析,結果正確。
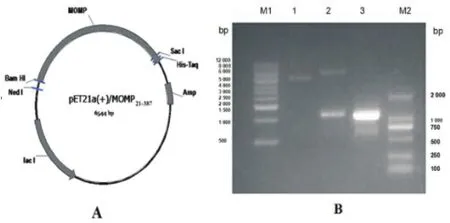
圖1 pET21a(+)/MOMP21-387重組質粒圖譜及雙酶切鑒定結果
2.2 MOMP21-387蛋白的表達、純化和鑒定 pET21a(+)/ MOMP重組質粒經原核表達系統誘導表達MOMP21-387融合蛋白,通過NI-NTA親和層析法進行純化,經SDSPAGE電泳及Western blot法分析驗證,結果顯示,在SDS-PAGE電泳圖上Mr大小約為44 000處出現濃染條帶,分子量大小與預期結果一致(見圖2A);以小鼠抗His標簽的單克隆抗體為一抗的Western blot法檢測結果顯示在目的位置有單一陽性條帶(見圖2B)。
2.3 小鼠血清中IgG抗體的ELISA法檢測 以滅活的Ct全菌體為ELISA包被抗原,檢測各組小鼠血清中特異性IgG抗體結果見圖3。3次免疫后,MOMP21-387組及Ct滅活組均誘導小鼠在血清中產生了特異性的IgG抗體,且3組之間差異均有統計學意義(P<0.05)。其中,MOMP21-387組小鼠血清中的IgG抗體表達水平高于PBS組,差異有統計學意義(P<0.05),而MOMP21-387組與Ct滅活組相比,其血清中IgG抗體表達水平差異也有統計學意義(P<0.05)。
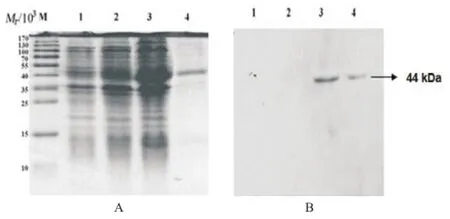
圖2 pET21a(+)/MOMP21-387融合蛋白的SDS-PAGE和Western blot法檢測結果
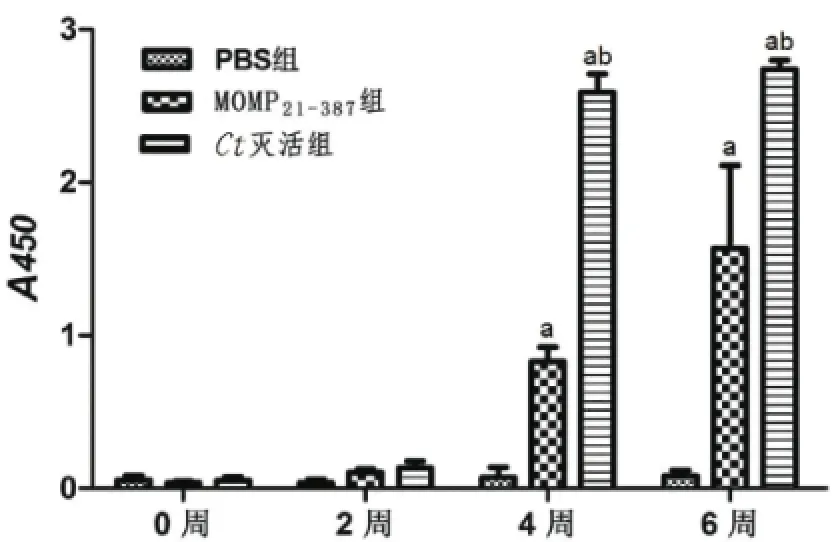
圖3 各組小鼠血清特異性IgG抗體的ELISA法檢測結果
2.4 小鼠分泌物中IgA抗體的ELISA法檢測 以滅活的Ct全菌體為ELISA包被抗原,檢測各組小鼠生殖道分泌物中特異性IgA抗體結果見圖4。3次免疫后,MOMP21-387組和Ct滅活組均誘導小鼠在分泌物中產生特異性的IgA抗體,且3組之間差異有統計學意義(P<0.05)。其中,MOMP21-387組小鼠生殖道分泌物中IgA抗體表達水平高于PBS組,差異有統計學意義(P<0.05),而Ct滅活組分泌物中IgA抗體表達水平高于MOMP21-387組,差異也有統計學意義(P<0.05)。
2.5 特異性的CTL活性檢測 利用LDH釋放試劑盒測定效應細胞(脾細胞)對靶細胞(P815)的殺傷結果,以MOMP21-387CTL肽孵育靶細胞及脾細胞,在效/靶比為10∶1、20∶1、40∶1的條件下,Ct滅活組靶細胞殺傷率分別達到:13.4%±3.4%,32.7%±3.9%,42.2%±2.7%,MOMP21-387組的殺傷率分別達到:14.5% ±2.6%,37.3%±1.9%,45.7%±3.5%(見圖5)。經兩因素方差分析后,效靶比(E/T)及組別均影響殺傷率,兩者具有交互作用(P<0.05),且在效/靶比10∶1、20∶1、40∶1及80∶1的條件下,Ct滅活組和MOMP21-387組殺傷效率均明顯高于PBS組(P<0.05)。具體來說,MOMP21-387組小鼠脾細胞殺傷靶細胞的效率明顯高于PBS,差異有統計學意義(P<0.05),而MOMP21-387組與Ct滅活組比較,殺傷效率差異無統計學意義(P>0.05)。

圖4 各組小鼠生殖道分泌物特異性IgA抗體的ELISA法檢測結果
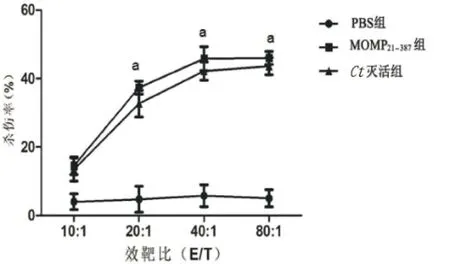
圖5 各組小鼠脾細胞CTL特異性殺傷結果
3 討論
基于pET載體的原核表達系統是目前原核蛋白表達引用最多的系統之一,它具有篩選便捷,蛋白高產及純化簡便等優勢[9]。但Ct的MOMP全長基因較難在pET載體的原核表達系統中表達,主要原因是組成Ct MOMP蛋白的起始22個氨基酸為信號肽(sign peptide),該信號肽雖不參與MOMP的主要生物學功能,但對大腸桿菌有毒性作用[10-12]。此外,根據影響蛋白穩定性的“N端原則”[13-15],當與N端Met相鄰的氨基酸為Arg、Lys、Phe、Leu、Trp、Tyr時,其蛋白容易降解[16]。而Ct E型MOMP全長蛋白,去除信號肽后的第1個氨基酸為Leu(即MOMP的第23個氨基酸),表達后易降解。因此,本研究直接從MOMP氨基酸肽鏈的第21個氨基酸開始設計,并在pET原核表達系統中成功表達了MOMP21-387融合蛋白。
為避免載體蛋白對目的蛋白的影響,本研究選擇PET21a載體,在設計上利用其多克隆位點的Bam HI(GGATCC),利用原核表達系統表達的目的蛋白MOMP21-387盡可能減少載體蛋白片段對實驗結果的干擾,經小鼠免疫可產生高效價的抗體,并經Western blot法分析,該蛋白可被特異性抗體識別,表明本研究制備的MOMP21-387融合蛋白具有較強的免疫原性和抗原性。
機體感染Ct可產生體液免疫和細胞的保護性反應,體液免疫表現為產生全身的血清IgG抗體和黏膜局部的IgA抗體[17-19]。本研究利用原核表達的MOMP21-387融合蛋白免疫小鼠,并檢測Ct特異性的血清IgG和分泌物IgA抗體水平以評價該蛋白的免疫原性。結果表明,MOMP21-387融合蛋白免疫組的特異性血清IgG及分泌物IgA抗體水平均高于PBS組,且差異具有統計學意義(P<0.05)。該結果與呂慧等[20]利用真核表達系統表達的MOMP蛋白結果相似,均能有效地刺激小鼠產生血清及局部黏膜特異性抗體。此外,本研究也對MOMP21-387融合蛋白所誘導的特異性CTL反應進行了檢測,結果表明免疫了融合蛋白的小鼠脾細胞在效靶比為10∶1、20∶1、40∶1和80∶1時,均對靶細胞有很強的殺傷作用,且與Ct滅活組相比,殺傷率差異無統計學意義(P>0.05),表明MOMP21-387融合蛋白有較強的CTL殺傷活性。提示本研究通過原核表達的MOMP融合蛋白有較強的誘導機體產生體液免疫和細胞免疫的免疫原性[18-19]。且MOMP全長蛋白去除起始端信號肽的20個氨基酸殘基,并不影響融合蛋白的免疫原性,可刺激小鼠產生良好的特異性體液免疫應答和細胞免疫應答。
綜上,本研究在原核表達系統成功表達并純化了E型Ct MOMP21-387融合蛋白,具有較強的免疫原性,此為后續的基于Ct MOMP的實驗室檢測方法的開發和疫苗研究等奠定了基礎。
[1]Hu VH, Holland MJ, Burton MJ, et al.Trachoma: protective and pathogenic ocular immune responses to Chlamydia trachomatis[J].PLoS Negl Trop Dis, 2013, 7(2): 1-13.
[2]Han Y, Yin YP, Shi MQ, et al.Difference in distribution of Chlamydia trachomatis genotypes among different provinces: a pilot study from four provinces in China[J].Jpn J Infect Dis, 2013, 66(1): 69-71.
[3]Donati M, Di Francesco A, D’Antuono A, et al.Chlamydia trachomatis serovar distribution and other concurrent sexually transmitted infections in heterosexual men with urethritis in Italy[J].Eur J Clin Microbiol Infect Dis, 2009, 28(5): 523-526.
[4]Choroszy-Krol IC, Frej-Madrzak M, Jama-Kmiecik A, et al.Characteristics of the Chlamydia trachomatis speciesimmunopathology and infections[J].Adv Clin Exp Med, 2012, 21(6): 799-808.
[5]幺山山, 曾明.沙眼衣原體疫苗的研發[J].國際生物制品學雜志, 2013, 36(1): 17-21.
[6]Ercolini AM, Miller SD.The role of infections in autoimmune disease[J].Clin Exp Immunol, 2009, 155(1): 1-15.
[7]Findlay HE, McClafferty H, Ashley RH, et al.Surface expression, single-channel analysis and membrane topology of recombinant Chlamydia trachomatis Major Outer Membrane Protein[J].BMC Microbiology, 2005, 5(1): 1-15.
[8]Zhu S, Chen J, Zheng M, et al.Identification of immunodominant linear B-cell epitopes within the major outer membrane protein of Chlamydia trachomatis[J].Acta Biochim Biophys Sin, 2010, 42(11): 771-778.
[9]Wallner M, Gruber P, Radauer C, et al.Lab scale and medium scale production of recombinant allergens in Escherichia coli[J].METHODS, 2004, 32(3): 219-226.
[10] Cheng C, Pal S, Tifrea D, et al.A vaccine formulated with a combination of TLR-2 and TLR-9 adjuvants and the recombinant major outer membrane protein elicits a robust immune response and significant protection against a Chlamydia muridarum challenge[J].Microbes Infect, 2014, 16(3): 244-252.
[11] Pal S, Theodor I, Peterson EM, et al.Immunization with the Chlamydia trachomatis mouse pneumonitis major outer membrane protein can elicit a protective immune response against a genital challenge[J].Infect Immunity, 2001, 69 (10): 6240-6247.
[12] Stephens RS, Mullenbach G, Sanchez-Pescador R, et al.Sequence analysis of the major outer membrane protein gene from Chlamydia trachomatis serovar L2[J].JB, 1986, 168 (3): 1277-1282.
[13] Jones HM, Kubo A, Stephens RS.Design, expression and functional characterization of a synthetic gene encoding the Chlamydia trachomatis major outer membrane protein[J].Gene, 2000, 258(1): 173-181.
[14] Tobias JW, Shrader TE, Rocap G, et al.The N-end rule inbacteria[J].Science, 1991, 254(5036): 1374-1377.
[15] Ucisik MN, Chakravorty DK, Merz KM Jr.Structure and dynamics of the N-terminal domain of the Cu(I) binding protein CusB[J].Biochemistry, 2013, 52(39): 6911-6923.
[16] Hirel PH, Schmitter MJ, Dessen P, et al.Extent of N-terminal methionine excision from Escherichia coli proteins isgoverned by the side-chain length of the penultimate amino acid[J].Proc Natl Acad Sci USA, 1989, 86(21): 8247-8251.
[17] Arsovic A, Nikolov A, Sazdanovic P, et al.Prevalence and diagnostic signifcance of specifc IgA and anti-heat shock protein 60 Chlamydia trachomatis antibodies in subfertile women[J].Eur J Clin Microbiol Infect Dis, 2014, 33(5): 761-766.
[18] Brunham RC, Rey-Ladino J.Immunology of Chlamydia infection: implications for a Chlamydia trachomatis vaccine [J].Nat Rev Immunol, 2005, 5(2): 149-161.
[19] Joyee AG, Yang X.Plasmacytoid dendritic cells mediate the regulation of infammatory type T cell response for optimal immunity against respiratory Chlamydia pneumoniae infection[J].PLoS ONE, 2013, 8(12): 1-13.
[20] 呂慧, 趙蔚明, 于修平, 等.E型沙眼衣原體MOMP基因重組腺病毒的構建及免疫原性研究[J].山東大學學報(醫學版), 2006, 44(12): 1189-1193.
(本文編輯:胡苗苗)
Prokaryotic expression and immunogenicity of major outer membrane protein 21-387 from Chlamydia tra-chomatis
LIU Qiaoqiong, TU Jianxin, LIN Xiaoyun, XIONG Yirong, ZHU Shanli, CHEN Shao, ZHANG Lifang.Institute of Molecular Virology and Immunology, Department of Microbiology and Immunology, Wenzhou Medical University, Wenzhou, 325035
Objective:To explore prokaryotic expression and immunogenicity of major outer membrane protein (MOMP21-387) of Chlamydia trachomatis serotype E.Methods:The gene encoding MOMP21-387was amplifed from genome DNA of C.trachomatis E by PCR analysis, and then cloned into pET21a (+) vector to construct recombinant plasmid pET21a (+)/MOMP21-387, and was expressed in the prokaryotic expression system.The MOMP21-387fusion protein was purifed and identifed by SDS-PAGE and western blot analysis.The immunogenicity was further assessed by immunizing BABL/c mice, the reactivity of specifc serum IgG in serum and genital tract mucosal IgA were tested by ELISA, and the specifc cytotoxicity of spleen cells was detected with lactate dehydrogenase (LDH) method.Results: The MOMP21-387fusion protein was successfully expressed in a prokaryotic expression system, and the specifc positive bands at the relative molecular mass (Mr) of about 44 000 was confrmed by SDS-PAGE and western blot analysis; And the purifed MOMP21-387fusion protein was obtained with the Ni-NTA affnity chromatography method.The mice can be induced to produce the specifc serum IgG and reproductive tract mucosal IgA by immunizing with the MOMP21-387fusion protein, and the value of the specifc serum IgG and mucosal IgAin immunized groups were signifcantly higher than that of the PBS control group (P<0.05), the antibodys detected by ELISA reached peak at the 6thweek post-immunization.The LDH analysis showed that, the killing rate of spleen cells to the target cell in MOMP21-387protein immunized groups was signifcantly higher than those in PBS control group, when the effector cells to target ratio reached to 10:1, 20:1, 40:1 and 80:1 (P<0.05).Conclusion:The MOMP21-387fusion protein of Chlamydia trachomatis serovar Eshows good immunogenicity, It may lay the foundation for the Chlamydia trachomatis ELISA detection and vaccine development based on MOMP21-387.
Chlamydia trachomatis; major outer memberane protein; prokaryotic expression; immunogenicity
·消 息·
R374.1,R392-33,Q344.13
A
10.3969/j.issn.2095-9400.2015.02.004
2014-07-21
國家自然科學基金資助項目(30972669);浙江省自然科學基金資助項目(Y2100611)。
劉巧瓊(1988-),女,湖南衡陽人,碩士生。
張麗芳,教授,博士生導師,Email:wenzhouzlf@126.com。

