利用鎂鋁雙金屬氧化物去除S2 - 的研究
王孝華,李傳強,湯琪,李榕榕
(重慶交通大學 應用化學系,重慶 400074)
煉油、石化、制藥、燃料、制革等工業生產過程中都會產生大量的含硫離子(S2-)廢水。廢水中的硫化物有毒性、腐蝕性,并具臭味,對環境造成極大的污染,因此含硫離子(S2-)廢水必須加以妥善的處理[1]。目前常見的含硫離子(S2-)廢水的物理化學處理方法主要有氧化法、堿吸收法和沉淀法。
層狀雙金屬氫氧化物(簡稱為LDHs)又稱水滑石,是一類具有層狀結構的新型無機功能材料。雙金屬氧化物(LDO)則是LDHs 在500 ℃左右焙燒得到的焙燒產物。目前,LDHs 及LDO 已廣泛應用于催化、離子交換、吸附以及功能助劑等諸多領域[2-8]。近年來在環境污染修復領域的研究也逐漸引起國內外學者的關注,取得了令人矚目的成果。而將LDO用于去除S2-的研究較少。鑒于此種情況,研究LDO 用于去除S2-的性能就有著重大的實際意義和應用前景。本文研究了LDO 用于去除S2-的性能,考察了S2-去除率與去除時間、反應溫度以及S2-的初始濃度的變化關系。
1 實驗部分
1.1 試劑與儀器
六水三氯化鋁、六水氯化鎂、氫氧化鈉、無水碳酸鈉、鹽酸、乙二胺四乙酸二鈉、氨水、氯化銨、三乙醇胺、五水硫酸銅、冰乙酸、乙酸鈉、硫酸、鉻黑T、硫化鈉、乙酸鉛均為分析純。
AL204 型電子天平;SHZ-D 循環水式多用真空泵;DHG-9076A 型電熱恒溫鼓風干燥箱;JJ-1 型定時電動攪拌器;DZ11-2 型恒溫水浴鍋;SX2-4-10 型實驗室電爐。
1.2 實驗方法
1.2.1 MgAl-LDO 的制備 按n(Mg)/n(Al)=2∶1的比例稱取氯化鎂和氯化鋁溶于100 mL 去離子水中配成混合鹽溶液。稱取一定量的氫氧化鈉和碳酸鈉溶于100 mL 去離子水中配成混合堿溶液。將混合鹽溶液裝入分液漏斗中,在攪拌的同時將混合鹽溶液在常溫下2 h 內滴入混合堿溶液中,用HCl 調節pH=9,攪拌,恒溫65 ℃晶化12 h,再靜置12 h,去掉上層清液洗滌至中性,抽濾,并干燥,得到鎂鋁雙金屬氫氧化物(MgAl-Cl-LDHs)濾餅。將所得鎂鋁雙金屬氫氧化物放于實驗室電爐(馬弗爐)中在500 ℃下煅燒后得到MgAl-LDO[9-13]。
1.2.2 LDO 對S2-的去除 利用1.2.1 節制備出的鎂鋁雙金屬氧化物(MgAl-LDO)去除S2-,并考察溶液的初始濃度、去除時間以及溫度對S2-去除率的影響。
1.3 分析測試
1.3.1 元素分析 準確稱取LDO 樣品0.3 g 于250 mL 燒杯中,加入少量水潤濕,滴加1∶1 HCl 4 ~6 mL,加熱使之溶解。冷卻后定量地轉入250 mL容量瓶中,用水稀釋定容,搖勻,備用。
1.3.1.1 鎂含量的測定 準確吸取25 mL 上述試樣于錐形瓶中,加入20 mL 水,5 mL 三乙醇胺,搖勻。加入10 mL 氨緩沖溶液,搖勻。最后加入少許鉻黑T 指示劑,然后用EDTA 標準溶液(0.02 mol/L)滴定至溶液由紫紅色變成純藍色,即為終點,平行滴定3 次。
試樣中Mg 的百分含量按下式計算:
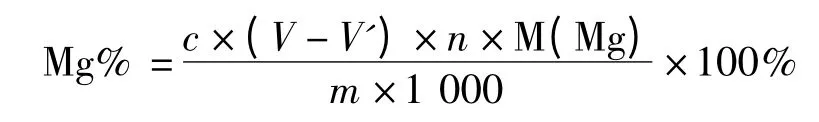
式中 c——EDTA 標準溶液的濃度,mol/L;
1.3.1.2 鋁含量的測定 (1)EDTA 標準溶液與硫酸銅標準溶液濃度的比較:先從滴定管中緩慢放10 mL EDTA 標準溶液(0.02 mol/L)于500 mL 燒杯中。用水稀釋至200 mL,將溶液加熱至60 ~70 ℃加入15 mL 乙酸-乙酸鈉緩沖溶液,加熱至沸,取下。加5 ~6 滴PAN 指示劑,以硫酸銅標準溶液(0.015 mol/L)滴定至溶液由黃色變成亮紫色即為終點。
(2)吸取40 mL 試樣于500 mL 燒杯中,準確加入20 mL EDTA 標準溶液(0.02 mol/L),然后用水稀釋至200 mL,將溶液加熱至60 ~70 ℃加入15 mL乙酸-乙酸鈉緩沖溶液(pH 約為4.3),此時溶液實際pH 值為3.8 ~4。煮沸1 ~2 min,取下。加5 ~6滴PAN 指示劑,以硫酸銅標準溶液(0.015 mol/L)滴定至溶液由黃色變成亮紫色即為終點。
試樣中Al 的百分含量按下式計算:
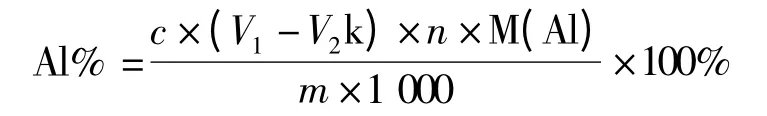
式中 c——EDTA 標準溶液的濃度,mol/L;

1.3.2 S2-去除率的測定 往含S2-的溶液(濃度c0)中加入一定量的鎂鋁雙金屬氧化物(MgAl-LDO),去除一段時間后,進行離心分離后取上層清液,加入過量醋酸鉛溶液,攪拌,待充分反應后抽濾,在75 ℃干燥箱中干燥1 h,稱量干燥后沉淀的質量,進而計算出去除后溶液中S2-的濃度(濃度c),即可得到S2-的去除率。
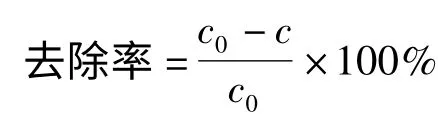
2 結果與討論
2.1 元素分析
2.1.1 鎂含量的分析 利用1.3.1.1 節中的鎂元素的分析方法進行分析,稱取樣品的質量為0.304 4 g,配成250 mL 溶液,取其中的25 mL 進行絡合滴定。平行滴定3 次,當溶液由紫紅色變成純藍色時,所消耗的EDTA(0.02 mol/L)的量見表1。

表1 測定鎂所用EDTA 的量Table 1 The amount of EDTA in determining magnesium
2.1.2 鋁含量的分析 按照1.3.1.2 節(1)的方法,EDTA 標準溶液與硫酸銅標準溶液濃度的比較結果為:10 mL 的EDTA(0.02 mol/L)需要14.1 mL硫酸銅(0.015 mol/L)溶液進行絡合滴定,即k =10/14.1。
按照1.3.1.2 節中分析鋁的方法,取上述所配試樣40 mL,加入20 mL EDTA(0.02 mol/L)溶液,以硫酸銅標準試液進行滴定至由黃色變為亮紫色,平行滴定3 次,所消耗的硫酸銅標準試液的量見表2。
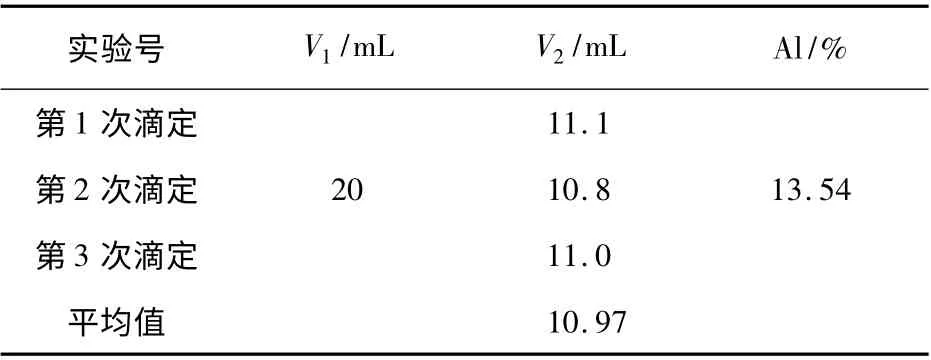
表2 測定鋁所用EDTA 的量Table 2 The amount of EDTA in determining aluminum
2.1.3 結構分析 LDO 具有與二價金屬氧化物相似的晶體結構,其組成通式為:
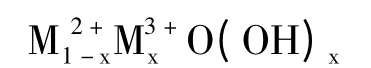
其中,M2+= Mg2+、Ni2+、Ca2+、Zn2+、Cu2+等;M3+=Al3+、Fe3+等;x 是M3+與[M2++M3+]的物質的量之比[14-15]。
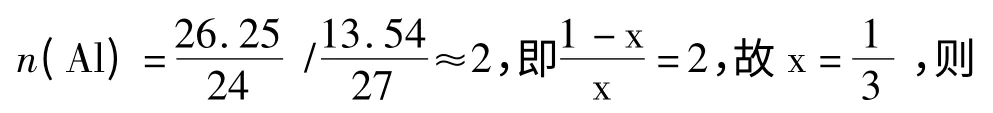
2.2 去除時間對去除率的影響
量取已配制好的10 g/L 的硫化鈉溶液20 mL于試管中,加入準確稱取的0.20 g LDO 粉末,常溫攪拌,用稀鹽酸調節pH =9。反應1,2,4,6,8 h 后分別測定S2-的去除率。去除時間對去除率的影響見圖1。
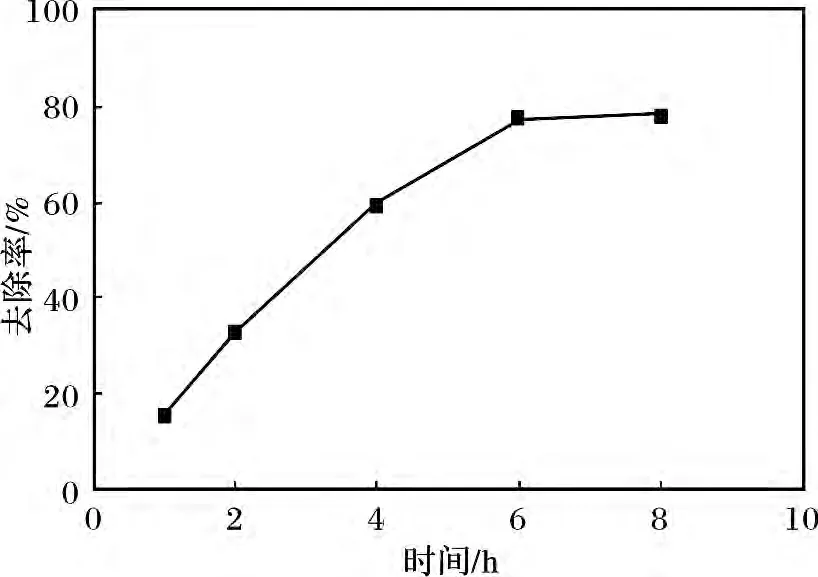
圖1 去除時間對去除率的影響Fig.1 The influence of the removing time on the removal rate
由圖1 可知,去除時間<2 h 時,S2-去除率增加較為緩慢,反應2 ~4 h 時,S2-去除率增大,去除時間超過6 h 后S2-去除率增加趨勢趨于平緩,去除時間為8 h,去除率可達77.75%左右。
根據參考文獻[1]可知,S2-去除率隨時間變化的主要原因是,在pH =9 的溶液中的S2-主要以HS-形式存在,且H+的離子半徑僅為10-3pm,S2-的離子半徑(184 pm)與Cl-的離子半徑相近,理論上為HS-而非S2-進入層間形成MgAl-HS-LDHs。隨著去除時間的增加,由于S2-有還原性容易被空氣中的O2氧化且MgAl-LDO 具有催化氧化性,因此在實驗中不可避免的伴隨有部分硫離子由-2 價被氧化成高價態進入層間使其層間間距增大,由于它和層板間有非常強的作用力,其他陰離子很難將其交換出來,因此隨著時間進一步增加對硫離子的去除效果不明顯。
2.3 硫離子初始濃度對去除率的影響
量取已配制好的5,10,15,20,25,30 g/L 的硫化鈉溶液于點滴瓶中,加入準確稱取的0.200 0 g LDO 粉末,常溫攪拌,用稀鹽酸調節pH=9 后,用蒸餾水定容至20 mL,靜置8 h 后分別測定S2-的去除率。硫離子初始濃度對去除率的影響見圖2。
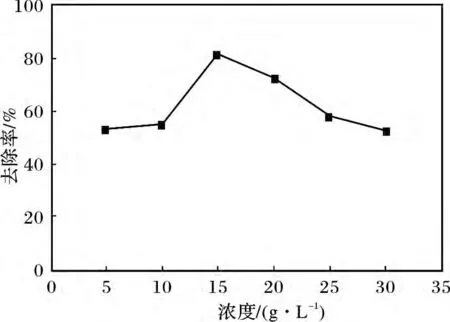
圖2 硫離子初始濃度對去除率的影響Fig.2 The influence of the initial concentration of S2-on the removal rate
由圖2 可知,S2-的初始濃度<10 g/L 時,去除率增加極為緩慢,當S2-的初始濃度處于10 ~20 g/L 時,去除率迅速增加,并在15 g/L 達到最大值,為81.93%左右,當S2-的初始濃度>15 g/L 時,去除率開始下降。造成這種結果的原因是當S2-的初始濃度較小時,S2-主要以HS-的形式存在,HS-進入層間,形成MgAl-HS-LDHs。而當S2-的初始濃度較大時,S2-具有還原性容易被空氣中的O2氧化且MgAl-LDO 具有催化氧化性,因此在實驗中不可避免的伴隨有部分硫離子由-2 價被氧化成高價態,進入層間使其層間間距增大,由于它和層板間有非常強的作用力,其他陰離子很難將其交換出來,因此對硫離子的去除率逐漸下降。
2.4 溫度對去除率的影響
量取已配制好的10 g/L 的硫化鈉溶液20 mL于試管中,加入準確稱取的0.2 g LDO 粉末,常溫攪拌,用稀鹽酸調節pH =9。分別于常溫(19.8 ℃),40,60 ℃條件下反應8 h 后分別測定S2-的去除率。溫度對去除率的影響見圖3。
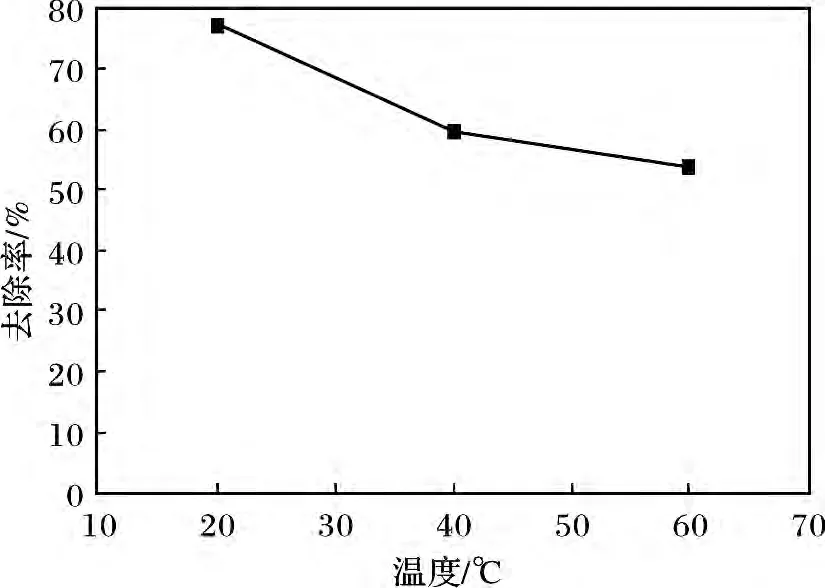
圖3 溫度對去除率的影響Fig.3 The influence of temperature on the removal rate
由圖3 可知,隨著溫度的增加,S2-去除率逐步下降,在常溫(19.8 ℃)下去除率最大,為78.09%左右,因此可以認為溫度的升高對MgAl-LDO 的去除效果不利,其原因是溫度的升高加速了S2-的催化氧化性,促使生成更多的S2O32-,S2O32-進入層間使其層間間距增大,由于它和層板間有非常強的作用力,其他陰離子很難將其交換出來,因此對硫離子的去除率逐漸下降。
3 結論
(1)通過共沉淀法合成層狀雙金屬氫氧化物(LDHs),將nMg/nAl=2∶1 的LDHs 在500 ℃焙燒下得到產物MgAl-LDO。利用絡合滴定的方法測定合成的鎂鋁雙金屬氧化物(MgAl-LDO)中鎂和鋁的含量,對合成的MgAl-LDO 進行元素分析,進而對結構進行了分析,得到鎂鋁雙金屬氧化物的結構式為Mg2AlO3(OH)。
(2)在溶液的pH =9 條件下,利用所制得的MgAl-LDO 去除S2-,同時考察了溶液的初始濃度、去除時間以及溫度對S2-去除率的影響。結果表明,MgAl-LDO 具有較好的去除S2-能力,當去除時間為8 h,溶液初始濃度為15 g/L,常溫(19.8 ℃)下,對S2-的最大去除率為81.93%。主要原因是pH=9 時,S2-發生水解且主要以HS-存在于溶液中,HS-通過LDO 結構恢復能迅速進入層間,且受MgAl-LDO 的催化氧化性能的影響,在結構恢復的同時HS-被氧化成S2O32-,可以有效去除溶液中的S2-。
由于目前實驗條件下對S2-去除率比較低,主要是由于MgAl-LDO 具有催化氧化性,因此在實驗中不可避免的伴隨有部分硫離子由-2 價被氧化成S2O3
2-進入MgAl-LDO 樣品層間,而且S2O32-和層板間有非常強的作用力,其他陰離子很難將其交換出來。因此,如何消除S2O3
2-競爭吸附的影響將成為今后研究工作的重點。
[1] 劉淼,楊俊佼,武國慶,等. 鎂鋁雙金屬氫氧化物及氧化物去除硫離子(S2-)性能及其機理研究[J].無機化學學報,2006,22(10):1771-1777.
[2] 孫媛媛,曾希柏,白玲玉. Mg/Al 雙金屬氧化物對As(V)吸附性能的研究[J]. 環境科學學報,2011,31(7):1377-1385.
[3] 杜寶中,王宏軍,鄭剛,等. 納米層狀雙金屬氫氧化物的制備及結構表征[J].無機鹽工業,2007,39(5):26-28.
[4] 鄭立波,葉瑛,季珊珊,等.Mg/Al 型雙金屬氧化物對六價鉻的去除作用[J].地球化學,2004,33(2):208-215.
[5] 朱茂旭,李艷蘋,張良,等. 水滑石及其焙燒產物對磷酸根的吸附[J].礦物學報,2005,25(1):27-32.
[6] 杜寶中,王宏軍,王汝敏,等. 溶劑性質對合成納米層狀雙金屬氫氧化物的影響研究[J]. 無機鹽工業,2009,41(7):12-14,25.
[7] 王軍鋒,杜寶中,王紅軍,等. 納米層狀雙金屬氫氧化物粉體制備工藝研究[J]. 西安理工大學學報,2006,22(2):219-221.
[8] 高偉,何杰,張曉梅. 層狀雙金屬氫氧化物及其應用[J].大學化學,2012,27(4):38-45.
[9] 王軍鋒,李子榮,康志強.室溫固相法合成納米層狀雙金屬氫氧化物[J]. 安徽科技學院學報,2007,21(5):33-36.
[10]李發炎,胡章文.聚乙烯醇/鎂鋁雙金屬氫氧化物復合材料的合成與性能研究[J]. 安徽化工,2013,39(2):22-24.
[11]謝建武,包永忠,黃志明. 聚苯乙烯/層狀雙金屬氫氧化物納米復合材料的制備與表征[J]. 高分子學報,2009(2):118-122.
[12]孫金陸,甄衛軍,李進.LDHs 材料的結構、性質及其應用研究進展[J].化工進展,2013,32(3):610-616.
[13]李發炎,胡章文,劉俊.共沉淀法制備鎂鋁雙金屬氫氧化物及表征[J].輕金屬,2013(6):15-17.
[14]胡小平,衡慧敏,盧濤,等. 鎂鋁層狀雙金屬氫氧化物的制備及表征[J].中國粉體技術,2012,18(3):31-35.
[15]趙寧,廖立兵.水滑石類化合物及其制備、應用的研究進展[J].材料導報,2011,25(專輯17):543-549.

