S1P通路在膽鹽所致HL-7702細胞毒性損傷中的作用*
梁君銘曾 寬鄒堂斌
S1P通路在膽鹽所致HL-7702細胞毒性損傷中的作用*
梁君銘①曾 寬②鄒堂斌③
目的:探討S1P通路在膽鹽所致HL-7702細胞毒性損傷中的作用。方法:應用甘氨鵝脫氧膽酸鹽(GCDC)處理HL-7702細胞建立膽鹽損傷肝細胞模型,應用CCK-8試劑盒-8檢測細胞存活率,ELISA方法檢測細胞培養上清液S1P的表達,Western blot法測定caspase-3蛋白的表達水平。結果:應用150 μmol/L GCDC處理HL-7702細胞24 h可引起毒性損傷,10 μmol/L VPC23019(S1PR1抑制劑)預處理30 min可對抗GCDC引起的損傷,使細胞存活率升高,凋亡細胞數目和cleaved caspase-3表達均減少。結論:GCDC可以引起HL-7702細胞毒性,S1P通路介導GCDC對HL-7702細胞的損傷作用。
甘氨鵝脫氧膽酸鹽; 凋亡; S1P; SphK1激酶; HL-7702細胞
膽汁淤積性黃疸病因復雜,能引起肝臟等損害,膽汁淤積膽酸鹽所致肝實質細胞毒性損傷是膽汁淤積性黃疸肝損害的重要機制[1-3]。其中甘氨鵝脫氧膽酸鹽(Glycochenodeoxcholate,GCDC)是引起肝細胞損傷的主要膽汁酸,在膽汁淤積性黃疸時濃度升高最為明顯[4]。新近研究表明,鞘磷脂在肝臟生理和病理中有重要作用,1-磷酸鞘氨醇(sphingosine-1-phosphate,S1P)是鞘磷脂的重要代謝產物,而鞘氨醇激酶(Sphingosine kinase,SphK)是調控鞘脂代謝平衡的關鍵酶,S1P信號通路可能參與肝癌、膽汁淤積所致肝實質細胞損傷,但是S1P信號通路與膽汁淤積膽酸鹽引起肝臟實質細胞損傷的機制尚不明確[1-3]。因此,本研究在HL-7702細胞建立膽酸鹽損傷細胞模型,探討S1P信號通路在GCDC損傷HL-7702細胞中的作用及其有關機制[2]。
1 資料與方法
1.1 一般資料 GCDC和VPC23019購自美國Sigma-Aldrich公司,CCK-試劑盒-8購自日本Dojindo公司,DMEM-F12培養基以及特級胎牛血清FBS購自美國Gibco BRL公司,Cleaved-caspase-3抗體購自美國Cell Signaling Technology公司,S1P ELISA測定試劑盒購自上海前塵生物科技有限公司,人HL-7702肝細胞株購自深圳市百恩維生物科技有限公司。
1.2 方法
1.2.1 CCK-8法測定HL-7702細胞存活率 當HL-7702細胞生長融合度至70%~80%時,給予含GCDC或VPC23019的培養基干預24 h或30 min后,根據CCK-8試劑盒說明書檢測細胞存活率。每孔加入10%無血清培養基稀釋的CCK-8工作液100 μL,37 ℃細胞培養箱孵育3 h,用Multiskan MK3酶標儀測定450 nm波長處的吸光度。取4孔光密度OD平均值,按照說明書公式計算細胞存活率,重復實驗3次后收集數據行統計分析。
1.2.2 Western blot法檢測caspase-3蛋白的表達 接種于60 mm培養皿的HL-7702細胞5×106,給予含GCDC或VPC23019的培養基干預24 h或30 min后,用冷PBS洗兩次,加入適量細胞裂解液,4 ℃靜置30 min,使用細胞刮子刮下細胞,置入2 mL離心管中,12 000 rpm離心10 min,取上清約2 μL采用BCA法進行蛋白定量,剩余上清液保存于低溫冰箱以備電泳。總蛋白經聚丙烯酰胺凝膠電泳分離后,蛋白轉移到PVDF膜上。5%脫脂奶粉封閉60 min,然后在兔抗人caspase-3抗體(美國Bioworld Technology公司)孵育液中4 ℃過夜,接著與相應的二抗室溫孵育90 min。用ECL發光液顯色后,暗室曝光到X線片,掃描后用ImageJ 1.410軟件進行半定量分析。
1.2.3 雙抗體夾心ELISA方法檢測上清液S1P的表達 接種于96孔板的HL-7702細胞,給予含GCDC或VPC23019的培養基干預24 h或30 min后,取100 μL細胞培養上清液,加到S1P抗體預先包被的酶標板中,37 ℃培養箱孵育90 min,然后吸去上清液,接著加入S1P抗體繼續37 ℃培養箱孵育60 min,TBS漂洗3次后,加入生物素標記的二抗37 ℃培養箱孵育30 min,加入TMB顯色,終止液終止反應后,用Multiskan MK3酶標儀(入=450 nm)記錄吸光度。取3孔吸光度的平均數,按公式計算上清液S1P的表達。
1.3 統計學處理 使用SPSS 13.0軟件進行統計分析,實驗數據(mean±SE)表示,組間差異采用單因素方差分析,兩兩比較按照最小顯著性差異進行,以P<0.05為差異有統計學意義。
2 結果
2.1 S1P通路介導GCDC引起的HL-7702細胞毒性 根據筆者前期的實驗研究,應用150 mol/L GCDC處理HL-7702細胞24 h建立膽酸鹽損傷肝細胞模型,CCK-8試劑盒測定細胞存活率。未經任何處理的對照組細胞存活率為100%,150 μmol/L GCDC組處理HL-7702細胞24 h可明顯地產生細胞毒性,使細胞存活率為(60.8±5.2 630)%明顯降低,兩組比較差異有統計學意義(P<0.01);1.25 μmol/L及2.5 μmol/L濃度的VPC23019(S1PR1抑制劑)未能抑制GCDC引起的HL-7702細胞毒性作用,細胞存活率分別為(61.6±4.0 373)%、(62.8±4.3 243)%,與GCDC組比較差異均無統計學意義(P>0.05);5~20 μmol/L濃度范圍內的VPC23019(S1PR1抑制劑)能抑制GCDC引起的HL-7702細胞毒性作用,其中10 μmol/L VPC23019+GCDC預處理30 min的抑制作用最顯著,表現為細胞存活率升高分別為(70.2±2.5 884)%、(80.4±2.7 018)%、(70±2.9 154)%,與GCDC組比較差異均有統計學意義(P<0.01),見圖1。單獨10 μmol/L VPC23019預處理對細胞存活率無明顯影響。
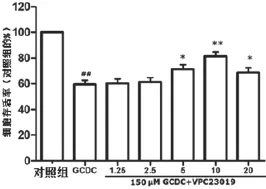
圖1 S1P通路介導GCDC引起的HL-7702細胞毒性*P<0.05,**P<0.01,與GCDC組比較;##P<0.01,與對照組比較
2.2 S1P通路介導GCDC引起的HL-7702細胞凋亡 免疫印跡法測定cleaved caspase-3表達(是反映細胞凋亡的一個指標),未經任何處理的對照組cleaved caspase-3/β-actin比值為(0.5±0.0 894),150 μmol/L GCDC處理組HL-7702細胞24 h比值為(1.2±0.1 788)可明顯地誘導細胞凋亡,與對照組比較差異有統計學意義(P<0.05)。但是,在GCDC作用HL-7702細胞前,10 μmol/L VPC23019預處理30 min能抑制GCDC對cleaved caspase-3表達的上調作用其比值為(0.8±0.0 894),可抑制GCDC的促凋亡作用,與GCDC組比較,差異有統計學意義(P<0.01)。10 μmol/L VPC23019單獨處理HL-7702細胞24 h對細胞凋亡無明顯的影響,其比值為(0.53±0.0 806),與對照組比較差異無統計學意義(P>0.05),見圖2。
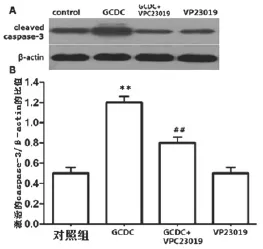
圖2 S1P通路介導GCDC所致HL-7702細胞凋亡**與對照組比較,P<0.01,##與GCDC組比較,P<0.01
2.3 SphK1抑制劑阻抑GCDC對HL-7702細胞S1P表達的上調作用 ELISA測定培養上清液中S1P的含量,未經任何處理的對照組培養上清液S1P濃度為(119.6±9.3 950)pmol/mL,150 μmol/L GCDC組處理HL-7702細胞24 h可使S1P表達明顯增多為(160.3±8.9 442)pmol/mL,兩組比較差異有統計學意義(P<0.01);但是,在GCDC作用HL-7702細胞前,應用10 μmol/L VPC23019預處理30 min可明顯地拮抗GCDC對S1P表達的上調作用,上清液S1P濃度為(140.8±7.0 894)S1P,與GCDC組比較差異有統計學意義(P<0.01),提示SphK1通路參與了GCDC對S1P表達的上調作用。單獨10 μmol/L VPC23019預處理對培養上清液S1P濃度無影響為(121.53±9.0 774)pmol/mL,見圖3。
3 討論
磷脂是細胞膜的重要組分,主要包含有兩大類磷脂,即由甘油構成的甘油磷脂(phosphoglyceride),由神經鞘氨醇構成的鞘磷脂(sphingolipid)。鞘磷脂(sphingomyelin)是含硝氨醇或二氫鞘氨醇的磷脂,其分子不含甘油,是一分子脂肪酸以酰胺鍵與鞘氨醇的氨基相連。人體含量最多的鞘磷脂是神經鞘磷脂,由鞘氨醇、脂肪酸及磷酸膽堿構成,常與卵磷脂存在于細胞膜外側。鞘磷脂的代謝產物為神經酰胺(ceramide,Cer)、鞘氨醇(sphingosine,Sph)和1-磷酸鞘氨醇(sphingosine-1-phosphate,S1P)等。1-磷酸鞘氨醇(S1P)是重要的磷脂代謝產物,參與細胞增殖、存活和遷移等廣泛的生物學效應。S1P在細胞內由鞘氨醇激酶(SphK)使鞘氨醇磷酸化而形成。S1P代謝的異常調節已經成為多種腫瘤發生發展的重要機制。靶向SphK-S1P信號通路的抑制劑、激動劑及抗體等已經成為眾多腫瘤的新治療策略。越來越多的證據表明,鞘磷脂參與調控細胞的生長、周期和凋亡等,鞘磷脂的重要活性代謝產物1-磷酸鞘氨醇(sphingosine 1-phosphate,S1P),鞘氨醇激酶(sphingosine kinase1,SphK1)是鞘氨醇生成S1P的關鍵限速酶,SphK1/ S1P信號通路在肝細胞存活或凋亡中有重要作用[4-6]。近來有研究表明,膽汁淤積性黃疸引起肝實質細胞損傷是急慢性肝病的病因之一,其中不同濃度的膽汁酸對肝實質細胞的損害程度相同,膽汁酸低濃度時誘導細胞凋亡,高濃度的膽汁酸則可導致細胞壞死[7-9]。細胞內鞘脂代謝平衡對于維持細胞增殖、分化和凋亡發揮重要作用,鞘脂代謝物包括神經酰胺、神經鞘氨醇、鞘氨醇-1-磷酸鹽等,可作為重要的信號分子,在肝細胞損傷和腫瘤的發生發展中有重要作用[10-17]。
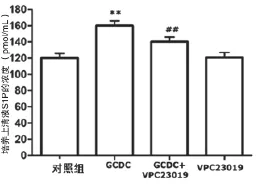
圖3 S1P通路介導GCDC所致HL-7702細胞S1P的生成**與對照組比較,P<0.01;##與GCDC組比較,P<0.01
本研究結果顯示,膽汁酸中的甘氨鵝脫氧膽酸鹽(GCDC)能引起人HL-7702細胞明顯的毒性損傷,其表現為GCDC劑量依賴性地導致細胞存活率下降,及細胞凋亡增加,其中150 μmol/L GCDC處理HL-7702細胞24 h細胞存活率下降顯著,這與先前研究結果相吻合[5-8]。引人注意的是,本研究也發現,在GCDC處理HL-7702細胞前,10 μmol/L VPC23019能抑制GCDC所致肝細胞毒性損傷和促凋亡作用,表現為細胞存活率升高,以及細胞凋亡減少。以上研究結果提示,S1P/S1PR1信號通路可能介導了膽汁酸(GCDC)對肝實質細胞(如HL-7702細胞)的毒性損傷,而膽汁酸(GCDC)對肝實質細胞的毒性損傷是否通過受體下游MAPK、STAT3等信號通路呢?這期待將來進一步深入研究探索。
綜上所述,本研究首次證實S1P/S1PR1通路可介導了膽汁酸(GCDC)對肝實質細胞(如HL-7702細胞)引起的細胞毒性及致凋亡作用,本文為臨床防治膽汁淤積性肝臟損傷提供了新的實驗依據。
[1]肖敏,李琛,袁漢堯,等.鞘氨醇激酶2與蛋白激酶D參與調控丁酸鈉誘導的人肝癌細胞凋亡[J].第三軍醫大學學報,2014,36(3):262-266.
[2]賽巖,代學強,白紀民,等.鞘氨醇激酶通過調控血管發生促進肝癌轉移[J].中國醫藥生物技術,2012,7(3):171-177.
[3]易軍,魯茁壯,段海峰,等.肝細胞生長因子通過鞘氨醇激酶途徑誘導內皮細胞遷移作用的研究[J].中國應用生理學雜志,2006,22(2):230-234.
[4]陳海英,高艷景,劉慧亞,等.鞘鞍醇激酶1對肝癌細胞凋亡特性的影響[J].中國現代普通外科進展,2011,14(1):6-8.
[5]陳海英,高艷景,劉慧亞,等.鞘氨醇激酶1對肝癌耐藥細胞生物學特性的影響[J].中華肝膽外科雜志,2011,17(12):1001-1004.
[6]陳念平,周軍,秦勇,等.甘氨鵝脫氧膽酸鹽對人正常肝細胞HL-7702的影響[J].廣東醫學,2010,31(14):1773-1775.
[7]姜大磊,高艷景,劉慧亞,等.SPK/S1P信號途徑對人肝癌細胞增殖、凋亡的作用[J].山東大學學報(醫學版),2009,47(11):76-79.
[8] 劉慧亞,高艷景,姜大磊,等.SPK1/S1P信號途徑對人肝癌耐藥細胞株BEL-FU凋亡、侵襲力及耐藥特性的影響[J].山東大學學報(醫學版),2010,48(6):67-71.
[9]姜大磊,高艷景,付金棟,等.SPK/S1P信號途徑對人肝癌細胞VEGF表達的作用[J].山東大學學報(醫學版),2007,45(3):250-252.
[10]孫旻,陳劍群.鞘氨醇激酶在惡性腫瘤中的研究進展[J].徐州醫學院學報,2010,30(6):412-414.
[11]呂冰潔,楊陽,張建初.鞘磷脂代謝物與肺癌關系的研究進展[J].華中科技大學學報(醫學版),2014,43(5):603-605.
[12]張麗志,溫克.1-磷酸鞘氨醇對惡性腫瘤生物學行為調控的研究進展[J].腫瘤,2012,32(11):936-939.
[13]鄧曉楊,朱曉鶯,徐蕾.鞘氨醇-1磷酸鹽對宮頸癌HeLa細胞生長及細胞侵襲的影響[J].廣西醫學,2014,36(12):1695-1698.
[14]雷燁,許曉倩,王健民.SphK-S1P-S1PR信號通路在腫瘤發病機制中的作用[J].國際腫瘤學雜志,2014,41(6):412-415.
[15]單海霞.鞘氨醇激酶在惡性腫瘤中作用的研究[J].徐州醫學院學報,2012,32(3):205-207.
[16]劉君,孫艷,鄧愛軍.1-磷酸鞘氨醇對人視網膜色素上皮細胞增殖的影響[J].中國醫學創新,2010,7(20):21-22.
[17]孫艷,劉君,鄧愛軍.1-磷酸鞘氨醇對體外培養的人視網膜色素上皮細胞α-SMA表達的影響[J].中國醫學創新,2010,7(20):6-7.
Role of S1P Pathway in Bile Salt-induced Injury in HL-7702 Cells
LIANG Jun-ming,ZENG Kuan,ZOU Tangbin.//Medical Innovation of China,2015,12(20):015-017
Objective: To explore the role of S1P pathway in the bile salt-induced injury in HL-7702 cells.Method:HL-7702 cells were treated with glycochenodeoxycholate (GCDC) to establish a bile salt-induced cellular injury model,cell viability was detected by CCK-8 kit. The expression of S1P in the cell culture supernatant was detected by ELISA,and the expression level of caspase-3 protein was determined by Western blot assay.Result:Exposure of HL-7702 cells to 150 μmol/L GCDC for 24 h markedly enhanced cell apoptosis.Pretreatment of HL-7702 cells with 10 μmol/L VPC23019(a S1PR1 inhibitor) for 30 min before exposure to GCDC inhibited the cytotoxicity induced by GCDC, it made cell viability increase,the number of apoptotic cells and expression of cleaved caspase-3 decrease. Conclusion:GCDC can induced cytotoxicity in HL-7702 cells,S1P pathway mediates the GCDC-induced injury in HL-7702 cells.
Glycochenodeoxcholate; Apoptosis; S1P; SphK1 kinase; HL-7702 cells
10.3969/j.issn.1674-4985.2015.20.005
2015-03-17) (本文編輯:周亞杰)
廣東省科技計劃項目(2013B031800016);東莞市科技計劃項目(2014108101053)
①廣東省佛山市順徳區第一人民醫院附屬杏壇醫院 廣東 佛山528325
②中山大學附屬孫逸仙紀念醫院
③廣東醫學院公共衛生學院
鄒堂斌
First-author’s address:The First People’s Hospital of Shunde Affiliated Xingtan Hospital,Foshan 528325,China

