明日葉查耳酮對Ⅱ型糖尿病大鼠脂代謝的影響
張建偉
(唐山師范學院體育系,河北 唐山 063000)
明日葉查耳酮對Ⅱ型糖尿病大鼠脂代謝的影響
張建偉
(唐山師范學院體育系,河北 唐山 063000)
目的:研究明日葉查耳酮和游泳運動對Ⅱ型糖尿病大鼠脂代謝的影響。方法:注射鏈脲佐菌素誘導成年雄性Sprague-Dawley(SD)大鼠糖尿病模型,觀察補充明日葉查耳酮、游泳運動、游泳運動結合補充明日葉查耳酮,以及陽性藥物二甲雙胍對糖尿病大鼠血清甘油三酯(triglyceride,TG)、總膽固醇(total cholesterol,TC)、低密度脂蛋白(low density lipoprotein,LDL)、高密度脂蛋白(high density lipoprotein,HDL)、游離脂肪酸(free fatty acid,FFA)水平的影響,以及對肝臟內脂素(visfatin)mRNA、甘油-3-磷酸酰基轉移酶-1(glycerol-3-phosphate acyltransferase-1,GPAT-1)mRNA、肉堿棕櫚酰轉移酶-1(carnitine palmitoyl transferase-1,CPT-1)mRNA相對表達量的影響。結果:與糖尿病組比較,各干預組大鼠的TG 、TC、LDL、FFA水平顯著下降,HDL水平顯著升高;各干預組大鼠肝臟visfatin mRNA、GPAT-1 mRNA相對表達量顯著下降;肝臟CPT-1 mRNA相對表達量則均顯著升高。結論:明日葉查耳酮有很好的改善糖尿病大鼠脂代謝的能力,并且與游泳運動產生協同效果。
明日葉查耳酮;運動;糖尿病;脂代謝
Ⅱ型糖尿病(type Ⅱ diabetes mellitus,T2DM)是以高血糖和胰島素抵抗(insulin resistance,IR)為主要特征的代謝性疾病[1]。而飲食的高糖高脂、日常運動過少等因素都是糖尿病形成的主要原因。傳統的西藥治療常常使患者的用藥量隨著用藥時間的延長而逐漸增加,投入的藥物種類也常由單一逐漸變為聯合,而藥量增加與同時服用多種降糖藥都不可避免地導致了對肝臟和腎臟的毒副作用,又會使患者對藥物產生依賴作用[2]。隨著病情的發展,許多病人又不斷出現多種并發癥。這些問題出現的原因在于糖尿病導致的體質變化未得到改善,提供了并發癥的生理基礎,這些發生于全身的病變正是西藥治療的薄弱環節[3]。
當今,運動和飲食調節對糖尿病的治療作用越來越受到人們的重視。運動可以促進體內糖脂代謝,從而加速葡萄糖分解。天然保健食品往往含有多種有益健康的成分,大多為藥食兼用的動、植物性食品,對人體的毒副作用小,也不會產生耐藥性,藥性溫和,并可以通過對機體的全方位調理達到滋陰清熱、補腎健脾、益氣養陰、活血化瘀的目的,降低血糖水平,改善糖尿病癥狀,延長糖尿病人壽命。
鑒于飲食和運動調節對糖尿病預防的重要意義,本研究探討補充明日葉查耳酮和游泳運動對改善T2DM大鼠肝臟脂代謝的可能影響。
1 材料與方法
1.1 動物、材料與試劑
8 周齡雄性Sprague-Dawley(SD)大鼠,體質量(180.0±18.8)g,購自北京維通利華實驗動物技術有限公司。
明日葉查耳酮、鏈脲佐菌素(streptozocin,STZ)美國Sigma公司。
鹽酸二甲雙胍緩釋片 哈爾濱同一堂藥業公司;血清甘油三酯(triglyceride,TG)測定試劑盒、總膽固醇(total cholesterol,TC)測定試劑盒、高密度脂蛋白(high density lipoprptein,HDL)測定試劑盒、低密度脂蛋白(low density lipoprotein,LDL)測定試劑盒、游離脂肪酸(free fatty acid,FFA)測定試劑盒 南京建成生物工程研究所;RNAstore樣品保存液、血清內脂素(visfatin)檢測試劑盒、實時熒光定量聚合酶鏈式反應(polymerase chain reaction,PCR)試劑盒SYBR FAST qPCR Kit 天根生化科技(北京)有限公司;Trizol試劑、逆轉錄試劑盒PrirneScriptⅡ 1st Strand cDNA Synthesis Kit 寶生物工程(大連)有限公司。
1.2 儀器與設備
S22PC分光光度計、DYY-Ⅲ31A/31B型電泳槽北京六一儀器廠;ABI 2720 PCR儀 美國Applied Biosystems PE公司;DNA Engine PCR儀、Quantityone凝膠分析軟件 美國Bio-Rad公司;VILBER LOURMAT熒光-化學發光成像系統 法國Vilber公司。
1.3 方法
1.3.1 T2DM大鼠模型制備、分組及運動訓練方案
將65 只雄性SD大鼠普通飼料喂養1周后,隨機分為正常對照組(NC組,8只)和造模組(57 只)。正常對照組繼續以普通飼料喂養,造模組以高糖高脂飼料喂養,高糖高脂飼料包括(以下均為質量分數)20%蔗糖、10%豬油、5%蛋黃粉、0.2%膽酸鈉、64.8%基礎飼料。給予造模組大鼠高糖高脂飼料5 周后,按照35 mg/kg(以體質量計,下同)腹腔注射STZ,并繼續維持高糖高脂飲食。正常對照組大鼠注射同等劑量的檸檬酸鈉緩沖液。注射3、7 d后,從各組大鼠尾靜脈取血測定隨機血糖濃度,血糖濃度均大于16.7 mmol/L為造模成功大鼠。本實驗中,造模成功率為89.1%。
選取造模成功的SD大鼠40 只,隨機分為5 組:糖尿病組(DM組)、二甲雙胍組(S組,50 mg/(kg·d))、明日葉查耳酮組(CA組,20 mg/(kg·d))、運動組(CE組)、明日葉查耳酮+運動組(CACE組,20 mg/(kg·d)),每組8 只,正常對照組大鼠灌胃等劑量的無菌水。各組灌胃給藥均于每天下午17:00左右進行,之后以普通飼料繼續喂養各組大鼠8 周并進行運動訓練。
運動訓練采取8 周不負重的游泳訓練。先進行為期1 周的適應性訓練(10 min/d),之后進行正式訓練,訓練時間為:第1周15 min/d、第2周30 min/d、第3~8周45 min/d,每周訓練6 d。游泳訓練在白色大水桶中完成,每桶4 只大鼠,水深60 cm,水溫(32±2)℃,每次游泳結束立即用干毛巾將大鼠體表水分輕柔擠壓吸干。
1.3.2 樣品制備
運動訓練8 周后,各組大鼠眼球取血,分離得血清備用。取血后脫頸處死大鼠,迅速取肝臟用錫紙包裹投入液氮冷凍,之后保存于-80 ℃冰箱備用。
1.3.3 指標測定
大鼠血清TG、TC、HDL、LDL、FFA含量均采用試劑盒測定,具體操作步驟按照說明書方法進行。
肝臟組織visfatin mRNA、甘油-3-磷酸酰基轉移酶-1(glycerol-3-phosphate acyltransferase-1,GPAT-1)mRNA及肉堿棕櫚酰轉移酶-1(carnitine palmitoyl transferase-1,CPT-1)mRNA相對含量的測定:Trizol法提取肝臟細胞總RNA,瓊脂糖凝膠電泳檢測總RNA濃度,再根據逆轉錄試劑盒說明書方法操作獲取cDNA,然后進行實時熒光定量PCR擴增。將β-actin作為內參基因,visfatin作為目的基因。對GPAT-1 mRNA及CPT-1 mRNA的定量檢測中,以18S rRNA作為內參基因。參考文獻[4-6],用Primer5軟件設計引物,進行實時熒光定量PCR。
visfatin mRNA相對含量的定量PCR反應體系(10 μL):2×SYBR Green Master Mix 1.5 μL、1 μmol/L正向引物0.2 μL、1 μmol/L反向引物0.2 μL、10 ng/μL cDNA模板1 μL,ddH2O 7.1 μL。PCR擴增程序:94 ℃變性3 min;95 ℃變性30 s,60 ℃復性20 s,72 ℃延伸30 s,40 個循環;72 ℃延伸8 min。
GPAT-1 mRNA及CPT-1 mRNA相對含量的定量PCR反應體系(10 μL):2×SYBR Green Master Mix 1.5 μL、1 μmol/L正向引物0.25 μL、1 μmol/L反向引物0.25 μL、10 ng/μL cDNA模板1.25 μL、ddH2O 6.25 μL。PCR擴增程序:94 ℃變性4 min;95 ℃變性30 s,62 ℃復性30 s,72 ℃延伸30 s,40 個循環;72 ℃延伸10 min。
1.4 數據分析
采用SPSS 13.0軟件,組間差異比較采用獨立樣本t檢驗。P<0.05表示差異有統計學意義。
2 結果與分析
2.1 大鼠脂代謝相關血液指標的變化
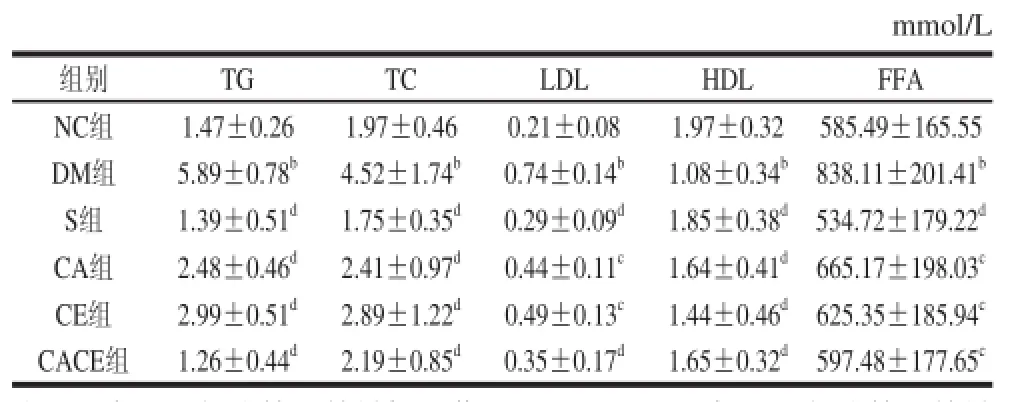
表1 大鼠脂代謝相關血液指標含量Table 1 Serum parameters of rats associated with lipid metabolism
由表1可知,與NC組比較,DM組大鼠血清TG、TC、LDL、FFA含量均極顯著升高(P<0.01),HDL含量極顯著降低(P<0.01)。實驗8 周后,與DM組比較,S組大鼠血清TG、TC、LDL、FFA含量均極顯著下降(P<0.01),HDL含量極顯著升高(P<0.01);CA組大鼠血清TG、TC含量極顯著下降(P<0.01),LDL、FFA含量顯著下降(P<0.05),HDL含量極顯著升高(P<0.01);CE組大鼠血清TG、TC含量均極顯著下降(P<0.01),LDL、FFA含量顯著下降(P<0.05),HDL含量極顯著升高(P<0.01);CACE組大鼠血清TG、TC、LDL含量均極顯著下降(P<0.01),FFA含量顯著下降(P<0.05),HDL含量極顯著升高(P<0.01)。
2.2 大鼠肝臟visfatinmRNA相對表達量
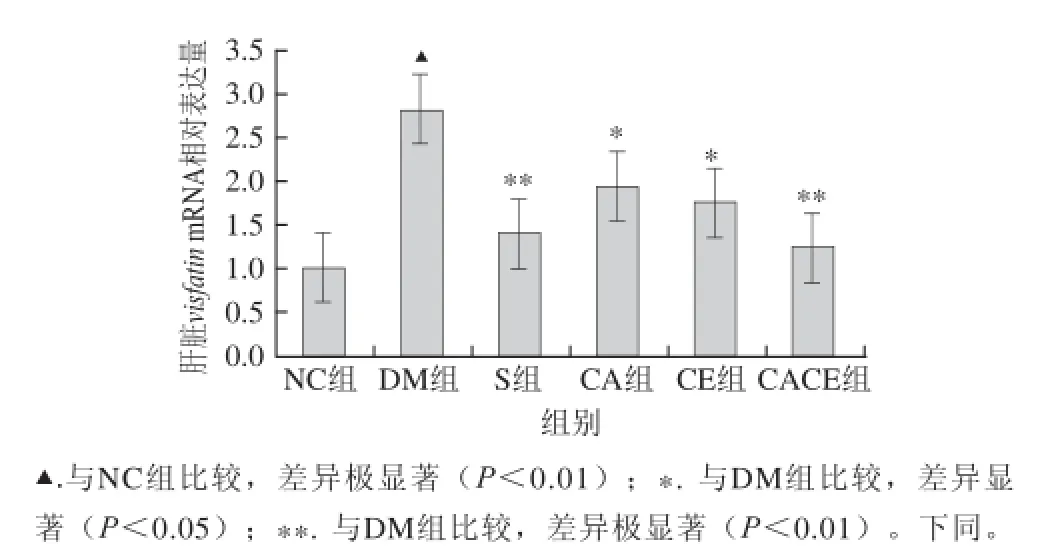
圖1 各組大鼠肝臟visfatinfatin mRNA相對表達量Fig.1 Relative expression of visfatin mRNA in rats
由圖1可知,與NC組相比,DM組大鼠肝臟visfatin mRNA相對表達量極顯著升高(P<0.01);與DM組相比,S組、CACE組大鼠肝臟visfatin mRNA相對表達量均極顯著下降(P<0.01),CA組及CE組顯著下降(P<0.05)。
2.3 大鼠肝臟GPAT-1 mRNA相對表達量
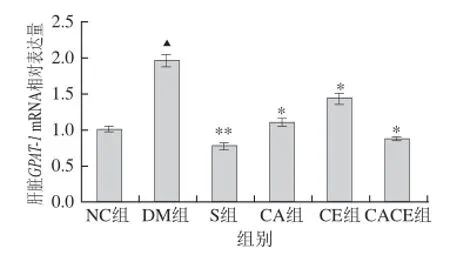
圖2 各組大鼠肝臟GPAT-1 mRNA相對表達量Fig.2 Relative expression of GPAT-1 mRNA in rats
由圖2可知,與NC組相比,DM組大鼠肝臟GPAT-1 mRNA相對表達量極顯著升高(P<0.01);與DM組相比,S組大鼠肝臟GPAT-1 mRNA相對表達量極顯著降低(P<0.01),而CA組、CE組及CACE組均顯著降低(P<0.05)。
2.4 大鼠肝臟CPT-1 mRNA相對表達量

圖3 各組大鼠肝臟CPT--11 mRNA相對表達量Fig.3 Relative expression of CPT-1 mRNA in rats
由圖3可知,與NC組相比,DM組大鼠肝臟CPT-1 mRNA相對表達量極顯著降低(P<0.01);與DM組相比,S組、CA組、CE組及CACE組大鼠肝臟CPT-1 mRNA相對表達量均極顯著升高(P<0.01)。
3 討論與結論
明日葉是傘形科多年生草本植物,具有多種功效,如增強人體免疫力、抗氧化、抗衰老、抗腫瘤、抗菌消炎、降低血糖和血脂水平等[7],其中降糖作用尤為顯著。明日葉中主要活性成分為查耳酮。查耳酮類化合物屬于黃酮類物質,是一種植物色素,含有1,3-二苯基丙烯酮結構。查耳酮類化合物具有多種生物學活性,如降血糖、降血脂、抗氧化等。目前,有很多關于明日葉查耳酮對糖尿病防治作用的研究,認為查耳酮有很強的胰島素樣活性,能夠增強胰島素功能、降低血糖濃度[8]。
糖尿病患者一般都存在血脂異常的狀況,甚至發生脂肪肝病變。這與糖尿病患者在糖代謝異常的同時一般都伴隨脂代謝異常相關[9]。血脂代謝異常是糖尿病及其并發癥的主要危險因素。糖尿病的脂代謝異常典型表現為FFA、TG、TC、LDL水平升高,HDL水平降低。研究表明,脂代謝紊亂特別是TG和FFA水平增高是糖尿病的誘發因素[10]。糖尿病的早期癥狀之一常表現為TG水平升高[11]。FFA主要為皮下和內臟脂肪脂解產生,分解產生的FFA在肝臟中作為底物合成TG。長期的高水平FFA易發生再脂化,并異位沉積于非脂肪器官,使周圍組織對胰島素敏感性降低,最終使胰島素分泌發生障礙[12]。因此,加速脂類分解,改善脂代謝狀況,既可以提高葡萄糖的利用率,又可以減少糖異生,從而降低血糖濃度,達到預防和治療糖尿病的目的。
運動對血脂代謝的改善作用已經得到了證實。尤其是中等強度的有氧運動,可以通過改善機體氧化應激來增加抗氧化酶的活力,從而增強機體抗氧化能力[13]。本實驗中,運動組大鼠血清TG、TC、LDL、FFA水平都明顯降低,而HDL水平明顯升高。本實驗結果也進一步證實了前人的研究,并且實驗結果顯示明日葉查耳酮對糖尿病大鼠血清的脂代謝相關指標也有顯著改善作用。本研究結果表明,運動與明日葉查耳酮表現出協同效應,兩者配合可能對血脂指標的改善作用更強。
Visfatin是Fukuhara等[14]在2005年發現的一種內臟脂肪細胞因子,在脂肪細胞分化和葡萄糖代謝中有特殊的重要作用。它具有類似胰島素樣的降血糖作用,并能促進前內臟脂肪細胞分化,促進內臟脂肪合成和聚集,可能參與肥胖等疾病的發生發展,是糖脂代謝重要影響因子[15-18]。本實驗中,糖尿病組大鼠肝臟visfatin mRNA水平比正常對照組極顯著升高,可能是因為糖尿病大鼠糖代謝異常,血糖水平的升高使機體產生相應的代償反應,各組織分泌更多visfatin,模擬胰島素降糖作用,以補充胰島素的相對不足,使作為調控機體糖代謝器官的肝臟中visfatin維持在較高水平。而各干預組與糖尿病組相比,肝臟visfatin mRNA水平都明顯下降,可能是各干預組都不同程度地降低了糖代謝異常的情況而使肝臟visfatin分泌減少,而且明日葉查耳酮與運動的共同作用要優于二者單獨使用的效果。
GPAT-1、CPT-1是脂肪酸β-氧化的關鍵酶[5,19]。GPAT-1可以將脂肪酸酯化為TG儲存起來[20]。CPT-1是脂肪酸氧化過程中的一種限速酶,催化脂肪酸轉運至線粒體基質進行β-氧化[21-22]。它位于線粒體外膜,通過過氧化物酶體增殖物激活受體、丙二酰輔酶A進行磷酸化、脫磷酸化依賴的細胞骨架成分在轉錄水平、翻譯及翻譯后水平接受調節,在能量代謝中起關鍵作用[23-24]。本研究中,糖尿病組大鼠肝臟的GPAT-1 mRNA水平比正常對照組極顯著升高,與血清TG水平的變化趨勢一致,說明糖尿病組大鼠脂肪酸酯化加強,致使轉化的TG含量增加。而明日葉查耳酮組大鼠肝臟的GPAT-1 mRNA水平比糖尿病組顯著降低,CPT-1 mRNA水平比糖尿病組顯著升高,表明明日葉查耳酮可能通過降低GPAT-1水平來減少TG的形成,同時提高GPAT-1水平而促進脂肪酸β-氧化,降低TG水平。本研究結果表明,明日葉查耳酮與運動對改善糖尿病大鼠脂代謝具有協同作用。
明日葉查耳酮能夠促進大鼠體內脂肪酸β-氧化,降低脂肪酸的酯化水平,加速脂類分解,改善脂代謝。雖然其作用弱于二甲雙胍,但是明日葉查耳酮可與運動產生整體的協同效果。
[1] 龔志剛, 朱篤, 張月華. 葛根素干預對糖尿病運動大鼠血清抗氧化能力的影響[J]. 食品科學, 2008, 29(9): 567-572.
[2] ACCILI D. 專家專題報告4: 2型糖尿病的新生物學進展[J]. 中華內分泌代謝雜志, 2014, 30(3): 269.
[3] 王昌儒. 溫腎健脾化痰法對代謝綜合征大鼠的作用機制研究[D]. 武漢: 湖北中醫藥大學, 2014: 12-14.
[4] 付鵬宇, 龔麗景, 趙林青, 等. 有氧運動和飲食干預對肥胖小鼠Visfatin水平的影響及其與氧化應激的關系[J]. 中國運動醫學雜志, 2014, 33(1): 52-58.
[5] EJAZ A, WU D, KWAN P, et al. Curcumin inhibits adipogenesis in 3T3-L1 adipocytes and angiogenesis and obesity in C57/BL mice[J]. The Journal of Nutrition, 2009, 139(5): 919-925.
[6] GAO Ye, ZHOU Yi, XU Aimin, et al. Effects of an AMP-activated protein kinase inhibitor, compound C, on adipogenic differentiation of 3T3-L1 cells[J]. Biological & Pharmaceutical Bulletin, 2008, 31(9): 1716-1722.
[7] 趙陽. 明日葉查爾酮對2型糖尿病大鼠葡萄糖轉運體表達的影響[D].青島: 青島大學, 2013: 35-36.
[8] AUGUSTIN R. The protein family of glucose transport facilitators: it’s not only about glucose after all[J]. IUBMB Life, 2010, 62(5): 315-333.
[9] 王慶平, 曹卿, 鐘進義, 等. 明日葉查爾酮對2型糖尿病大鼠胰島素受體表達的影響[J]. 中國食物與營養, 2013, 19(1): 69-72.
[10] EL-ABHAR H S, SCHAALAN M F. Topiramate-induced modulation of hepatic molecular mechanisms: an aspect for its anti-insulin resistant effect[J]. PLoS ONE, 2012, 7(5): e37757. doi: 10.1371/ journal.pone.0037757.
[11] DOWMAN J K, TOMLINSON J W, NEWSOME P N. Pathogenesis of non-alcoholic fatty liver disease[J]. QJM, 2010, 103(2): 71-83.
[12] GARY W. Possible effects of dietary polyphenols on sugarabsorption and digestion[J]. Molecular Nutrition & Food Research, 2013, 57: 48-57.
[13] 張裕中, 王銀暉, 陳曉光, 等. 游泳運動和白藜蘆醇對Ⅱ型糖尿病大鼠肝糖原及肝臟GLUT2的影響[J]. 中國運動醫學雜志, 2014, 33(2): 135-141.
[14] FUKUHARA A, MATSUDA M, NISHIZAWA M, et al. Visfatin: a protein secreted by visceral fat that mimics the effects of insulin[J]. Science, 2005, 307: 426-430.
[15] 陳寶. 有氧運動聯合膳食控制對2型糖尿病大鼠血清Visfatin水平的影響及相關因素的研究[D].揚州: 揚州大學, 2009: 44-45.
[16] KIM S, KANG S, MOON N R, et al. Central visfatin potentiates glucose-stimulated insulin secretion and β-cell mass withoutincreasing serum visfatin levels in diabetic rats[J]. Cytokine, 2014, 65(2): 159-166.
[17] de LUIS D A, SAGRADO M G, CONDE R, et al. Relation of visfatin to cardiovascular risk factors and adipocytokines i n patients with impaired fasting glucose[J]. Nutrition, 2013, 29(11/12): 1300-1303.
[18] 李婧波, 李艷波. Visfatin與自身免疫性甲狀腺疾病關系的研究[J].標記免疫分析與臨床, 2010, 17(6): 355-358.
[19] LI Tuoping, LI Suhong, DONG Yinping, et al. Antioxidant activity of penta-oligogalacturonide, isolated from haw pectin, suppresses triglyceride synthesis in mice fed with a high-fat diet[J]. Food Chemistry, 2014, 145(15): 335-341.
[20] PETRESCU A D, MCINTOSH A L, STOREY S M, et al. High glucose potentiates L-FABP mediated fibrate induction of PPARα in mouse hepatocytes[J]. Biochimica et Biophysica Acta (BBA)-Molecular and Cell Biology of Lipids, 2013, 1831(8): 1412-1425.
[21] YASUDA Y, HASHIMOTO R, OHI K, et al. A functional polymorphism of the GTP cyclohydrolase 1 gene predicts attention performance[J]. Neuroscience Letters, 2014, 566(30): 46-49.
[22] ZHANG Tianshun, SAWADA K, YAMAMOTO N, et al. 4-Hydroxyderricin and xanthoangelol from ashitaba (Angelica keiskei) suppress differentiation of preadiopocytes to adipocytes via AMPK and MAPK pathways[J]. Molecular Nutrition & Food Research, 2013, 57(10): 1729-1740.
[23] NEGI L M, JAGGI M, TALEGAONKAR S. Development of protocol for screening the formulation components and the assessment of common quality problems of nano-structured lipid carriers[J]. International Journal of Pharmaceutics, 2014, 64(1/2): 403-410.
[24] HSU W H, CHEN T H, LEE B H, et al. Monascin and ankafl avin act as natural AMPK activators with PPARα agonist activity to downregulate nonalcoholic steatohepatitis in high-fat diet-fed C57BL/6 mice[J]. Food Chemical Toxicology, 2014, 64: 94-103.
Effect of Ashitaba Chalcone on Lipid Metabolism of Rats with Type II Diabetes
ZHANG Jianwei
(Department of Physical Education, Tangshan Normal University, Tangshan 063000, China)
Objective: To study the effect of oral ashitaba chalcone and swimming exercise on lipid metabolism of rats with type II diabetes. Methods: Adult male streptozotocin-induced diabetic rats wer e subjected to swimming exercise and/or oral administration of ashitaba chalcone. Changes in the serum contents of triglyceride (TG), total cholesterol (TC), low density lipoprotein (LDL), high density lipoprotein (HDL) and free fatty acid (FFA), and the relative mRNA expression levels of visfatin, glycerol-3-phosphate acyltransferase-1 (GPAT-1) and carnitine palmitoyl transferase-1 (CPT-1) in liver tissue were measured. Results: Compared with the diabetic model group, the serum levels of TG, TC, LDL and FFA contents were signifi cantly lower in the intervention groups, while the serum level of HDL was signifi cantly increased. The mRNA expression levels of visfatin and GPAT-1 in liver were remarkably decreased in the treated diabetic groups; however, the relative mRNA expression of CPT-1 in liver mRNA was signifi cantly enhanced. Conclusion: Ashitaba chalcones improve lipid metabolism in diabetic rats showing a synergistic effect with exercise intervention.
ashitaba chalcones; exercise; diabete; lipid metabolism
TS201.4
A
1002-6630(2015)19-0250-05
10.7506/spkx1002-6630-201519045
2014-11-12
唐山市應用基礎研究計劃項目(14130254B);河北聯合大學培育基金項目(SP201309;GP201524)
張建偉(1978-),男,講師,碩士,主要從事運動訓練學與運動營養學研究。E-mail:353451852@qq.com

