膠原水解產物生物功能性的研究進展
段 煉,杜 崢,張德勝
(西南大學紡織服裝學院,重慶 400715)
膠原水解產物生物功能性的研究進展
段 煉,杜 崢,張德勝*
(西南大學紡織服裝學院,重慶 400715)
膠原是動物體內含量最豐富的蛋白質,其特有的三股螺旋結構以及氨基酸序列使得膠原及其水解產物具有生物相容性、生物功能性等諸多優點,可以廣泛地應用于生物醫學、組織工程、食品保健等領域。本文結合國內外最新研究成果,綜述了膠原水解產物的生物功能性,包括抗菌性能、抗氧化性和降血壓等。指出我國膠原相關產業的發展除了生產傳統的組織工程和醫藥材料之外,還應該根據其特性,拓展其應用范圍,開發出各種具有生物功能性的食品和保健品。
膠原水解產物;抗菌性;抗氧化性;降血壓
膠原是生物體內細胞間質的主要組成成分,廣泛存在于動物的皮、肌腱、軟骨、血管及各種結締組織中,起著支撐器官及保護機體的作用[1]。迄今為止,已經發現了28 種不同類型的膠原[2]。其中,約9 0%的膠原都是纖維膠原,例如主要分布在皮里的Ⅰ型、主要分布在軟骨和玻璃體里的Ⅱ型和主要分布在血管里的Ⅲ型膠原是屬于纖維膠原[3]。膠原分子是由3 條α多肽鏈組成的,在α多肽鏈中,甘氨酸(Gly)約占氨基酸殘基總量的25%~30%,脯氨酸(Pro)約占12%,羥脯氨酸(Hyp)約占10%。氨基酸殘基按照Gly-X-Y的順序呈周期性排列,其中,X與Y常分別為脯氨酸和羥脯氨酸,且3 條左手螺旋的α多肽鏈相互纏繞,形成一個右手三股螺旋結構[4]。
提取純化的未變性膠原由于保持了其在動物體內特有的三股螺旋結構,具有低免疫原性、活化血小板、可生物降解性、促進細胞生長等特點[5],使得膠原可以被制成止血海綿、手術縫合線、人工血管、人工皮膚、護膚品和藥物載體而廣泛應用于生物醫學、組織工程和化妝美容等領域[2]。膠原在高溫或酶等作用下可以水解成明膠或水解膠原;水解后膠原特有的三股螺旋結構被破壞了[6]。此外,膠原、明膠或水解膠原還可以進一步水解成多肽。新的研究表明[7-8],膠原水解產物具有抗菌性、抗氧化性以及降血壓等諸多生物功能性,以此為基礎可以開發各種食品、保健品和醫學藥品,促進我國膠原產業的發展。
1 抗菌性
作為細胞間質的主要成分,膠原會被一些細菌所侵蝕,例如綠膿桿菌可以侵蝕Ⅰ型膠原基質[7]。但是研究發現膠原也具有一定的抗菌性能,例如Jus等[8]將膠原涂覆在羊毛材料外發現其具有抵抗細菌和真菌侵蝕的功效。Abdillahi等[9]的研究表明某些特殊類型的膠原具有天然的滅菌性能:細胞間質中的Ⅵ型膠原在生理環境中可以殺滅革蘭氏陽性細菌和陰性細菌,為組織細胞提供了先天性的抗菌保護,其滅菌機理可能與細菌的細胞膜被破壞有關。
由膠原、水解膠原制成的一些多肽具有較強的抗菌性。Gomez-Guillen等[10]分別用魷魚膠原和金槍魚皮膠原制備了分子質量小于1 kD和分子質量在1~10 kD的多肽,并用瓊脂擴散法研究了其對常見細菌的抗菌性能,研究結果表明這兩種多肽對革蘭氏陰性和陽性細菌以及乳酸菌等均具有較好的抗菌性。Kempka等[11]發現將水解膠原和甘露醇溶解并涂覆在草莓表面后有較好的抗菌性能,能延長草莓的保鮮期;當膠原質量分數為7.5%、甘露醇質量分數為2.5%時草莓的保鮮期可達12 d。然而,迄今為止,這些多肽的抗菌機理尚未確定。di Bernardini 等[12]認為多肽抗菌性可能與其氨基酸組成、序列、分子質量以及細菌種類都有關系;Wieprecht等[13]的研究表明帶正電荷的抗菌多肽可以通過靜電吸附與帶負電荷的細菌細胞膜接近,多肽中的疏水性氨基酸則有助于其進入到細菌細胞膜中。Gomez-Guillen等[10]則認為當膠原或水解膠原降解成多肽之后,其分子質量降低,暴露在外的氨基酸殘基和電荷增多了,促進了其與細菌細胞膜的相互作用,從而賦予了多肽抗菌性能。此外,膠原制備的氨基酸還可以用來合成抗菌化合物:例如Molinero等[14]將膠原水解制得的氨基酸與月桂酰精氨酸合成了具有表面活性效果的二肽,這種二肽由于帶有陽電荷,其對革蘭氏陰性和陽性細菌都有很強的抗菌性。
2 抗氧化性
人與外界環境的接觸以及人的各種生理活動會使人體內積累大量的自由基。這些自由基如果不能及時清除會加速機體的衰老,引發癌癥及其他疾病。一些研究表明膠原具有清除自由基、抗氧化的功效。李春楠等[15]研究了象皮、豬皮和魚鱗膠原的抗氧化功效,結果表明魚鱗膠原、象皮膠原和豬皮膠原清除自由基的IC50值分別為0.51、0.42、0.60 g/L,具有一定的抗氧化功效;膠原質量濃度越高,其自由基清除效果越好。Jeevithan等[16]研究了Ⅱ型酸溶銀鯊軟骨膠原、Ⅱ型酶溶銀鯊軟骨膠原和Ⅱ型銀鯊明膠的抗氧化功效,結果表明它們對1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基的清除率在16%~24%,且Ⅱ型酶溶銀鯊軟骨膠原的抗氧化性最好。
此外,很多蛋白質水解產物、多肽和氨基酸都能與活性氧反應并清除自由基,因此它們都具有抗氧化性的功效[17]。其中多肽比氨基酸具有更強的自由基清除能力,因此其抗氧化性比氨基酸更強[18]。相關研究表明膠原的水解產物也具有抗氧化的功效。Ding Jinfeng等[19]從水母中提取制備了水解膠原并研究了其抗氧化和抗疲勞的功效,結果表明小鼠服用這種水解膠原后能表現出更好的運動能力,其血液中的乳酸和尿素氮含量降低了20%~30%,肝糖原和肌糖原含量增加了30%~50%。Mendis[20]及Kim[21]等的研究表明魷魚、魚皮和牛皮制成的明膠均具有抗氧化性的功效。楊芳寧[22]將豬皮膠原降解并制成了多肽,發現其具有較高的抗脂質氧化能力、較強的清除自由基能力和金屬螯合能力,且抗氧化活性隨著底物濃度的增加而增加。Kim等[23-25]的研究表明明膠制備的多肽抗氧化性要好于其他蛋白源制備的多肽,而且由膠原或明膠制備的多肽可以保護細胞免受自由基的氧化損害。Mendis等[20]的研究表明由魷魚皮明膠制備的多肽可以強化人類肺部成纖細胞的細胞存活能力,使其免受叔丁基氫過氧化物誘導的細胞毒性的損害。此外,他們還發現從鱈魚皮明膠中提取的多肽可以強化谷胱甘肽過氧化物酶、過氧化氫酶和超氧化物歧化酶等抗氧化酶在人肝癌細胞中的活性[26]。
目前膠原及其水解產物抗氧化功效的生物活性機理還有待系統的研究。很多研究表明多肽的抗氧化性能與其氨基酸序列、疏水性和分子質量有關。
2.1 氨基酸序列
明膠和膠原的水解產物的氨基酸組成與膠原類似,富含Gly、Ala、Pro、Hyp、Glu和Asp,但是Met、Cys、His和Tyr含量很少[20,27]。根據Dávalos等[28]的研究,單個氨基酸中抗氧化活性最強的是Trp、Tyr和Met,然后是Cys、His和Phe,其余的氨基酸沒有任何的抗氧化活性。然而,很多多肽雖然并不含有上述具有抗氧化活性功能的氨基酸,卻依然具有抗氧化功能。例如Kim等[24]從鱈魚皮中提取了兩種具有抗氧化功效的多肽,它們分別由13 個和16 個氨基酸組成,含有Gly-Pro-Hyp的氨基酸序列,且在碳端含有甘氨酸。Li Bo等[29]發現由豬皮膠原水解物制備的多肽中,具有Gln-Gly-Ala-Arg氨基酸序列的抗氧化活性最強。此外,Mendis等[20]的研究表明氨基酸序列為Asn-Gly-Pro-Leu-Gln-Ala-Gly-Gln-Pro-Gly-Glu-Arg的多肽具有抑制自由基的功能。
2.2 疏水性
有的學者則認為由膠原制備的多肽具有抗氧化功能的原因可能與其含有較多的疏水性氨基酸有關,這些疏水性氨基酸可以增加多肽在脂類物質中的溶解度而強化其抗氧化功效[20,24]。Rajapakse等[30]認為由皮膠原制備的多肽比肉類蛋白制得的多肽具有更好的抗氧化性是因為其含有更多的疏水性的Gly和Pro。
2.3 分子質量
Gomez-Guillen等[10]發現從魷魚皮水解物制備的多肽都具有抗氧化性,但其抗氧化能力和多肽分子質量有很大的關系:分子質量越低的多肽其抗氧化性越強。Yang[31]和Yang Hongshun[32]等的研究則表明在魚皮明膠的水解產物中,分子質量低于700 D的多肽的自由基清除能力要比其他的強20%左右。Li Zongrui等[33]研究了分子質量與水解膠原抗氧化功效的關系,結果表明,在研究的39 種海洋魚類水解膠原中(分子質量大于0.64 kD,小于257 kD),其分子質量越小,水解膠原清除自由基的功效越強。類似地,Chi Changfeng等[34]在研究魚膠原水解產物抗氧化功效時也發現分子質量越小的水解產物抗氧化性越強。水解制備多肽時所用蛋白酶的種類也決定著水解產物的大小和氨基酸序列,因此也會影響多肽的抗氧化功能。有研究表明,由堿性蛋白酶水解明膠(或膠原)制備的多肽的抗氧化功能要比用膠原酶、胃蛋白酶、胰蛋白酶、木瓜蛋白酶或中性蛋白酶等水解明膠制備的多肽要好[27,35]。
3 降低血壓
高血壓會損傷血管,使身體的重要器官發生缺血和功能受損,甚至危及生命。因此,高血壓的防治對于保護人們生命安全具有十分重要的意義。血管緊張素轉化酶(angiotensin converting enzyme,ACE)會使無活性的血管緊張素Ⅰ轉變為使血管收縮的血管緊張素Ⅱ,引發高血壓。因此,抑制ACE的活性可以有效地治療高血壓[36-37]。相關研究表明攝入一些功能性的多肽后,可以抑制ACE的活性,進而減少血管緊張素Ⅱ的產生,達到降低血壓的功效[37]。在從蛇毒中提取了具有抑制ACE活性的多肽后,人們嘗試人工合成具有這種功能的多肽。但人工合成的這種多肽會引發咳嗽、味覺失調、皮疹等副作用[38]。因此,人們試圖從蛋白質等天然產物中提取具有抑制ACE活性功能且副作用較小的多肽。具有抑制血管緊張素轉化酶活性功能多肽可以從牛奶、血蛋白、玉米、鷹嘴豆、大豆以及牛、雞、豬、魚的肌肉蛋白中提取[39-40]。
有研究表明膠原和明膠經酶解后也能制備具有降血壓功效的多肽[41-43],例如從脊椎動物的皮、骨、鱗片以及軟體動物的魷魚鞘、海參中提取的膠原都可以制備具有抑制ACE活性功能的多肽和水解產物。此類多肽的降血壓功能一般是在大鼠體內進行測試的[44]。許多由膠原制備的抑制ACE活性多肽已經進行了動物實驗并獲得了不錯的實驗效果。例如大鼠分別口服雞腿骨膠原水解物和Gly-Ala-Hyp-Gly-Leu-Hyp-Gly-Pro八肽都可以明顯地降低其血壓[43,45]。Faria等[46]發現大鼠口服豬皮和牛皮膠原水解物后,其血壓也明顯降低了。由豬皮膠原水解制備的兩種多肽(Gly-Pro和Gly-Phe-Hyp-Gly-Pro)也可以降低大鼠的血壓[41]。
多肽的ACE抑制功能與其結構之間的關系尚不清楚,但具有這種功效的多肽都有相似的特點:由于ACE的活性位點不能容納大分子的多肽[47],因此這些多肽肽段較短,分子質量較小。Murray等[48]發現在碳端含有疏水氨基酸的多肽更容易抑制ACE的活性。此外,碳端含有Arg或者Lys也會強烈抑制ACE的活性。膠原和明膠水解物具有抑制ACE的功能則可能是因為其含有大量的疏水氨基酸,例如Pro。Pro可能是抑制ACE活性效果最好的氨基酸,很多具有ACE抑制功能的氨基酸中都含有Pro[49-50]。表1列出了一些由膠原及其水解產物制備的具有抑制ACE活性功效的多肽的結構及ACE活性被抑制一半時所需多肽的濃度(IC50)。
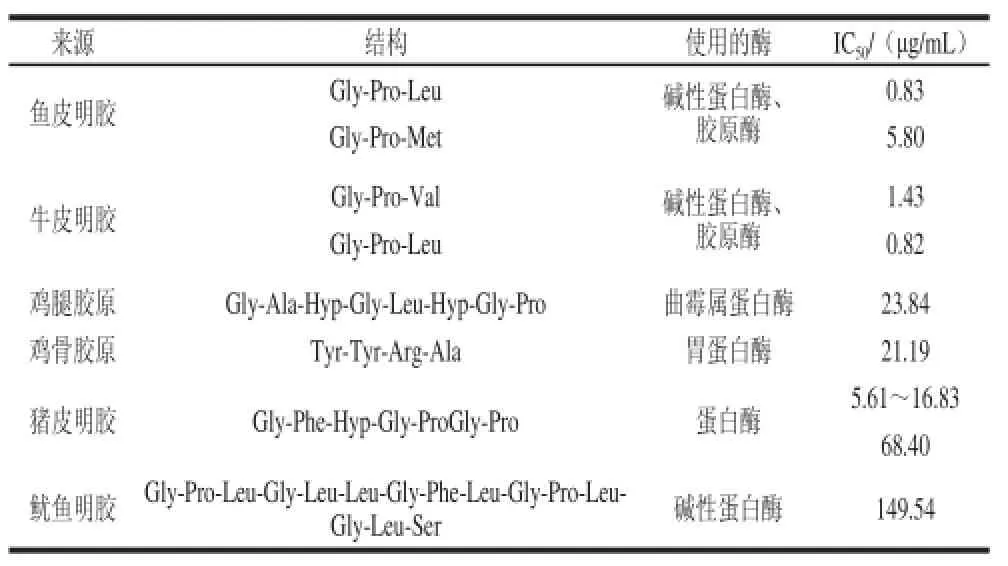
表1 由膠原及其水解產物制備的具有抑制ACE活性功效的多肽結構[51]Table 1 ACE inhibitory peptides derived from collagenous sources[51]
Zhang Yuhao等[52]用酶處理牛皮膠原并制備了具有抑制ACE活性功能的多肽,結果表明使用堿性蛋白酶和膠原酶水解膠原,不需預處理就能制備具有抑制ACE功能的多肽;在酶水解前如果高溫高壓預處理5 min則可以得到分子質量更小且ACE抑制能力更強的多肽。Kong Qing等[53]則研究了由膠原生產具有降血壓功效多肽的生產工藝,比對其進行了優化。結果表明,pH 2、質量濃度為8.23 g/100 mL的膠原溶液在37 ℃條件下用酶酶解3.82 h所得到的產物降血壓功效最好;同時使用胃蛋白酶和胰蛋白酶水解的產物抑制ACE活性能力最好(88.25%),其IC50值也最低(141.64 μg/mL)。Zhuang Yongliang等[54]從水母膠原中制備了具有降血壓功效的多肽并優化了其制備條件,結果表明,在52.7 ℃、pH 8.63、酶用量為3.46%時,具有降血壓功效的多肽產量最高,達到81.7%。
4 結 語
我國的畜牧業和漁業都非常發達,每年的豬、牛、羊以及魚類的產量都位居世界前列,有著非常豐富的膠原原料。但是和發達國家相比,我國的膠原產業才剛起步,存在著知識普及不足、生產方式較落后、產品附加值較低等缺陷。我們在研究開發膠原相關產品時,除了生產常用的人工皮膚、支架材料等生物醫學和組織工程材料之外,還可以結合膠原及其水解產物的抗菌性、抗氧化性及降血壓等功效生產各種具有生物功效的食品、保健品及醫藥用品。例如在生產膠原腸衣時可以添加具有抗菌功效的膠原水解產物,使腸衣在保鮮的同時又能抗菌,食用時更加衛生安全;在生產保健口服液時,可以適當地添加具有抗氧化功效的膠原水解產物,提升產品的保健功效。這樣在滿足人們不同需要的同時,引入各種前沿的科研成果,提高產品的附加值,促進了膠原相關產業的發展,同時能帶來更好的經濟效益和社會效益。
[1] 湯克勇. 膠原物理與化學[M]. 北京: 科學出版社, 2012: 3-4.
[2] 李國英. 膠原化學[M]. 北京: 中國輕工業出版社, 2013: 6.
[3] 蔣挺大. 膠原與膠原蛋白[M]. 北京: 化學工業出版社, 2006: 13-14.
[4] RAMACHANDRAN G N, KARTHA G. Structure of collagen[J]. Nature, 1954, 174: 269-270.
[5] 李國英. 膠原的生物學性質[J]. 中國皮革, 2002(21): 20-21.
[6] 李國英, 張忠楷, 雷蘇, 等. 膠原、明膠和水解膠原蛋白的性能差異[J].四川大學學報: 工程科學版, 20 05, 37(4): 54-58.
[7] PLOTKOWSKI M C, CHEVILLARD M, PI ERROT D, et al. Differential adhesion of Pseudomon as aeruginosa to human respiratory epithelial cells in prima ry culture[J]. Journal of Clinical Investigation, 1991, 87: 2018-2028.
[8] JUS S, KOKOL V, GUEBITZ G M. Tyrosinase-catalysed coating of w ool fibres with different protein-based biomaterials[J]. Journal of Biomaterials Science, 200 9, 20(2): 253-269.
[9] ABDILLAHI S M, BALVANOVI? S, BAUMGARTEN M, et al. Collagen VI encodes antimicrobial activity: novel innate host defense properties of the extracellular matrix[J]. Journal of Innate Immunity, 2011, 4(4): 371-376.
[10] GOMEZ-GUILLEN M C, LOPEZ-CABALLERO M E, LOPEZ de LACEY A, et al. Sea by-products as real material: new ways of application[M]. Kerala, India: Transworld Res earch Network Signpost, 2010: 89-115.
[11] KEMPKA A P, SANTIN L, BETIOLO C, et al. Develpment of coating using partially hydrolyzed collagen, mannital and applied on strawberry[J]. Boletim do Centro de Pesquisa de Proc essamento de Alimentos, 2012, 30: 53-64.
[12] di BERNARDINI R, HARNEDY P, BOLTON D, et al. Antioxidant and antimicrobial peptidic hydrolysates from muscle protein sources and by-products[J]. Food Ch emistry, 2011, 124(4): 1296-1307.
[13] WIEPRECHT T, DATHE M, EPAND R M, et al. Influence of the angle subtended by the positively charged helix face on the membrane activity of amphipathic, antibacterial peptides[J]. Bioc hemistry, 1997, 36: 12869-12880.
[14] MOLINERO J, JULIA M R, ERRA P, et al. Synthesis and properties on Nα-lauroyl-L-arginine dipeptides from collagen-lauroyl-L-arginine dipeptides from collag en[J]. Journal of the American Oil Chemists’Society, 1988, 65(6): 975-978.
[15] 李春楠, 孫佳明, 張輝. 象皮和擬替代品豬皮、魚鱗中膠原及其抗氧化活性研究[J]. 中國中藥雜志, 2011, 36(16): 2183-2186.
[16] JEEVITHAN E, BAO Bin, BU Yongshi, et al. Type II collagen and gelatin from Silvertip Shark (Carcharhinus albimarginatus) cartilage: isolation, purifi cation, physicochemical and antioxidant properties[J]. Marine Drugs, 2014, 12(7): 3852-3873.
[17] STADTMAN E R, LEVINE R L. Free radical-mediated o xidation of free amino acids and amino acid residues in proteins[J]. Amino Acids, 2003, 25(3/4): 207-2 18.
[18] ELIAS J R, KELLERBY S, DECKER A E. Antioxidant activity of proteins and peptides[J]. Critical Reviews in Food Science and Nutrition, 2008, 48: 430-441.
[19] DING Jinfeng, LI Yanyan, XU Jiajie, et al. Study on effect of jellyfi sh collagen h ydrolysate on anti-fatigue and anti-oxidation[J]. Food Hydrocolloids, 2011, 25: 1350-1353.
[20] MENDIS E, RAJAPAKSE N, BYUN H, et al. Investigation of jumbo squ id (Dosidicus gigas) skin gelatin peptides for their in vitro antioxidant effects[J]. Life Sciences, 2005, 77: 2166-2178.
[21] KIM S K, MENDIS E. Bioactive c ompounds from marine processing byproducts: a review[J]. Food Research International, 2006, 39: 383-393.
[22] 楊芳寧. 豬皮膠原蛋白抗氧化肽的制備與活性研究[D]. 鄭州: 河南科技大學, 2012.
[23] KIM S K, BYUN H G, PARK P J, et al. Angiotensin I converting enzyme inhibitory peptides purified from bovine skin gelatin hydrolysate[J]. Journal of Agricultural and Food Chemistry, 2001, 49: 2992-2997.
[24] K IM S K, BYUN H G, NAM K, et al. Isolation and characterization of antioxidative peptides from gelatin hydrolysate of Alaska pollack skin[J]. Journal of Agricultural and Food Chemistry, 2001, 49: 1984-1989.
[25] KIM S K, KIM Y T, BYUN H G, et al. Purification and characterization of antioxidative peptides from bovine skin[J]. Journal of Biochemistry and Molecular Biology, 2001, 34: 214-219.
[26] MENDIS E, RAJAPA KSE N, KIM S K. Antioxidant properties of a radicals scavenging peptide purified from enzymatically prepared fish skin gelatin hydrolysate[J]. Journal of Agricultural and Food Chemistry, 2005, 53: 581-587.
[27] A LEMAN A, GIMENEZ B, PEREZ-SANTIN E, et al. Contribution of Leu and Hyp residues to antioxidant and ACE-inhibitory activities of peptides sequences isolated from squid gelatin hydrolysate[J]. Food Chemistry, 2011, 125: 334-341.
[28] DáVALOS A, MIGUEL M, BARTOLOME B, et al. Antioxidant activity of peptides derived from egg white proteins by enzymatic hydrolysis[J]. Journal of Food Protection, 2004, 67: 1939-1944.
[29] LI Bo, CHEN Feng, WANG Xi, et al. Isolation and identification of antioxidative peptides from porcine collagen hydrolysate by consecutive chromatography and electrospray ionization-mass spectrometry[J]. Food Chemistry, 2007, 1 02: 1135-1143.
[30] RAJAPAKSE N, MENDIS E, BYUN H G, et al. Purification and in vitro antioxidative effects of giant squid muscle peptides on free radical-mediated oxidative systems[J]. Jo urnal of Nutritional Biochemistry, 2005, 16: 562-569.
[31] YANG J I, HO H Y, CHU Y J, et al. Characteristic and antioxidant activity of retorted gelatin hydrolysates from cobia (Rachycentron canadum) skin[J]. Food Chemistry, 2008, 110: 128-136.
[32] YANG Hongshun, WANG Yifen, ZHOU Peng, et al. Effects of alkaline and acid pretreatment on the physical properties and nanostructures of the gelatin from channel catfish skins[J]. Food Hydrocolloids, 2008, 22: 1541-1550.
[3 3] LI Zongrui, WANG Bin, CHI Changfeng, et al. Infl uence of average molecular weight on antioxidant and functional properties of cartilage collagen hydrolysates from Sphyrna lewini, Dasyatis akjei and Raja porosa[J]. Food Research International, 2013, 51: 283-293.
[34] CHI Changfeng, CAO Zihao, WANG Bin, et al. Antioxidant and functional properties of collagen hydrolysates from Spanish mackerel skin as infl uenced by average molecular weight[J]. Molecules, 2014, 19(8): 11211-11230.
[35] QIAN Z J, JUNG W K, KIM S K. Free radical scavenging activity of a novel antioxidative peptide purifi ed from hydrolysate of bullfrog skin, Rana catesbeiana Shaw[J]. Bioresource Technology, 2008, 99: 1690-1698.
[36] ONDETTI M A, CUSHMAN D W. Design of specific inhibitors of angio tensin-converting enzyme-new class of orally active antihypertensive agents[J]. Science, 1977, 196: 441-444.
[37] CHEN Qihe, XUAN Guodo ng, FU Mingliang, et al. Effect of angiotensin I-converting enzyme inhibitory peptide from rice dregs protein on antihypertensive activity in spontaneously hypertensive rats[J]. Asian Pacifi c Journal of Clinical Nu trition, 2009, 16: 281-285.
[38] ATKINSON A B, ROBERTSON J I S. Captopril in the treatment of clinical hypertension and cardiac failure[J]. Lancet, 1979, 2: 836-839.
[39] AHHMED A M, MUGURUMA M. A review of meat protein hydrolysates and hypertension[J]. Meat Science, 2010, 86: 110-118.
[40] JANG A, LEE M. Purification and identification of angiotensin converting enzyme inhibitory peptides from beef hydrolysates[J]. Meat Science, 2005, 69: 653-661.
[41] ICHIMURA T, YAMANAKA A, OTSUKA A, et al. Antihypertensive effect of enzymatic hydrolysate of collagen and Gly-Pro in spontaneousl y hypertensive rats[J]. Bioscience, Biotechnology and Biochemistry, 2009, 73: 2317-2319.
[42] PARK C H, KIM H J, KANG K T, et al. Fractionation and angiotensin I-converting enzyme (ACE) inhibitory activity of gelatin hydrolysates from by-products of Alaska pollock surimi[J]. Fisheries and Aquatic Science, 2009, 12: 79-85.
[43] CHENG Fuyuan, WAN Tienchun, LIU Yutse, et al. Determination of angiotensin-I converting enzyme inhibitory peptides in chicken leg bone protein hydrolysate with alcalase[J]. Animal Science Journal, 2009, 80(1): 91-97.
[44] FITZGERALD R, MURRAY B A. Hypotensive peptides from milk proteins[J]. Journal of Nutrition, 2004, 134: 980-988.
[45] SAIGA A, IWAI K, HAYAKAWA T, et al. Angiotensin I-converting enzyme-inhibito ry peptides obtained from chicken collagen hydrolysate[J]. Journal of Agricultural and Food Chemistry, 2008, 56: 9586-9591.
[46] FARIA M, da COSTA E L, GONTIJO J A R, et al. Evaluation of the hypotensive potential of bovin e and porcine collagen hydrolysates[J]. Journal of Medicinal Food, 2008, 11: 560-567.
[47] ONDETTI M A, CUSHMAN D W. Enzymes of the renin-angiotensin system and their inhibitors[J]. Annual Review of Biochemistry, 1982, 51: 283-308.
[48] MURRAY B A, FITZGERALD R. Angiotensin converting enzyme inhibitory peptides derived f rom food proteins: biochemistry, bioactivity and production[J]. Current Pharmaceutical Design, 2007, 13: 773-791.
[49] CONTRETAS M, CARRON R, MONTERO M J, et al. Novel caseinderived pe ptides with antihypertensive activity[J]. International Dairy Journal, 2009, 19: 566-573.
[50] SHIMIZU K, SATO M, ZHANG Y, et al. The bioavailable octapeptide Gly-Ala-Hyp-Gly-Leu-Hyp-Gly-Pro stimulates nitric oxide synthesis in vascular endothelial cells[J]. Journal of Agricultural and Food Chemistry, 2010, 58: 6960-6965.
[51] GOMEZ-GUILLEN M C, GIM ENEZ B, LOPEZ-CABALLERO M E, et al. Functional and bioactive properties of collagen and gelatin from alternative sources: a review[J]. Food Hydrocolloids, 2011, 25: 1813-1827.
[52] ZHANG Yuhao, OLSEN K, GROSSI A, et al. Effect of pretreatment on enzymatic hydrolysis of bovine collagen and formation of ACE-inhibitory peptides[J]. Food Chemistry, 2013, 141: 2343-2354.
[53] KONG Qing, CHEN Fe ng, WANG Xi. Optimization of conditions for enzymatic production of ACE inhibitory peptides from collagen[J]. Food and Bioprocess Technology, 2011, 4(7): 1205-1211.
[54] ZHUANG Yongliang, SUN Liping, LI Bafang. Production of the angiotensin-I-converting enzyme (ACE)-inhibitory peptide from hydrolysates of jellyfish (Rhopilema esculentum) collagen[J]. Food and Bioprocess Technology, 2010, 5(5): 1-8.
Bioactive Functions of Collagen Hydrolysates
DUAN Lian, DU Zheng, ZHANG Desheng*(College of Textiles and Garments, Southwest University, Chongqing 400715, China)
As the most abundant protein in animals, collagen and its hydrolysates are biocompatible and biofunctional due to the unique triple-helix and amino acid sequence, and have been widely used in many fi elds. In this article, we have summarized the bioactive functions of collagen hydrolysates according to the latest investigations at home and abroad, including antimicrobial propertie s, antioxidant activity and antihypertensive activity. The development of collagen industry should not be limited to medicinal materials and tissue engineering. Food and health products based on collagen and its hydrolysates should also be developed.
collagen hydrolysates; antimicrobial properties; antioxidant activity; antihypertensive activity
TS209
A
1002-6630(2015)19-0292-05
10.7506/spkx1002-6630-201519053
2014-12-08
中央高校基本科研業務費專項資金一般項目(2120130635);西南大學博士啟動項目(SWU114092)
段煉(1985-),男,講師,博士,研究方向為蛋白質化學及資源化利用。E-mail:duan19850420@163.com
*通信作者:張德勝(1986-),男,助教,碩士,研究方向為蛋白質化學及資源化利用。E-mail:2695117804@qq.com

