乳中大腸桿菌O157:H7的熒光定量PCR檢測方法的建立
張微,姚笛,侯婷婷,郭瑜,佐兆杭,劉鑫
(黑龍江八一農墾大學食品學院,黑龍江大慶163319)
0 引言
腸出血性大腸桿菌是能引起人的出血性腹瀉和腸炎的一群大腸埃希氏菌[1、2]。以 O157:H7 血清型為代表菌株。自美國首次分離出該菌以后[3],O157:H7的爆發和流行相繼出現在20多個國家。我國近幾年也通過食品安全監測,先后從牛、羊、豬等肉類食品和乳中檢測到大腸桿菌O157:H7[5-7]。
目前,大腸桿菌O157:H7的檢測方法主要是細菌學培養法,該方法存在耗時,過程復雜,靈敏性不強等缺點。分子生物學檢測方法中應用較廣泛的常規PCR技術也存在假陽性和不能定量等缺點。因此,本研究擬建立一種大腸桿菌O157:H7的熒光定量PCR檢測方法,該技術具有更強的特異性和靈敏性,并能進行定量。建立的方法能夠使乳中大腸桿菌的檢測更為快速和準確,并為其他致病菌的快速檢測提供參考。
1 實驗
1.1 材料
1.1.1 菌株
大腸桿菌O157:H7標準菌株、蠟樣芽孢桿菌、沙門氏菌、宋內氏志賀氏菌、大腸桿菌DH5α均為黑龍江八一農墾大學食品學院食品生物技術實驗室保存。
1.1.2 試劑
LB培養基,細菌基因組DNA抽提試劑盒,質粒抽提試劑盒,膠回收試劑盒,TaKaRa ExTaqTM(5 U/μL),rTaq(5 U/μL),MgCl2(25 mmol/L),dNTPs(10 mmol/L),DL2000DNAMarker,6×Loading Buffer,10×Loading Buffer,SYBR Premix Ex TaqTM(Tli RNaseH Plus)等。
1.1.3 儀器
PCR 基因擴增儀(9700型),電泳儀(JY04S-3B),凝膠成像系統(YJ600+型),Real-Time PCR儀(Line-Gene K型),臺式離心機(TGL-16B)。
1.2 方法
1.2.1 菌株的培養與DNA模板的制備
將大腸桿菌O157:H7接種于固體LB培養基中,37℃,24 h,挑取單菌落接種于液體LB培養基中,37℃,200 r/min,培養過夜。取培養液1.0 mL,置于1.5 mL的離心管中,12 000 r/min離心2 min,滅菌ddH2O洗劑兩次,最后300 μL ddH2O懸浮,隔水煮沸15 min,8 000 r/min離心15 min,取上清,即為DNA模板。
1.2.2 引物的設計與合成
根據Genebank發表的大腸桿菌O157:H7的特異性基因rfbE的序列,利用Primer 5軟件設計特異性引物,由上海生工生物技術有限公司合成,上游引物:5'-CATCTTTACTTTCCTTGTGGACTTG-3';下游引物:5'-AAACTATTACTACAGGTGAAGGTGG-3'。擴增片段大小為261 bp。
1.2.3 PCR擴增和純化
以大腸桿菌O157:H7 DNA為模板,對大腸桿菌O157:H7的rfbE基因進行PCR擴增,反應體系:95℃預變性3 min,95 ℃變性30 s,55 ℃退火30 s,72 ℃延伸30 s,經30個循環;最后72℃延伸7 min。獲得的PCR產物進行2%瓊脂糖凝膠電泳,對擴增目的片段進行回收純化,具體操作按照說明書進行。
1.2.4 目的基因的克隆
取純化的PCR產物4 μL,pMD 18T載體1 μL,SolutionⅠ5 μL,輕輕混勻,16 ℃連接2 h,將連接產物加入100 μL E.coli DH5α感受態細胞中進行重組質粒的轉化,取適量均勻涂布于Amp+的LB平板中,37℃培養過夜,挑取平板中的單個菌落,接種在Amp+的LB液體培養液中,37℃ 180 r/min振搖過夜。按照說明書操作提取質粒,對重組質粒進行PCR鑒定,將陽性克隆送上海生工進行序列測定。
1.2.5 熒光定量PCR擴增
測定重組質粒的濃度C值,并計算出原始拷貝數,進行倍比稀釋后,取稀釋度不同的質粒模板進行定量PCR擴增。反應體系為:SYBR Premix Ex Tap(2×)(Tli RNaseH Plus)12.5 μL,上、下游引物(濃度10 μmol/L)各0.5 μL,DNA模板2.0 μL,ddH2O 9.5 μL。反應條件為94℃(30 s),95 ℃(5 s)變性,60℃(20 s)退火、延伸,擴增45個循環,反應結束后,計算機自動計算,形成標準曲線。
1.2.6 靈敏性檢測
用ddH2O對已知濃度的大腸桿菌O157:H7的DNA進行10倍梯度稀釋,分別取質量濃度為1×10-3,1×10-4,1×10-5,1×10-6,1×10-7ng/μL 的 DNA樣品2 μL進行熒光定量PCR擴增,測定其最低檢測值。
1.2.7 特異性檢測
利用建立的定量PCR檢測方法,對大腸桿菌O157:H7、沙門氏菌、志賀氏菌、蠟樣芽孢桿菌4種感染人類的食品病原細菌同時進行檢測,進一步確定大腸桿菌O157:H7熒光定量PCR方法的特異性。
1.2.8 模擬標本的檢測
將大腸桿菌O157:H7制備一定濃度的菌懸液,用無菌生理鹽水10倍梯度稀釋,測定菌落總數,將含量分別為67.0,6.70×102,6.70×103,6.70×104mL-1的大腸桿菌O157:H7摻入滅菌的牛乳中,混勻后提取DNA模板進行定量PCR擴增。
2 結果與分析
2.1 PCR擴增與測序
以提取的大腸桿菌O157:H7的DNA為模板,用特異性引物PCR擴增rfbE基因片段,擴增結果如圖1所示。由圖1可以看出,擴增條帶的大小與預期一致,且條帶單一,無引物二聚體。將擴增的PCR產物回收、連接、轉化,然后提取重組質粒進行PCR鑒定,其鑒定結果如圖1所示。將鑒定正確的重組質粒進行測序,測序結果進行BLAST比對,結果可知擴增產物與大腸桿菌O157:H7 rfbE基因的同源性為100%。
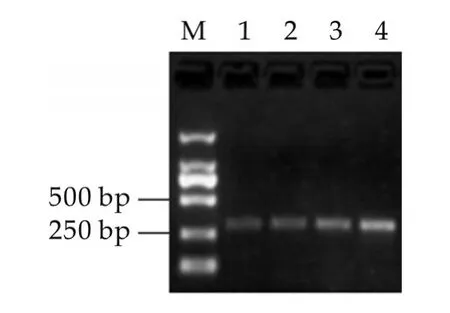
圖1 rfbE基因的PCR擴增產物
2.2 熒光定量PCR擴增結果
將重組質粒進行10倍系列稀釋,取濃度依次為1×105,1×106,1×107,1×108,1×109μL-1,分別以此為模板進行熒光定量PCR擴增,得到標準模板的實時PCR擴增曲線,擴增結果如圖2所示。根據質粒模板的Ct值繪制標準曲線,結果如圖3所示,得到線性方程為y=-3.40x+40.46,相關系數為0.991,表明在模板稀釋范圍內有很好的線性關系。然后進行標準模板熒光定量PCR的熔解曲線分析,結果如圖4所示。由圖4可以看出,不同濃度標準品的擴增產物的溶解溫度均為79.5℃,說明引物的特異性很好。
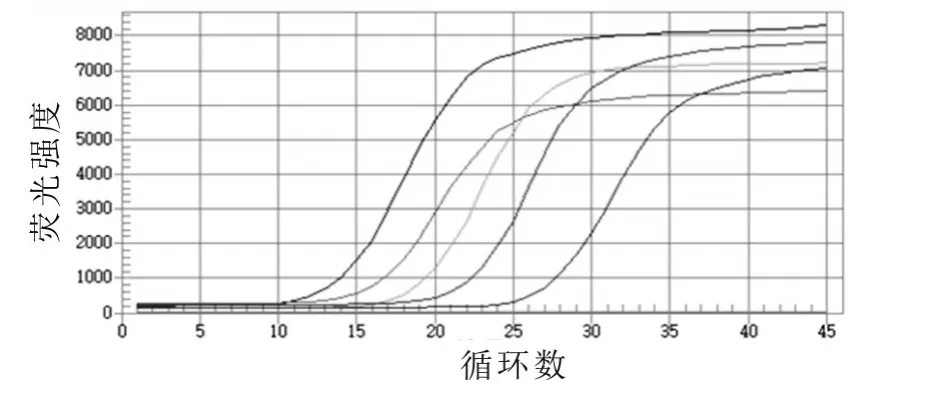
圖2 標準模板的熒光定量PCR擴增曲線

圖3 標準模板的標準曲線
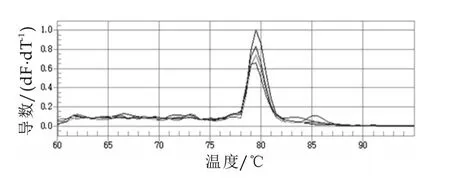
圖4 標準模板的熔解曲線
2.3 熒光定量PCR的特異性實驗
利用建立的熒光定量PCR方法對大腸桿菌O157:H7、蠟樣芽孢桿菌、沙門氏菌、宋氏志賀氏菌同時進行熒光定量PCR方法檢測,結果見圖5,結果表明:大腸桿菌O157:H7出現良好的擴增曲線,結果為陽性,而其他細菌均未出現曲線擴增,結果均為陰性。說明本研究建立的方法對大腸桿菌O157:H7有很好的特異性,與其他三種細菌無交叉反應。
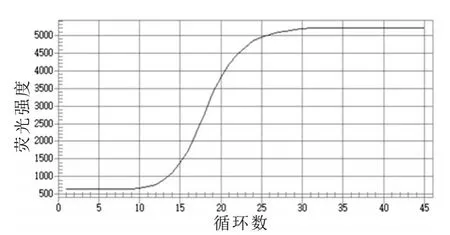
圖5 大腸桿菌O157∶H7熒光定量的特異性檢測
2.4 熒光定量PCR的靈敏性實驗
將大腸桿菌O157:H7的DNA模板用dd H2O 10倍梯度稀釋成1×10-3,1×10-4,1×10-5,1×10-6,1×10-7ng/μL的質量濃度,進行熒光定量PCR擴增,結果顯示其靈敏度為1×10-6ng/μL。當DNA的質量濃度只有1×10-6ng/μL時,根據公式計算出拷貝數為3.49×103μL-1,說明建立的熒光定量PCR方法擴增大腸桿菌O157:H7的靈敏度好。
2.5 模擬標本的檢測
將大腸桿菌O157:H7摻入到滅菌的牛乳中,使乳中菌的含量為 67.0,6.70× 102,6.70× 103,6.70× 104mL-1,采用熒光定量PCR方法同時進行檢測,結果如圖6所示。由圖6可以看出:當乳中大腸桿菌O157:H7的含量只有67.0 mL-1時,依然可以檢測到特異性擴增。
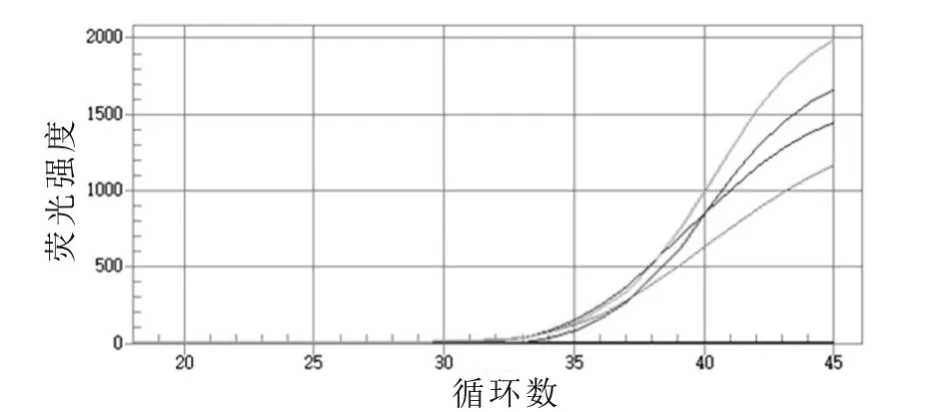
圖6 模擬標本的熒光定量PCR擴增曲線
3 結論
乳制品被普遍認為是致病性大腸桿菌的污染源[8],檢測方法包括細菌的分離鑒定和生化鑒定等方法。本研究以致病性強的大腸桿菌O157:H7為檢測對象,建立熒光定量PCR檢測方法,該技術操作過程簡單、快速,全部操作過程僅需3 h左右,大大提高了工作效率,與其他方法相比靈敏度高,特異性強,檢測的靈敏度可達1×10-6ng/μL,拷貝數為3.49×103μL-1,且與蠟樣芽孢桿菌、沙門氏菌、志賀氏菌三種細菌均無交叉反應。利用建立的方法檢測人工污染乳中的大腸桿菌 O157:H7,發現乳中大腸桿菌O157:H7的含量只有67.0 mL-1時,依然可以檢測到特異性擴增,說明該方法的靈敏度很高。本研究為建立乳中大腸桿菌O157:H7的檢測體系提供了一種高效、便捷、可靠的新技術,同時也為乳制品中其他致病菌的檢測提供了參考,具有較高的推廣和使用價值。
[1]王培育.腸出血性大腸桿菌O157:H7檢測技術進展[J].國際檢驗醫學雜志,2013,34(19):2570.
[2]LI Y,FREY E,MACKENZI A M,et al.Hu man response to Escherichi a coli 0 157:H7 infection :antibodies to secreted Vir ulence factors.Infect I mmun,2000,68(9):5090-5095.
[3]FACHP,PERELLES,GROUT J,et al.Comparison of different PCR teats for detecting Shigatoxin.Producing Escherichia coli 0157 and development of all EUSA-PCR assay for specific identification of the bacteria[J].J.Mierobiol Methods,2003,55(2):389-392.
[4]SCOTTER S,ALDRIDGE M,CAPPS K.Validation of a method for the detection of E.coli O157:H7 in foods,2000,11(2):85-95.
[5]林鷺芳,黃健利,鐘凌.漳州市首次檢出E.coli O157:H7[J].海峽預防醫學雜志,2002,8(4):52.
[6]倪大新,汪華,顧玲.江蘇省1999年大腸埃希菌O157:H7宿主動物帶菌情況調查[J].中華流行病學雜志,2002,23(2):102-104.
[7]孫強,李昱潔,任科研,等.大腸桿菌O157∶H7檢測技術的概況[J].吉林畜牧獸醫,2013,34(7):61-62.
[8]KEASLER S P,WALTER E H.Polymerase chain reaction idemification of enteroinasive Escherichia coli seeded into raw milk[J].Food Prot,1992,55:382-384.

