感染后腸易激綜合征小鼠不同腸段腸黏膜熱休克蛋白70的表達及意義*
周旭春,孫曉寧,楊波,黃白麗,鄧桃枝,何周桃,韓向陽,藍程
(1.海南省人民醫院消化內科,海南 海口 570311;2.重慶醫科大學附屬第一醫院消化內科,重慶 400016)
·論著·
感染后腸易激綜合征小鼠不同腸段腸黏膜熱休克蛋白70的表達及意義*
周旭春1,孫曉寧1,楊波2,黃白麗1,鄧桃枝1,何周桃1,韓向陽1,藍程1
(1.海南省人民醫院消化內科,海南 海口 570311;2.重慶醫科大學附屬第一醫院消化內科,重慶 400016)
目的探討感染后腸易激綜合征(PI-IBS)小鼠不同腸段腸黏膜熱休克蛋白70(HSP70)的表達,及其與炎癥細胞因子表達的相關性。方法旋毛蟲感染小鼠,不同腸段腸黏膜組織蘇木精-伊紅染色法(HE)染色,炎癥評分。腹壁撤退反射(AWR)和結腸傳輸試驗(CTT)觀察內臟敏感性和腸道動力變化。免疫組織化學及酶聯免疫吸附試驗(ELISA)檢測不同腸段HSP70和炎癥細胞因子的表達。Spearman相關性分析HSP70與炎癥細胞因子表達的相關性。結果①小鼠感染旋毛蟲后末段回腸和結腸出現明顯炎癥,炎癥消退后仍存在明顯的內臟高敏感和腸道動力異常。②PI-IBS小鼠空腸和末段回腸的HSP70表達較對照組明顯增強(P<0.01)。③PI-IBS小鼠末段回腸白細胞介素-17(IL-17)、干擾素-γ(IFN-γ)水平明顯升高,空腸、末段回腸及結腸白細胞介素-10(IL-10)水平明顯降低(P<0.01)。④PI-IBS小鼠空腸HSP70表達與炎癥細胞因子IL-10呈負相關(P<0.01);末段回腸HSP70表達與IL-10呈負相關(P<0.01),與IL-17、IFN-γ呈正相關(P<0.01)。結論①不同腸段HSP70和炎癥細胞因子的相關差異性表達可能在PI-IBS發病中起作用。②末段回腸可能是PI-IBS最重要的炎癥免疫啟動和調控部位。
感染后腸易激綜合征;熱休克蛋白70;炎癥;細胞因子;免疫組織化學;酶聯免疫吸附試驗
盡管發病機制尚未完全闡明,但大量證據提示感染和炎癥可能是腸易激綜合征(irritable bowel syndrome,IBS)重要的發病機制之一,即感染后腸易激綜合征(post-infectious irritable bowel syndrome,PI-IBS)[1-2]。熱休克蛋白70(heat shock protein 70,HSP70)是分子伴侶熱休克蛋白家族的一員,在胃腸黏膜的炎癥和損傷中起重要作用[3-4]。有關PI-IBS不同腸段HSP70的表達及其在PI-IBS發病中的意義未見報道,本文則報道研究的初步成果。
1 材料與方法
1.1 實驗材料
33只雌性C57BL/6(B6)小鼠(6~8周齡)購自中國科學院昆明動物所,隨機分為PI-IBS第2周組、PI-IBS第8周組和對照組,每組11只。旋毛蟲購自蘭州獸醫研究所,胃蛋白酶為美國Invitrogen公司產品,免疫組織化學試劑盒為武漢博士德公司產品,酶聯免疫吸附試驗(enzyme-linked immunosorbent assay,ELISA)試劑盒為深圳精美公司進口分裝,所有抗體來自美國BD Bioscience公司。
1.2 PI-IBS小鼠模型的建立和臨床指標的觀察
旋毛蟲感染法制作小鼠PI-IBS模型[5]。旋毛蟲包囊感染60 d的Sprague Dawley小鼠以胃蛋白酶人工消化法分離肌幼蟲。每只小鼠灌服0.2 ml含300個幼蟲的生理鹽水,感染后第8周進行腹壁撤退反射(abdominal withdrawal reflex,AWR)和結腸傳輸試驗(colon transportation test,CTT),分別觀察動物的內臟敏感性及腸道動力變化。結直腸氣囊擴張刺激后按動物情緒和腹肌收縮評分,總分0~4分[6]。活性炭灌胃后記錄首次排黑便時間以及糞便Bristol評分[7]。
1.3 組織病理學
感染后第2和8周分別取末端回腸和近端結腸組織,4%多聚甲醛固定,常規石蠟包埋切片,蘇木精-伊紅染色法(hematoxylin-eosin staining,HE)染色。顯微鏡下觀察各段腸黏膜組織炎癥。按DIELEMAN等[8]報道的方法,由2位病理學家進行雙盲法評分。
1.4 腸黏膜HSP70表達
感染后第8周免疫組織化學檢測腸黏膜HSP70的表達。腸組織切片脫蠟至水,一抗為大鼠抗小鼠HSP70單克隆IgG抗體,二抗為HRP Polymer酶標兔抗大鼠IgG抗體,二氨基聯苯胺(diaminobenzidine,DAB)顯色,光鏡觀察。
參照ZAGZAG等[9]的方法對染色強度和陽性細胞比例進行綜合評分,并對兩組的結果進行半定量比較。染色強度評分:0分,未見黃色;1分,淺黃色;2分,棕黃色;3分,棕褐色。陽性細胞比例評分:0分,無陽性細胞;1分,<1%;2分,1%~10%;3分,10%~50%;4分,>50%。
1.5 細胞因子表達
感染后第8周,取動物不同腸段組織,在4℃下經機械+超聲粉碎后,組織勻漿離心取上清液,ELISA測定細胞因子干擾素-γ(interferon gamma,IFN-γ)、白細胞介素-17(interleukin-17,IL-17)、白細胞介素-4(interleukin-4,IL-4)、白細胞介素-10(interleukin-10,IL-10)及腫瘤壞死因子-α(tumor necrosis factor alpha,TNF-α)的表達,按照試劑盒說明書進行操作。
1.6 統計學方法
采用SPSS 13.0統計軟件進行數據分析,計量資料以(±s)表示,用t檢驗,相關性分析用Spearman相關性檢驗,P<0.05為差異有統計學意義。
2 結果
2.1 建立小鼠PI-IBS模型
2.1.1 HE染色與對照組比較,模型組小鼠末端回腸和近端結腸組織在感染后第2周起,存在顯著中性粒細胞的炎癥細胞浸潤和間質充血水腫;第8周炎癥和水腫逐漸減輕至基本恢復正常,空腸的炎癥不明顯。見圖1。

圖1 3組小鼠腸道病理變化(HE×200)
2.1.2 腸道組織炎癥評分PI-IBS第2周組、PI-IBS第8周組及對照組小鼠腸道組織炎癥評分見表1。
表1 3組小鼠腸道組織炎癥評分(n=11±s)

表1 3組小鼠腸道組織炎癥評分(n=11±s)
注:1)與對照組比較,t=-13.823,P=0.000;2)與對照組比較,t= -12.076,P=0.000
分組空腸回腸結腸PI-IBS第2周組1.36±1.217.91±1.301)7.36±0.922)PI-IBS第8周組1.09±1.301.64±1.571.27±1.49對照組1.1 8±1.330.82±1.401.00±1.41
2.1.3 AWR評分當結直腸的擴張空氣量為0.35和0.50 ml時,PI-IBS組小鼠的AWR評分明顯高于對照組,差異有統計學意義。見圖2。
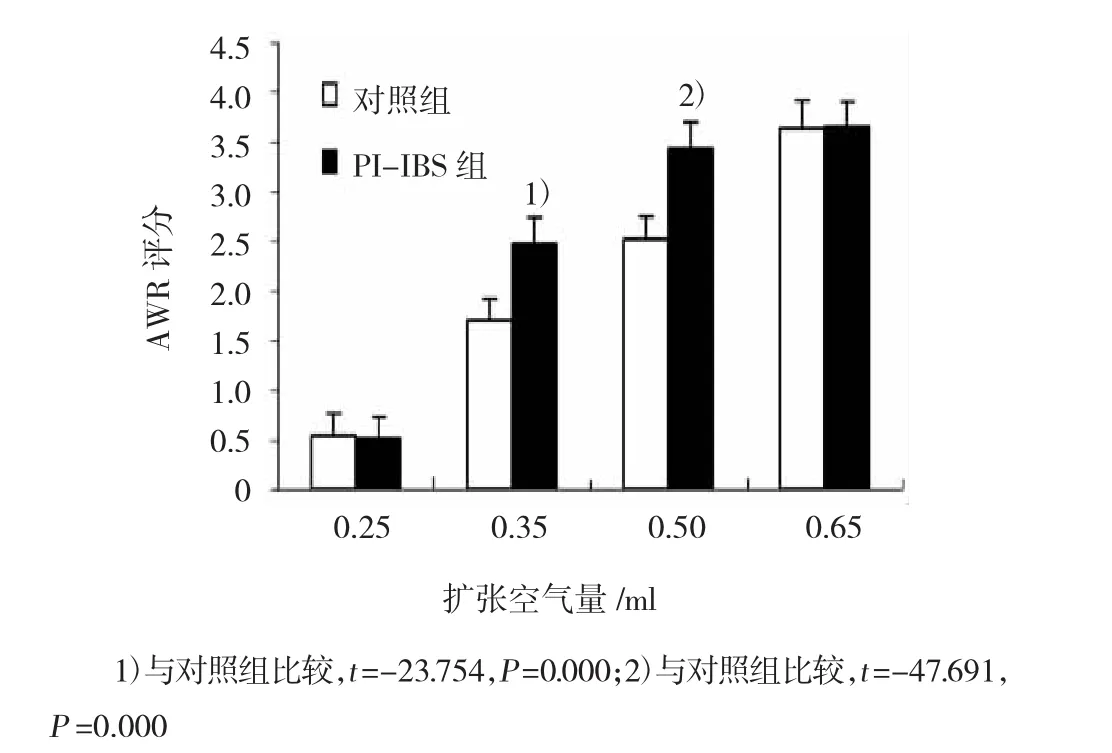
圖2 小鼠結直腸氣囊擴張AWR評分
2.1.4 腸道動力檢測PI-IBS組小鼠首次排黑便時間為(87.33±10.16)min,比對照組[(109.36±10.24)min]明顯縮短(t=6.187,P=0.000)。8 h糞便Bristol評分PI-IBS組(2.08±0.32),明顯高于對照組(1.02±0.20)(t=10.822,P=0.000)。
2.2 腸黏膜HSP70表達
HSP70主要表達于腸道黏膜上皮細胞的胞漿,在固有層部分表達,在黏膜下層及黏膜肌層表達相對較少。與對照組比較,PI-IBS小鼠空腸和末段回腸的HSP70表達明顯增強(P<0.01)。見圖3和表2。
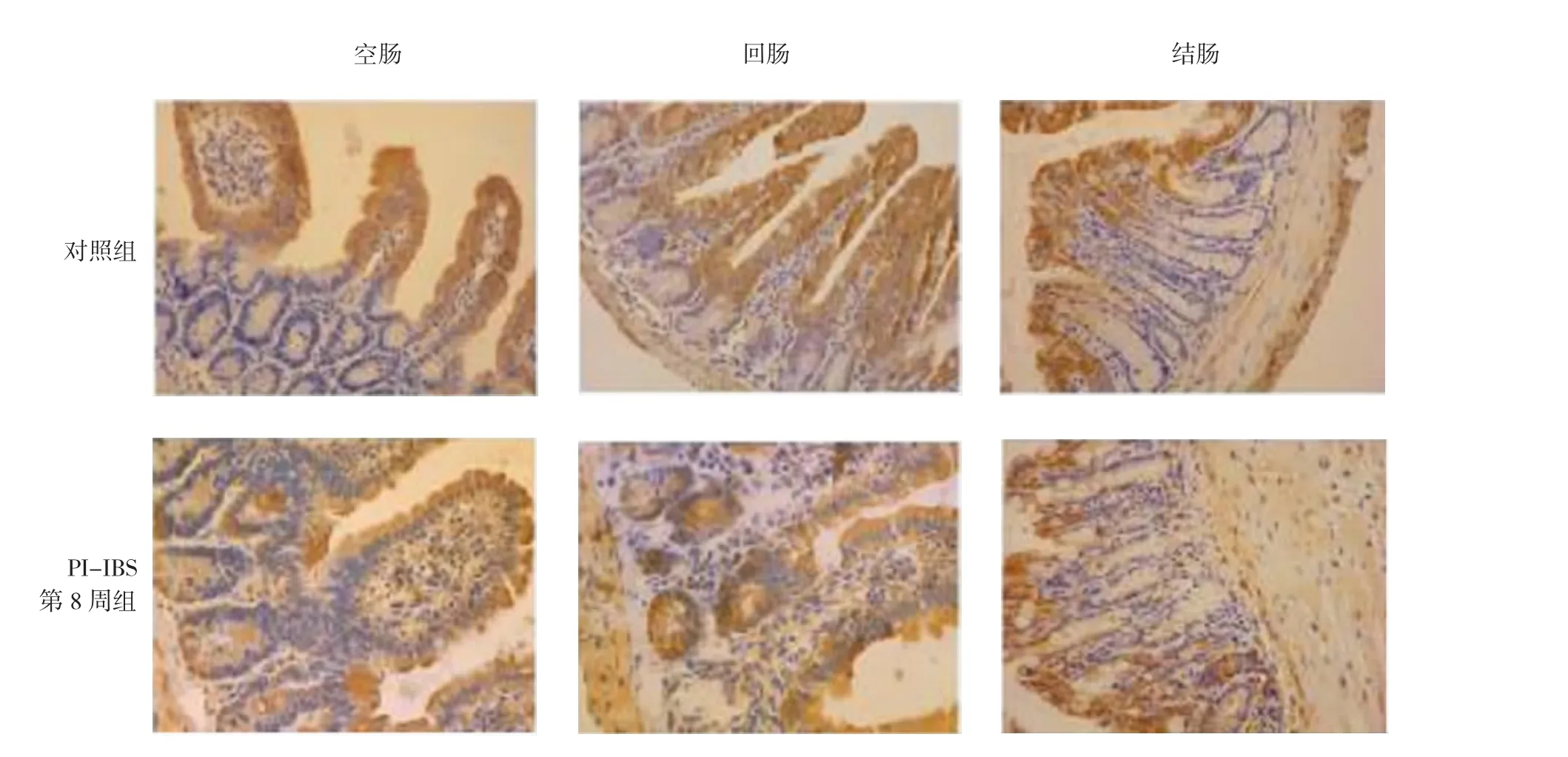
圖3 免疫組織化學檢測小鼠不同腸段HSP70表達(×200)
表2 兩組小鼠腸道組織HSP70免疫組織化學染色評分(n=11±s)

表2 兩組小鼠腸道組織HSP70免疫組織化學染色評分(n=11±s)
注:1)與對照組比較,t=7.416,P=0.000;2)與對照組比較,t=5.190,P=0.000
組別空腸回腸結腸PI-IBS組5.18±0.231)4.82±0.232)2.73±0.24對照組3.18±0.223.09±0.152.72±0.19
2.3 腸道炎癥細胞因子表達
與對照組比較,PI-IBS組小鼠末段回腸IL-17、IFN-γ明顯升高,空腸、末段回腸及結腸IL-10明顯降低(P<0.01)。見圖4~6。

圖4 小鼠不同腸段IL-17的表達

圖5 小鼠不同腸段IFN-γ的表達

圖6 小鼠不同腸段IL-10的表達
2.4 腸黏膜HSP70與PI-IBS小鼠腸道炎癥細胞因子表達的相關性
Spearman分析表明,PI-IBS小鼠空腸HSP70表達與腸道炎癥細胞因子IL-10呈負相關(r=-0.782,P<0.01);回腸HSP70表達與IL-10呈負相關(r= -0.752,P<0.01),與IL-17、IFN-γ呈正相關(r=0.718和0.727,P<0.01)。見表3。
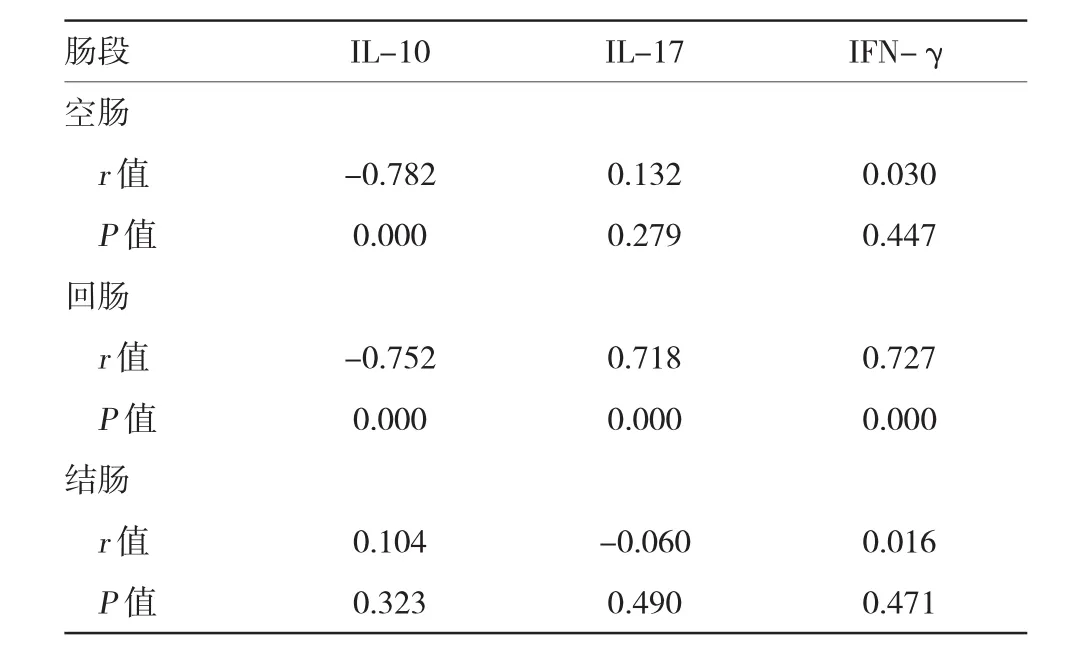
表3 PI-IBS小鼠不同腸段HSP70與腸道炎癥細胞因子表達的相關性
3 討論
腸道的部位劃分實際上是一個功能區分的概念,不同腸段承擔著消化、吸收、糞便形成等基本功能;在病理生理角度,不同腸段在分泌消化酶、轉運營養物質、腸道動力變化或者免疫調控方面起不同作用。IBS是胃腸動力異常、內臟敏感性增高、局部炎癥免疫反應、心理、社會因素等多種復雜因素共同作用的結果。體現在腸道功能就遠不止腹瀉和便秘這么簡單。過去一般認為,IBS的主要功能區在于結腸的變化,對其他腸段的作用則研究很少。HSP70是一組結構高度保守的分子伴侶蛋白,在多數原核和真核細胞中呈結構性表達或由熱休克及其他刺激誘導表達。HSP70可以協助由于應激或炎癥損傷而改變折疊結構的重要蛋白重新折疊,從而使損傷得到修復[10]。應急和炎癥時表面表達HSP分子的炎癥效應細胞可以被免疫細胞識別并清除[11]。另外,HSP70可能是胃腸黏膜炎癥和損傷的重要調節因子[12]。本文通過觀察PI-IBS小鼠不同腸段的HSP70表達及其與相應腸段炎癥的關系,試圖從腸段功能異質性這一新的角度來尋找PI-IBS發病機制的新線索。筆者發現,①PI-IBS小鼠不同腸段的炎癥不同,即末端回腸和近端結腸最明顯;第8周時腸道炎癥基本消退,但末端回腸和近端結腸的HSP70表達仍有明顯增強,十二指腸和空腸的HSP70表達沒有變化。這說明末端回腸和近端結腸可能是PI-IBS重要的調控部位。②進一步觀察不同腸段炎癥細胞因子的變化,發現PI-IBS小鼠末段回腸的IL-17、IFN-γ水平明顯升高,空腸、末段回腸及結腸IL-10明顯降低。該結果可以解釋不同腸段的炎癥。那么,不同腸段HSP70表達與炎癥的關系是通過什么途徑實現呢?筆者分析HSP70和幾種炎癥細胞因子的相關性,發現PI-IBS小鼠空腸HSP70表達與腸道炎癥細胞因子IL-10呈負相關;末段回腸HSP70表達與IL-10呈負相關,與IL-17、IFNγ均呈正相關。IL-10是抗炎因子,而IL-17和IFN-γ則是原炎癥因子[13-15]。這提示PI-IBS不同腸段HSP70可能與相應腸段的炎癥細胞因子表達有關,前者可能通過影響后者來影響腸道炎癥。
有趣的是,不論腸段炎癥、HSP70還是炎癥細胞因子表達,回腸末段都是變化最明顯的部位,這提示末段回腸可能是PI-IBS最重要的炎癥免疫啟動和調控部位。這可能是由于回腸末段免疫組織豐富的緣故。
綜上所述,不同腸段HSP70和炎癥細胞因子的相關差異性表達可能在PI-IBS發病中起作用,末段回腸可能是PI-IBS最重要的炎癥免疫啟動和調控部位。探討不同腸段HSP70表達在PI-IBS中的作用,將為深入闡明PI-IBS的病理生理機制提供線索。當然,其具體的細胞和分子調控機制有待進一步研究。
[1]SOARE S RL.Irritable bowel syndrome:a clinical review[J]. World J Gastroenterol,2014,20(34):12144-12160.
[2]FUTAGAMI S,ITOH T,SAKAMOTO C.Systematic review with meta-analysis:post-infectious functionaldyspepsia[J].Aliment Pharmacol Ther,2015,41(2):177-188.
[3]DUNCAN EJ,CHEETHAM ME,CHAPPLE JP,et al.The role of HSP70 and its co-chaperones in protein misfolding,aggregation and disease[J].Subcell Biochem,2015,78:243-273.
[4]MATTOORU,GOLOUBINOFFP.Molecularchaperonesare nanomachines that catalytically unfold misfolded and alternatively folded proteins[J].Cell Mol Life Sci,2014,71(17):3311-3325.
[5]YANG B,ZHOU X,LAN C.Changes of cytokine levels in a mouse model of post-infectious irritable bowel syndrome[J].BMC Gastroenterol,2015,15:43.
[6]DISTRUTTI E,CIPRIANI S,MENCARELLI A,et al.Probiotics VSL 3 protect against development of visceral pain in murine model of irritable bowel syndrome[J].PLoS One,2013,DOI: 10.1371/journal.pone.0063893.
[7]CAROFF DA,EDELSTEIN PH,HAMILTON K,et al.The Bristol stool scale and its relationship to Clostridium difficile infection[J].J Clin Microbiol,2014,52(9):3437-3439.
[8]DIELEMAN LA,PALMEN MJ,AKOL H,et al.Chronic experimental colitis induced by dextran sulphate sodium(DSS)is characterized by Th1 and Th2 cytokines[J].Clin Exp Immunol,1998, 114(3):385-391.
[9]ZAGZAG D,ZHONG H,SCALZITTI JM,et al.Expression of hypoxia-inducible factor 1α in brain tumors[J].Cancer,2000, 88(11):2606-2618.
[10]SHIBER A,RAVID T.Chaperoning proteins for destruction:diverse roles of Hsp70 chaperones and their co-chaperones in targeting misfolded proteins to the proteasome[J].Biomolecules, 2014,4(3):704-724.
[11]HIRSH MI,HASHIGUCHI N,CHEN Y,et al.Surface expression of Hsp72 by LPS-stimulated neutrophils facilitates gammadelta T cell-mediated killing[J].Eur J Immunol,2006,36(3): 712-721.
[12]LIU H,DICKSVED J,LUNDH T,et al.Heat shock proteins: intestinal gatekeepers that are influenced by dietary components and the gut microbiota[J].Pathogens,2014,3(1):187-210.
[13]SAXENA A,KHOSRAVIANI S,NOEL S,et al.Interleukin-10 paradox:a potent immunoregulatory cytokine that has been difficult to harness for immunotherapy[J].Cytokine,2015,74(1): 27-34.
[14]CǎTANǎ CS,BERINDAN NEAGOE I,COZMA V,et al.Contribution of the IL-17/IL-23 axis to the pathogenesis of inflammatory bowel disease[J].World J Gastroenterol,2015,21(19): 5823-5830.
[15]FORSTER S.Interferon signatures in immune disorders and disease[J].Immunol Cell Biol,2012,90(5):520-527.
(申海菊 編輯)
Role of differentially expressed heat shock protein 70 in various intestinal segments of mice in pathogenesis of post-infectious irritable bowel syndrome*
Xu-chun ZHOU1,Xiao-ning SUN1,Bo YANG2,Bai-li HUANG1,Tao-zhi DENG1, Zhou-tao HE1,Xiang-yang HAN1,Cheng LAN1
(1.Department of Gastroenterology,Hainan Provincial General Hospital,Haikou,Hainan 570311,P.R.China;2.Department of Gastroenterology,the First Affiliated Hospital, Chongqing Medical University,Chongqing 400016,P.R.China)
【Objective】To elucidate the role of differentially expressed heat shock protein 70(HSP70)in various intestinal segments of mice in the pathogenesis of post-infectious irritable bowel syndrome(PI-IBS).【Methods】To establish the PI-IBS animal model,the mice were infected with Trichinella spiralis.After 8 weeks,the intestinal inflammatory score,abdominal withdrawal reflex(AWR),intestine transportation time and Bristol scores were used to evaluate the clinical features of the mice,which were regarded as the characteristics for IBS.The intestinal HSP70 level in the various bowel segments including jejunum,terminal ileum and colon was detected by immunohistochemistry.The concentration of the intestinal inflammatory cytokines was examined by ELISA.The relationship between the intestinal HSP70 level and the clinical features of PI-IBSwas studied by Spearman correlation analysis.【Results】①The infected mice showed remarkable visceral hypersensitivity and abnormal intestinal motility even after the significant inflammation disappeared in their terminal ileum and proximal colon.②The expression of HSP70 significantly increased in the jejunum and terminal ileum of the PI-IBS mice(P<0.01)compared to the control group.③The expressions of IL-17 and IFN-γ significantly increased in the terminal ileum of the PI-IBS mice(P<0.01),while that of IL-10 decreased in all the three intestine segments(P<0.01).④In jejunum and terminal ileum of the PI-IBS mice,there was a negative correlation between HSP70 level and IL-10(P<0.01),while there were positive correlations between HSP70 level and both IL-17 and IFN-γ in the terminal ileum(P<0.01).【Conclusions】①The differentially expressed heat shock protein 70 in various intestinal segments may play an important role in the pathogenesis of post-infectious irritable bowel syndrome.②The terminal ileum may be an essential location where the inflammatory process,immune response and regulating events are triggered.
post-infectious irritable bowel syndrome;heat shock protein 70;inflammation;cytokine;immunohistochemistry;ELISA
R574.4
A
1005-8982(2015)29-0001-06
2015-05-27
國家自然科學基金(No:81160057);海南省國際科技合作專項基金(No:KJHZ2013-14)
藍程,E-mail:lancheng71@163.com;Tel:13078985175
周旭春,現工作單位為重慶醫科大學附屬第一醫院消化內科

