酒精性心肌病小鼠心電圖校正QT間期延長的電生理機制探討*
江宇,韓鐘霖,曹克將,汪道武
基礎與實驗研究
酒精性心肌病小鼠心電圖校正QT間期延長的電生理機制探討*
江宇,韓鐘霖,曹克將,汪道武
目的:通過建立酒精性心肌病小鼠動物模型,研究酒精性心肌病小鼠校正QT間期(QTc)延長的電生理機制。
方法:將40只C57 BL/6小鼠隨機分為兩組,酒精組(n=25)和對照組(n=15)。酒精組通過長期飲酒和灌胃建立小鼠酒精性心肌病模型,因造模和麻醉過程中死亡12只小鼠,最終納入13只小鼠,對照組麻醉過程中死亡3只小鼠,最終納入12只。使用染色和電鏡驗證酒精性心肌病模型,用小動物心電圖測量小鼠心電圖相關指標,通過酶解法將小鼠心室肌細胞進行急性分離,最后使用全細胞膜片鉗技術對細胞動作電位以及各種離子通道進行電生理學檢測,并進行通道相關動力學急性檢測。
結果:5個月后,酒精組小鼠平均左心室射血分數(LVEF)值為(39.06±1.511)%,而對照組小鼠為(61.18±2.56)%。小鼠心電圖檢查顯示,酒精組平均QTc較對照組明顯延長[(106.43±5.91)ms vs (85.64±6.35)ms,P<0.05]。全細胞膜片鉗實驗發現,酒精組小鼠心肌細胞動作電位時程延長,心肌細胞動作電位復極至90%所需時間(APD90)為(37.62±3.53)ms,對照組小鼠心肌細胞APD90為(25.77±3.41)ms。膜片鉗實驗發現酒精組小鼠L型鈣電流失活延遲,其窗口電流面積增大。
結論:長期大量飲酒可導致心室肌鈣通道失活延遲,從而延長心室肌細胞動作電位。這是酒精性心肌病小鼠心電圖QTc延長的原因之一。
酒精性心肌病;校正QT間期;膜片鉗實驗;動作電位;L型鈣電流
Methods: A total of 40 C57BL/6 mice were randomly divided into 2 groups: Alcoholic group, n=25, the ACM model was established by long term alcohol drinking and intragastric alcohol administration, 12 mice died during modeling and anesthesia and 13 mice were enrolled for study. Control group, n=15, the mice were fed by normal diet, 3 died during anesthesia and 12 were enrolled for study. All animals were treated for 5 months. The pathological changes of ACM were examined by electric microscope, QT interval was measured by ECG, the electrophysiology of cell action potential duration and ion channels were detected by whole cell patch-clamp techniques.
Results: Alcohol group showed decreased left ventricle ejection fraction (LVEF) than Control group (39.06 ± 1.511) % vs (61.18 ± 2.56) %, prolonged QT interval (106.43 ± 5.91) ms vs (85.64 ± 6.35) ms, P<0.05, and extended action potential duration APD90(37.62 ± 3.53) ms vs (25.77 ± 3.41) ms. Alcohol group also presented delayed voltage-dependent inactivation of L-type Ca2+channel and increased window current area.
Conclusion: Long term alcohol drinking may cause extended inactivation of myocardium Ca2+channel, prolong the action potential duration, which is one of the mechanisms for prolonged QT interval of ACM in experimental mice.
(Chinese Circulation Journal, 2015,30:374.)
眾所周知,校正QT間期(QTc)延長和離散增加與心律失常密切相關,QTc延長也是酒精性心臟病猝死患者中常見的現象之一[1-3]。這部分患者發生QTc延長的概率為22%~46.9%[4]。QT間期與動作電位時程(APD)的變化與心肌細胞離子通道功能相關,目前已有研究證明多種動物心肌細胞在急性酒精作用下可影響細胞APD。Williams等[5]發現,5分鐘的酒精暴露即可下調家犬心臟蒲肯野纖維的APD。然而,相關研究多側重于酒精對心肌離子通道的急性變化,這種變化并不能完全代表臨床長期飲酒導致心臟結構及電生理重構的變化。由于目前關于慢性飲酒對心肌電生理的影響的研究尚不充分,因此本研究旨在慢性酒精性心臟病小鼠的基礎上,觀察并探討小鼠QTc變化的機制,為今后的臨床研究提供更多的理論依據。
1 材料與方法
酒精性心肌病小鼠模型的建立:2013-03至2014-09使用6周齡立特艾比拉特洛波C57BL/6清潔級小鼠[由揚州大學比較醫學中心提供,動物合格證號:SCXK(蘇)2012-0004]40只,適應性飼養一周后,隨機分組,酒精組25只,對照組15只,兩組小鼠平均體重無明顯差異。參考Wei Liu等[6]大鼠酒精性心肌病造模方法,酒精組依次給予濃度為5%、10%酒精自由飲一周后,在10%酒精自由飲的基礎上,以30%酒精灌胃0.2 ml/d,持續5個月造模(含酒精飲用水為唯一水源)。對照組以同等熱量的葡萄糖水灌胃。
超聲心動圖結構及功能測定:在造模和麻醉過程中,酒精組死亡12只小鼠,最終剩余13只;對照組死亡3只,最終僅剩12只。使用小動物超聲成像系統(Vevo770,Visual Sonics,加拿大)進行二維超聲心動圖檢測,超聲探頭為RMV70型。計量資料連續測量5個心動周期取平均值。測量指標包括室間隔厚度(IVS)、左心室射血分數(LVEF)、左心室短軸縮短率(LVFS)、左心室后壁收縮厚度(LVPW)。
心電圖測量:造模5個月后隨機從酒精組和對照組各取7只小鼠進行心電圖測量(酒精組小鼠麻醉過程中死亡1只,僅剩6只),接通多道生物信號采集與處理系統(RM6240B,成都儀器廠,中國),用0.1 ml 10%的水合氯醛麻醉小鼠,3~5 min待小鼠安靜后,取小鼠仰位,電極連線分為紅色(E)右上肢、黑色(EB)右下肢、綠色(HB)左下肢(Ⅱ導),將針電極分別刺入其四肢皮下,記錄Ⅱ導聯的心電圖。
心肌病理形態學、電鏡和心肌膠原纖維染色:造模5個月后用斷頸術處死3只小鼠,取出心臟,用4%甲醛固定,石蠟包埋,取左心室冠狀面制備3 mm薄切片,蘇木精-伊紅(HE)染色和馬松(masson)染色后顯微鏡下觀察形態變化。另取1 mm×1 mm左右的組織,固定、脫水、包埋、切片、染色進行透射電鏡(JEOL-1010,日本電子,日本)觀察。
單個心室肌細胞的分離:酒精組和對照組各選用造模5個月的4只小鼠以1000 U/kg肝素皮下注射,斷頸后,快速取出心臟,置于Langendorff灌流系統中,在37℃恒溫下進行主動脈逆行灌流,流速3 ml/min。用臺氏液[正常臺氏液成分(單位mmol/L):氯化鈉140;氯化鉀5.4;氯化鈣1.8;氯化鎂0.5;4-羥乙基哌嗪乙磺酸5.0;葡萄糖5.5;磷酸二氫鈉0.4,酸堿度(pH)用氫氧化鈉調至7.40]灌流1 min排除殘留血液后,換無鈣臺氏液[為正常臺氏液中不加鈣離子]灌流5 min排出液體中鈣離子,最后用含有0.05%膠原酶Ⅱ(Type 2,Worthington,美國)液體灌流12~15 min。取下心臟,將心室肌剪碎、吹打成單個心室肌細胞,自然沉淀,吸取上清液,用上述不含膠原酶的液體在室溫下孵育10 min、在KB液(單位mmol/L:氫氧化鉀70,氯化鉀40,磷酸二氫鉀20,L-谷氨酸50,牛磺酸20,乙二醇雙四乙酸0.5,4-羥乙基哌嗪乙磺酸10,葡萄糖10,用氫氧化鉀將pH調節至7.3)中孵育2 h后,選擇其中紋理清晰、表面光滑的單個心室肌細胞進行膜片鉗實驗。
小鼠心室肌細胞膜片鉗實驗:全細胞記錄單個心室肌細胞動作電位和鈉電流、L型鈣電流以及瞬
時外向鉀通道電流。將細胞懸液滴于三維倒置顯微鏡(IX50,OLYMPUS,日本)工作臺上的灌流槽內,待細胞黏附于槽底后,用細胞外液灌流,灌流速度l ml/min。玻璃微電極(1.4 mm,南京泉水電生理儀器廠,中國)用玻璃微電極拉制儀(P-1000 Model,Sutter Instrument,美國)拉制,電極灌沖內液后的電阻是1~3 MΩ,電極與膜片鉗放大器(Axopatch 200B,Axon Instrument,美國) 相連,當電極尖端與細胞表面接觸后,以持續負壓吸引,使電極尖端與細胞表面形成高阻抗(1 G以上)封接,再以微小負壓吸破細胞膜,計算機補償快速膜電容,形成全細胞記錄。在全細胞電流鉗狀態下記錄到心室肌細胞的靜息電位,然后給予脈寬3 ms、電流強度200~400 pA的刺激,即可誘發小鼠心室肌細胞動作電位的產生。測量心肌細胞動作電位復極至90%所需時間(APD90);在全細胞電壓鉗狀態下,用細胞外液灌流5 min,分別記錄鈉電流、L型鈣電流以及瞬時外向鉀電流及相關動力學指標。

2 結果
心電圖結果:通過對小鼠Ⅱ導聯的觀察,發現酒精組(n=6)小鼠的心率、PR間期、RR間期和QRS間期與對照組(n=7)沒有明顯差異(P>0.05),QTc延長有統計學意義(P<0.05)。表1
心功能觀察結果:5個月后,酒精組小鼠(n=13)LVEF和LVFS值均低于對照組(n=12),差異有統計學意義(P均<0.05)。表2
表1 兩組小鼠的心電圖比較分析(

表1 兩組小鼠的心電圖比較分析(
注:與對照組比較*P<0.05
?
表2 兩組小鼠心功能指標檢測結果

表2 兩組小鼠心功能指標檢測結果
注:與對照組比較*P<0.05。LVEF:左心室射血分數 LVPWd:左心室后壁厚度 IVS:室間隔厚度LVFS:左心室短軸縮短率
?
心肌組織電鏡、病理和心肌膠原染色結果:通過HE染色發現酒精組小鼠心肌細胞老化、縮小,肌纖維斷裂不規則(圖1B,箭頭標注),而對照組心肌細胞飽滿,肌纖維排列整齊(圖1A),兩組masson染色無明顯差異(圖1D、1C)。在電鏡下,酒精組出現明顯可以看到部分肌絲斷裂,肌絲間可見潤盤縫隙連接區斷裂,致密斑消失,脂滴生成(圖1F,箭頭標注);而對照組細胞核內染色質有輕度凝集現象,肌細胞各帶結構明顯,細胞器豐富(圖1E)。圖1
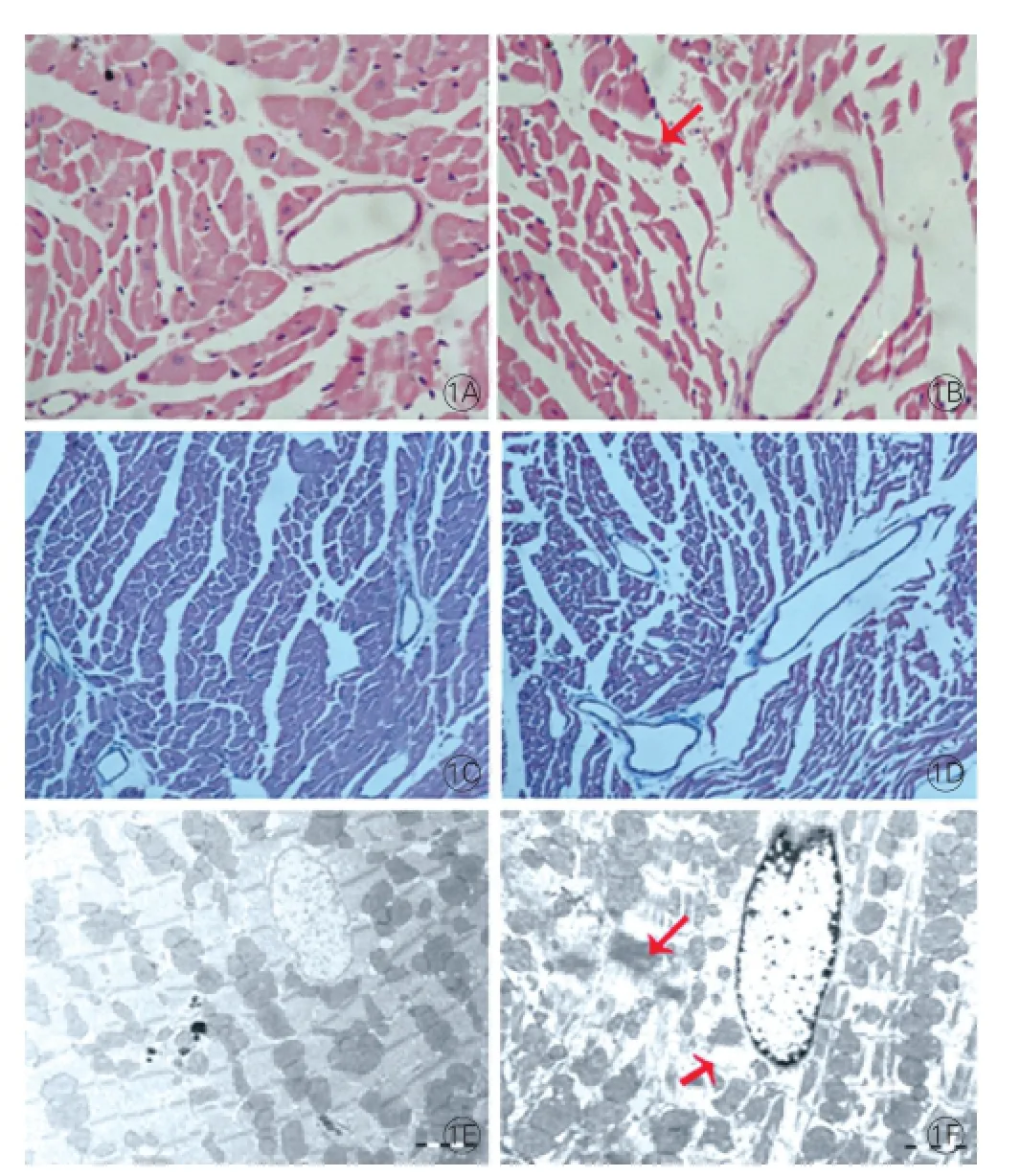
圖1 兩組小鼠心肌組織目鏡病理和電鏡結果
膜片鉗實驗結果:酒精組小鼠心肌細胞(n=9)APD90較對照組(n=13)明顯延長[(37.62±3.53)ms vs(25.77±3.41)ms],差異有統計學意義(P<0.05)。圖2
離子通道電流及其動力學測量發現,酒精組小鼠的鈣通道電流密度絕對值較對照組有所減少[(-7.49±0.56)pA/pF
vs (-10.31±0.60)pA/pF,P<0.05)](圖3),但酒精組失活動力學檢測下半失活電壓向負極方向移動,提示較對照組明顯失活延遲[(-31.78±1.44)mV vs (-39.55 ± 1.26)mV,P<0.05],而激活動力學檢測下兩組無明顯差異。表3

圖2 兩組小鼠心肌細胞動作電位復極至90%所需時間比較(

圖3 兩組小鼠心肌細胞L型鈣電流電流電壓曲線的比較
表3 兩組小鼠心肌細胞鈣電流動力學指標比較
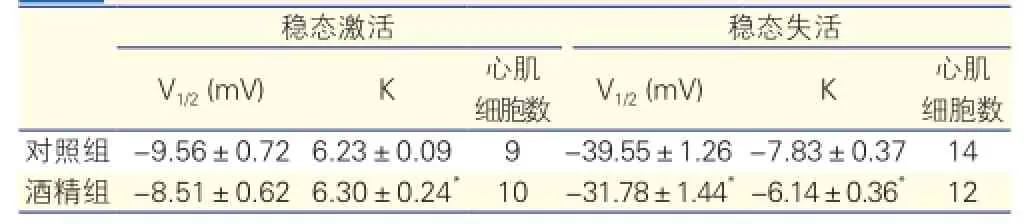
表3 兩組小鼠心肌細胞鈣電流動力學指標比較
注:與對照組比較*P<0.05; V1/2:半失活電位 K:斜率
?
實驗發現,鈉電流與動作電位的誘發及心電傳導有關。酒精組小鼠心肌細胞(n=17)和對照組(n=13)的鈉電流密度分別為[(36.00±2.41)pA/ pF vs(36.66±1.63)pA/pF] ,無明顯統計學差異(P>0.05,圖4),激活和失活動力學中斜率K酒精組均小于對照組,有微小差異,差異有統計學意義(P<0.05,表4)。

圖4 兩組小鼠心肌細胞鈉電流電流電壓曲線的比較
表4 兩組小鼠心肌細胞鈉電流動力學指標比較

表4 兩組小鼠心肌細胞鈉電流動力學指標比較
注:與對照組比較*P<0.05。余注見表3
?
瞬時外向鉀電流是小鼠心室肌細胞復極的主要外向電流。酒精組小鼠心室肌細胞(n=9)鉀電流密度與對照組(n=9)無明顯差異[(44.45±6.45)pA/ pF vs(48.93±8.74)pA/pF,P>0.05],且兩組小鼠心肌細胞瞬時外向鉀通道動力學也無明顯差異(P>0.05)。圖5、表5

圖5 兩組小鼠心肌細胞瞬時外向鉀電流電流電壓曲線的比較
表5 兩組小鼠心肌細胞瞬時外向鉀通道動力學比較

表5 兩組小鼠心肌細胞瞬時外向鉀通道動力學比較
注:V1/2和K注釋見表3
?
3 討論
飲酒是常見的猝死原因[7],長期大量飲酒可使心臟擴大,心肌纖維結構紊亂,心肌收縮功能減退,左心室射血分數降低[8],且可增加心源性猝死風險[9]。本研究中酒精組小鼠通過5個月的酒精飼養和灌胃,出現LVEF和LVFS降低等心功能下降等情況;病理檢查發現酒精組小鼠心肌細胞肌纖維斷裂不規則,電鏡下肌絲斷裂,潤盤縫隙連接區斷裂,致密斑消失,脂滴生成;同時酒精組小鼠心電圖QTc顯著延長;這些特征與相關報道相符[6,10,11]。在全細胞膜片鉗實驗中,酒精組小鼠APD90延長,鈣通道失活延遲,鈣通道窗口電流增大。雖然酒精組小鼠的鈣電流密度減小,但是其失活動力學顯著延遲,鈣通道窗口電流增大,提示鈣通道功能部分上調。此外,鈣通道功能的上調是8型長QT間期綜合征患者QTc延長的原因之一,Boczek等[12]的研究發現突變的鈣通道雖然電流減小,但是開放提前,功能上調,最終的結果是窗口電流增大,這就表明鈣通道在激活和失活的交替過程中,有更多的鈣離子進入細胞,導致復極時所需鉀離子增多。本研究發現鈣通道電壓依賴性失活延遲而電壓依賴性激活變化不明顯,綜合起來可導致窗口電流增大,這與之前的研究結果有類似之處,同時我們還發現瞬時外向鉀電流密度無明顯差異;綜合來看,以上因素可能是動作電位時程延長的主要原因之一。而且鈣通道窗口電流增大還可引起早期后除極,這也是導致心律失常發生的重要機制之一[13]。有研究[14]發現,在急性酒精浸潤情況下,細胞動作電位縮短,鈉電流、鉀電流、鈣電流都有一定程度減小,但這反映的是酒精的急性作用,并不能說明在長期酒精作用下患者心臟電生理是否發生改變。本研究的結果提示鈉電流可能并不是導致酒精性心肌病心電活動異常的主要原因。我們發現長期飲酒使鈣通道的失活延遲,開放時間相對延長,導致鈣通道窗口電流增大,從而使動作電位時程延長,最終促使小鼠QTc延長,而QTc延長是引起心室復極異常的重要原因,后者為猝死的心電基質[15]。這為酒精性心肌病患者猝死發生率升高提供了新的電生理學理論依據。
[1] Day CP, James OF, Butler TJ, et al. QT prolongation and sudden cardiac death in patients with alcoholic liver disease. Lancet, 1993, 341: 1423-1428.
[2] Day CP, McComb JM, Campbell RW. QT dispersion: an indication of arrhythmia risk in patients with long QT intervals. Br Heart J, 1990, 63: 342-344.
[3] Kupari M, Koskinen P. Alcohol, cardiac arrhythmias and sudden death. Novartis Found Symp, 1998, 216: 68-85.
[4] Yokoyama A, Ishii H, Takagi T, et al. Prolonged QT interval in alcoholic autonomic nervous dysfunction. Alcohol Clin Exp Res, 1992, 16: 1090-1092.
[5] Williams JW, Tada M, Katz AM, et al. Effect of ethanol and acetaldehyde on the (Na++K+)-activated adenosine triphosphatase activity of cardiac plasma membranes. Biochem Pharmacol, 1975, 24: 27-32.
[6] Liu W, Li J, Tian W, et al. Chronic alcohol consumption induces cardiac remodeling in mice from Th1 or Th2 background. Exp Mol Pathol, 2011, 91: 761-767.
[7] 李明, 黃京璐, 王小廣, 等. 622例猝死案例的流行病學調查. 中國循環雜志, 2014, 29: z1.
[8] Kim SD, Bieniarz T, Esser KA, et al. Cardiac structure and function after short-term ethanol consumption in rats. Alcohol, 2003, 29: 21-29.
[9] Bertoia ML, Triche EW, Michaud DS, et al. Long-term alcohol and caffeine intake and risk of sudden cardiac death in women. Am J Clin Nutr, 2013, 97: 1356-1363.
[10] Lorsheyd A, de Lange DW, Hijmering ML, et al. PR and QTc interval prolongation on the electrocardiogram after binge drinking in healthy individuals. Neth J Med, 2005, 63: 59-63.
[11] Corovic N, Durakovic Z, Misigoj-Durakovic M. Dispersion of the corrected QT and JT interval in the electrocardiogram of alcoholic patients. Alcohol Clin Exp Res, 2006, 30: 150-154.
[12] Boczek NJ, Miller EM, Ye D, et al. Novel Timothy Syndrome Mutation Leading to Increase in CACNA1C Window Current. Heart Rhythm, 2015, 12: 211-219.
[13] Ming Z, Nordin C, Aronson RS. Role of L-type calcium channel window current in generating current-induced early after depolarizations. J Cardiovasc Electrophysiol, 1994, 5: 323-334.
[14] Bebarova M, Matejovic P, Pasek M, et al. Effect of ethanol on action potential and ionic membrane currents in rat ventricular myocytes. Acta Physiol, 2010, 200: 301-314.
[15] 郭繼鴻. 中國心臟性猝死現狀與防治. 中國循環雜志, 2013, 28: 323-326.
The Electrophysiological Mechanism of QT Prolongation in Experimental Mice With Alcoholic Cardiomyopathy
JIANG Yu, HAN Zhong-lin, CAO Ke-jiang, WANG Dao-wu.
Department of Cardiology, The First Affiliated Hospital of Nanjing Medical University, Nanjing (210029), Jiangsu, China
Objective: To investigate the electrophysiological mechanism of QT prolongation in experimental mice with alcoholic cardiomyopathy (ACM).
Alcoholic cardiomyopathy; QT interval; Patch clamp; Action potential duration, L-type calcium current
2014-12-19)
(編輯:朱柳媛)
國家自然科學基金面上項目(81170159);江蘇省六大人才高峰資助項目(2012-WS-018)
210029 江蘇省南京市,南京醫科大學第一附屬醫院 心血管內科
江宇 碩士研究生 主要從事心臟起搏與電生理相關研究 Email: 328450715@qq.com 通訊作者:汪道武 Email: david37212@hotmail.com
R54
A
1000-3614(2015)04-0374-05
10.3969/j.issn.1000-3614.2015.04.018

