抗心律失常肽10對柯薩奇B3病毒感染小鼠原代心肌細胞縫隙連接蛋白43的影響*
伍瓊,楊波
抗心律失常肽10對柯薩奇B3病毒感染小鼠原代心肌細胞縫隙連接蛋白43的影響*
伍瓊,楊波
目的: 建立原代心肌細胞柯薩奇B3病毒(CVB3)感染性病毒性心肌炎的模型,使用抗心律失常肽10(AAP10)對該疾病模型進行干預,觀察其對小鼠原代心肌細胞及縫隙連接蛋白43(Cx43)的影響。
方法: 選取出生1~3天的BALB/C小鼠10只進行原代心肌細胞培養,分別用不同劑量的抗心律失常肽10的培養液進行干預100倍組織細胞培養半數感染量(TCID50)CVB3感染的心肌細胞,將原代小鼠心肌細胞分為細胞對照組、病毒對照組、低劑量干預組、高劑量干預組4組,每組8孔,通過蛋白免疫印跡法測定細胞縫隙連接蛋白43的表達水平。
結果:縫隙連接蛋白43相對表達水平低劑量干預組 [(71.46±2.69)%]和高劑量干預組[(83.56±3.74)%]明顯高于病毒對照組[(44.92±4.49)%],隨著干預劑量增加,其縫隙連接蛋白43相對表達水平進一步顯著增加,差異均有統計學意義(P均<0.001)。
結論:抗心律失常肽10可保護心肌細胞,增加縫隙連接蛋白43的表達,減少病毒性心肌炎的心肌損害。
抗心律失常肽;病毒性心肌炎;縫隙連接蛋白;原代心肌細胞
Methods: A total of 10 BALB/C mice at the age of 1-3 days were used for primary myocardial cell culture, the cells were infected by 100 times of TCID50 CVB3 and then, cultured with different doses of AAP10. The cells were divided into 4 groups: Cell control group, Virus control group, Low dose APP10 group and High dose APP 10 group. The protein expression of Cx43 was examined by Western blot analysis.
Results: The protein expression of Cx43 in Low dose APP10 group (71.46 ± 2.69) % and High dose APP 10 group (83.56 ± 3.74) % were obviously higher than that in Virus control group (44.92 ± 4.49) %, and with the higher APP 10 intervention, the protein expression of Cx43 increased accordingly, all P<0.01.
Conclusion: The anti-arrhythmic peptide 10 may protect myocardial cells, increase Cx43 expression and reduce myocardial injury from viral myocarditis in experimental mice.
(Chinese Circulation Journal, 2015,30:379.)
病毒性心肌炎是心血管臨床上的常見病、多發病,有25%~30%的心肌炎患者發展為擴張型心肌病,部分患者常伴有嚴重的室性心律失常,直接危及生命。基礎研究發現心律失常與心肌細胞間電化學耦聯密切相關,縫隙連接蛋白43(Connexin 43,Cx43)是存在于相鄰細胞間傳導通訊的特殊膜通道結構,對維持心臟細胞間的正常電化學信號耦聯具有重要意義[1]。近年來發現抗心律失常肽(antiarrhythmic peptide 10,AAP10)可增加心肌細胞電耦聯和代謝耦聯[2],可能成為通過調控縫隙連接蛋白43來治療病毒性心肌炎患者心律失常的新藥。本文通過制作小鼠原代心肌細胞柯薩奇B3病毒(coxsackievirus B3,CVB3)感染性病毒心肌炎的體外模型,觀察抗心律失常肽10對縫隙連接蛋白43的影響。
1 材料與方法
1.1 材料
實驗時間:2012-10至2013-12。主要儀器:二氧化碳細胞培養箱(MODEL2300 SHELAB美國)、倒置顯微鏡(NikonT300,日本)、臺式高速低溫離心機(TGL-16C,上海安亭科學儀器廠)、酶聯免疫檢測儀(北京元業伯樂科技發展有限公司)、生物安全柜(Costar公司,美國)、電子天平(上海精密科學儀器公司天平儀器廠)、恒溫磁力攪拌器(上海越眾儀器設備有限公司)、Bio-Rad ChemiDocXRS化學發光成像系統(上海伯樂生命醫學產品有限公司)等。主要藥物與試劑:抗心律失常肽10(杭州中肽生化有限公司),胰蛋白酶(HyClone 公司,美國)、II型膠原酶(上海世澤生物科技有限公司),DMEM培養液(HyClone公司,美國)、胎牛血清(HyClone公司,美國),臺盼藍(Sigma公司,美國),磷酸鹽緩沖溶液(PBS)(Sigma公司,美國),5-溴脫氧尿嘧啶核苷(5-Brdu)(Sigma公司,美國),D-Hank′s平衡液(HyClone公司,美國),小鼠抗總縫隙連接蛋白43單克隆抗體(百奇,貨號AN1083), 羊抗兔IgG-HRP (博仕德,貨號:BA1054),活細胞計數試劑盒(CCK8,東仁化學科技有限公司),心肌肌鈣蛋白I、肌酸磷酸激酶以及乳酸脫氫酶酶聯免疫吸附試劑盒(上海博蘊生物科技有限公司)。實驗動物及細胞:出生第2天的巴比塞(BALB/C)小鼠,雌雄不拘(武漢大學動物中心)、人宮頸癌細胞(Hela細胞,CTCC)。實驗病毒 :CVB3(武漢大學病毒研究所)。
1.2 方法
小鼠原代心肌細胞培養[3-5]:取出生第2天的BALB/C小鼠10只,無菌條件下開胸取心尖部,用預冷的D-Hank′s 平衡液洗滌3遍,將心臟剪成約1 mm × 1 mm × 1 mm大小;用0.125%的胰蛋白酶及0.1%的II型膠原酶,在37℃消化心肌組織消化7~8次,每次5~8 min不等,棄去第一次消化的上清液,收集第2次及以后的上清液,加10%胎牛血清終止消化,離心1 000 r/min,8 min,棄上清液,加入含10%胎牛血清pH調至7.3~7.4的DMEM培養液恒溫磁力攪拌器中輕輕吹打,制成細胞懸液,再接種到培養瓶中,置5% CO237℃培養箱培養60 min后,采用差速貼壁分離技術,吸收培養瓶中的懸液,將細胞濃度調至為5.0×105細胞/ml,以單層細胞分別接種于48孔及96孔培養板中繼續培養,前面兩天加入0.1 mmol/L的5-溴脫氧尿嘧啶核苷,以后48 h換液一次。
原代心肌細胞CVB3病毒的擴增、組織細胞培養半數感染量(TCID50)的測定及心肌細胞的感染[6]:將DMEM培養液加入傳代的Hela細胞中,置于5% CO237℃細胞培養箱中常規培養,待出現明顯的細胞病變后于-80℃/37℃反復凍融3次,收集病毒液。將正常傳代培養的Hela細胞經0.125%的胰蛋白酶消化后,加入含5%胎牛血清的DMEM培養液,將細胞吹散混勻,分別接種至96孔的聚苯乙烯培養板中(0.1 ml/孔),再將先前收獲的CVB3病毒液用無血清DMEM培養液做10倍連續稀釋后接種Hela細胞,測定TCID50,用Reed-Muench法計算數值。距離比例=(高于50%病變率的百分數-50%)/(高于50%病變率的百分數-低于50%病變率的百分數)。lg TCID50=距離比例×稀釋度對數之間的差+高于50%病變率的稀釋度的對數。感染CVB3后的心肌細胞病變以細胞受累程度為標準:心肌細胞病變表示法:(±)<25% ,( + ) 25%~50%,(++)51%~75%, (+++)>75%,(++++)近100%,正式實驗選用100 TCID50作為接種濃度。
抗心律失常肽10對心肌細胞的毒性測定[7]:分析天平稱量抗心律失常肽10質量,溶解于一定量培養液中,配成3~30 μg/ml 的濃度梯度,0.22 μm 濾膜過濾備用,在96孔板中每孔加入5×104的原代小鼠心肌細胞,培養24 h,細胞長成單層后,加入0.1 ml終濃度分別為0 μg/ml、5 μg/ml、8 μg/ml、10 μg/ml、15 μg/ml、20 μg/ml、25 μg/ml、30 μg/ml的抗
心律失常肽10培養液,每種濃度重復8孔,置5% CO237℃培養箱繼續培養12 h、24 h、48 h、72 h,在倒置顯微鏡下觀察細胞形態,生長狀態,用活細胞計數試劑盒說明書方法測各孔在450 nm波長下的吸光度(A)值[8],計算心肌細胞活性,繪制細胞活性時間曲線圖[9],取出現細胞活性達到最高時的藥物濃度作為高劑量干預組的終濃度,終濃度的一半作為低劑量干預組終濃度。
抗心律失常肽10干預:將原代小鼠心肌細胞分為4組,每組8孔,分別為:細胞對照組、病毒對照組、低劑量干預組、高劑量干預組。48孔板中每孔加入1×105的原代小鼠心肌細胞,培養48 h。細胞長成單層后,除細胞對照組外,其余3組給予0.1 ml/孔的含100 TCID50的CVB3的維持液,低劑量干預組及高劑量干預組分別再給予0.1 ml/孔含規定終濃度抗心律失常肽10的維持液;置5% CO237℃培養箱繼續培養24 h。
心肌細胞形態,搏動率及存活率的觀察[2]:在40倍倒置顯微鏡下觀察4組心肌細胞的生長狀態、形態變化。取相同量的0.4%臺盼藍液與細胞懸液混勻后再取適量混合液滴于細胞計數板上,在20倍視野下計數4個大格中的細胞總數及未染成藍色的桿狀活細胞數,觀察細胞搏動數,計數10次,取平均值計算細胞存活率及搏動率。細胞存活率(%)=活細胞數/細胞總數×100%;細胞搏動率(%)=搏動細胞數/細胞總數×100%。
縫隙連接蛋白43的蛋白免疫印跡法測定[10]:將培養瓶中的培養基棄去,加入3 ml預冷的磷酸鹽緩沖溶液洗滌細胞,每瓶細胞加入1 ml裂解液,于冰上放置10 min裂解細胞,4℃,以12 000 r/min離心10 min,吸取上清液分裝至0.2 ml PCR管,于-20℃保存待用。制作12%的分離膠及5%的積層膠,取20μl蛋白樣品恒壓電泳,十二烷基硫酸鈉(SDS)聚丙烯酰胺電泳完畢后,去掉積層膠,硝酸纖維素膜轉膜1 h,用蒸餾水漂洗,加麗春紅染色液染色數分鐘,觀察轉膜效果,再將硝酸纖維素膜轉入封阻液(50 mM Tris·Cl,150 mM NaCl,pH 7.4,5%脫脂奶粉)中室溫封阻1 h,加入抗總縫隙連接蛋白43一抗及IgG-HRP二抗 室溫反應1 h,洗滌液洗滌5次,每次5 min,每張膜加入1 ml左右 SuperSignal West Pico 化學熒光底物反應5 min。使用Bio-Rad ChemiDocXRS化學發光成像系統觀察膜上的化學信號,拍照。
心肌酶學測定[11]:待細胞培養24 h后,取各組細胞上清液用酶聯免疫吸附法測定心肌肌鈣蛋白I(cTnI)、肌酸激酶(CK)、乳酸脫氫酶(LDH)。
統計學處理:采用SPSS17.0統計軟件分析,正態分布計量資料采用均數±標準差(x±s)表示,各組均數比較采用方差分析及兩兩比較,兩組均數比較采用獨立樣本t檢驗,P<0.05為差異有統計學意義。
2 結果
2.1 抗心律失常肽10對心肌細胞的活性測定
顯微鏡鏡下觀測到各抗心律失常肽10濃度心肌細胞保持貼壁生長,細胞形態完整,其收縮力度隨作用時間的增加略有增強,從藥物時間曲線可以看出,20 μg/ml 抗心律失常肽10的心肌細胞活性持續高于其他濃度的抗心律失常肽10,隨觀察時間的延長(72 h),與30 μg /ml 抗心律失常肽10相比,其心肌細胞活性差異有統計學意義(P<0.01),見表1、圖1。根據檢測結果選擇20 μg /ml作為高劑量藥物干預組的終濃度,選擇10 μg/ml作為低劑量干預組的終濃度(因20 μg/ml以下濃度的抗心律失常肽10對心肌細胞影響無顯著性差異,本組采用10 μg/ ml作為低劑量干預組的終濃度)。
表1 抗心律失常肽10對心肌細胞的活性測定

表1 抗心律失常肽10對心肌細胞的活性測定
注:與30μ g/ml 抗心律失常肽10相比*P<0.01
?
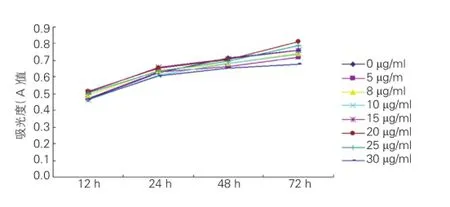
圖1 抗心律失常肽10作用后心肌細胞活性時間變化曲線
2.2 抗心律失常肽10干預感染心肌細胞后心肌細胞存活率、心肌細胞搏動率及縫隙連接蛋白43表達水平的測定
各組孔內細胞培養24 h后顯微鏡鏡下觀測到細胞對照組心肌細胞形態完整、搏動正常,病毒對照組心肌細胞大部分圓縮、脫落,其中部分心肌細胞明顯變形,搏動減弱甚至停止,懸浮在培養液中,高劑量干預組心肌細胞形態基本完整并貼壁生長,低劑量干預組心肌細胞少數發生變形,其壞死程度低于病毒對照組。圖2

圖2 各組心肌細胞在培養板孔內進行細胞培養24 h后的心肌細胞形態
低劑量干預組和高劑量干預組心肌細胞存活率及搏動率均明顯高于病毒對照組(P<0.001),隨著干預劑量增加,兩個干預組的心肌細胞存活率及搏動率均進一步顯著增加(P<0.001),差異均有統計學意義。表2
表2 各組心肌細胞總數、搏動細胞數、細胞搏動率、活細胞數以及細胞存活率的測定

表2 各組心肌細胞總數、搏動細胞數、細胞搏動率、活細胞數以及細胞存活率的測定
注:與病毒對照組相比*P<0.001;與低劑量干預組相對△P<0.001
?
低劑量干預組和高劑量干預組縫隙連接蛋白43相對表達水平明顯高于病毒對照組(P<0.001),隨著干預劑量增加,兩個干預組縫隙連接蛋白43相對表達水平進一步顯著增加(P<0.001),差異均有統計學意義。表3、圖3
表3 各組心肌細胞縫隙連接蛋白43表達水平的測定

表3 各組心肌細胞縫隙連接蛋白43表達水平的測定
注:與病毒對照組相比*P<0.001;與低劑量干預組相比△P<0.001
?

圖3 心肌細胞縫隙連接蛋白43表達量的蛋白免疫印跡法測定
2.3 心肌酶學測定
干預24 h后,高劑量干預組與低劑量干預組肌鈣蛋白I、肌酸激酶、乳酸脫氫酶濃度均低于病毒對照組,高劑量干預組亦低于低劑量干預組,差異均有統計學意義(P <0.05~0.001)。表4
表4 各組心肌酶學測定

表4 各組心肌酶學測定
注:與病毒對照組相比*P<0.05**P<0.01***P<0.001;與低劑量干預組相比△P<0.05△△△P<0.001
?
3 討論
抗心律失常肽10是人工合成的具有生物學活性的多肽,在正常人體中也存在天然的抗心律失常肽,主要分布在心房組織中,它作為一種激素在體內發揮效應,研究表明血液中抗心律失常肽的減少可促使心力衰竭的發生,誘發心律失常,而肺心病患者可能因為心肺功能下降,內環境缺氧而導致組織器官對抗心律失常肽的分泌減少,破壞增加,從而大大降低其在體內的含量[12]。實際上風濕性心臟病,冠心病患者也發現體內抗心律失常肽的水平有明顯減少,這類有嚴重心臟疾病的患者均可因體內天然的抗心律失常肽濃度下降而出現更為嚴重的心律失常,甚至猝死的發生。因此,目前有相當一部分研究觀察通過外源性人工合成抗心律失常肽10的補充,能否有效抵抗心律失常及猝死的發生。近幾年,在動物水平的實驗中,已經證實抗心律失常肽10能有效對抗急性缺血壞死、缺血再灌注以及陳舊性心肌梗死等相關的
器質性缺血性心臟病所引發的室性心律失常,而對于電解質紊亂所誘發的室性心律失常具有可逆轉效應,對于心房顫動的控制具有比較肯定的治療作用[13]。
縫隙連接蛋白是存在于心肌細胞間具有傳導功能的膜通道蛋白質,參與心肌細胞離子流介導的動作電位,保持心臟興奮沖動的快速傳播,維持電活動與機械收縮,舒張功能的同步性,還可介導第二信使[14,15],影響心肌組織的分化、生長和凋亡,因此其結構和功能的改變均可影響心臟的電活動。研究發現縫隙連接蛋白分為縫隙連接蛋白40、縫隙連接蛋白45和縫隙連接蛋白43,心室肌的膜通道蛋白主要由縫隙連接蛋白43構成,在發生急性心肌缺血時,缺血局部心肌傳導速度不均一,傳導受阻部分的縫隙連接蛋白43有嚴重降解,而在瓣膜性心臟病或高血壓心臟病引發的心力衰竭時,心臟能量供應障礙,心肌纖維化引發重構,早期縫隙連接蛋白43增加,晚期減少伴隨分布異常,同樣在心房顫動動物的實驗中,心房肌中縫隙連接蛋白43表達明顯增加,射頻消融7天后縫隙連接蛋白43顯著下降,而纖維化區域的縫隙鏈接蛋白43數量再次增多并伴有分布異常[16]。由于縫隙連接蛋白與抗心律失常肽10兩者在體內的分布及功能都存在相似性,因此有人通過給予外源性抗心律失常肽10后觀察心肌細胞的傳導以及與縫隙連接蛋白43的關系來探討彼此間的關聯和作用機制。
國內的數項研究發現,在給合并有心律失常的陳舊性心肌梗死兔腹腔注射外源性的抗心律失常肽10后,心律失常的發生明顯減少,同時檢測到心肌組織中縫隙連接蛋白43表達增加,在合并使用了胺碘酮后作用增強[17]。同樣在乳鼠進行原代心肌培養并急性缺氧誘導的實驗中,劃痕標記染料示蹤技術發現給予了抗心律失常肽10培養基的心肌細胞傳導范圍有所增加,而縫隙連接蛋白43表達增多[10]。國外有研究也報道抗心律失常肽10可增加縫隙鏈接蛋白43的表達來調控心律失常的發生[18]。
本文通過建立小鼠原代心肌細胞病毒心肌炎的體外模型,觀察到采用CVB3感染心肌細胞后,通過引起心肌細胞凋亡及細胞內鈣調節失衡,導致細胞損傷壞死明顯[19],而加入了抗心律失常肽10后其損傷程度減輕,其存活率、搏動率增高,肌鈣蛋白I降低,同時測得縫隙連接蛋白43表達量增加,與病毒對照組比有明顯差異,抗心律失常肽10本身對于正常心肌細胞無毒性作用,且有增加心肌細胞活性的功能,可能與促進縫隙連接蛋白43表達增加及代謝增強有關,而過量的抗心律失常肽10可能引起心肌細胞生長受限。抗心律失常肽10作為一種新的保護心肌及抗心律失常藥物,能有效降低目前臨床上其他抗心律失常藥物的致心律失常副作用[20],同時為病毒性心肌炎臨床治療開拓新的思路。
[1] 黃強輝, 胡建新. 心肌縫隙鏈接蛋白43與心血管疾病的關系. 嶺南心血管病雜志, 2012, 18: 81-84.
[2] 王鳳梅, 王帆, 張爍. 縫隙鏈接蛋白重構與心律失常. 心血管康復醫學雜志, 2013, 22: 626-629.
[3] 杜廣勝, 文淵, 馬業新. BALB/c小鼠乳鼠心肌細胞的原代培養.農墾醫學, 2011, 33: 31-33.
[4] 馬芳芳, 沈曉麗, 林立芳, 等. 新生大鼠心肌細胞的原代培養. 心血管康復醫學雜志, 2009, 18: 125-128.
[5] 張曉京, 張建棟, 來麗娜, 等. SD乳鼠原代心肌細胞培養方法的改進. 長治醫學院學報, 2012, 26: 171-173.
[6] 朱理安, 關瑞錦, 胡錫衷, 等. 病毒性心肌炎細胞感染模型的建立.福建醫科大學學報, 2000, 34: 224-227.
[7] 張立博, 汪培華. 抗心律失常肽與心肌細胞間耦聯. 中國心血管雜志, 2000, 5: 59-62.
[8] 張嫻, 王興岡, 解玉泉, 等. 髓系觸發受體在柯薩奇病毒B3導致的炎癥反應及心肌細胞損傷中作用的實驗研究. 中華心血管病雜志, 2012, 40: 411-415.
[9] 石朔, 王利華, 鍋睿, 等. 氧化鈷誘導心肌細胞化學性缺氧HIF-12表達的研究. 診斷學理論與實踐, 2013, 12: 532-536.
[10] 王榮, 張存泰, 劉念, 等. 抗心律失常肽對乳鼠心肌細胞急性缺氧時細胞間傳導的影響. 華中科技大學學報(醫學版), 2007, 36: 574-577.
[11] 樊理華, 韓星, 盧向紅, 等. 阿霉素對大鼠原代心肌細胞凋亡的影響. 中華全科醫學, 2013, 11: 1167-1168.
[12] Hagen A, Dietze A, Dhein S, et al. Human cardiac gap-junction coupling: effects of antiarrhythmic peptide AAP10. Cardiovasc Res, 2009, 83: 405-415.
[13] Jozwiak J, Dhein S. Local effects and mechanisms of antiarrhythmic peptide AAP10 in acute regional myocardial ischemia: electrophysiological and molecular findings. Naunyn Schmiedebergs Arch Pharmacol, 2008, 378: 459-470.
[14] Fong JT, Kells RM, Falk MM, et al. Two tyrosine-based sorting signals in the Cx43 C-terminus cooperate to mediate gap junction endocytosis. Mol Biol Cell, 2013, 24: 2834-2848.
[15] Waza AA, Andrabi K, Hussain MU. Protein kinase C (PKC) mediated interaction between conexin43 (Cx43) and K(+)(ATP) channel subunit(Kir6. 1) in cardiomyocyte mitochondria: Implications in cytoprotection against hypoxia induced cell apoptosis. Cell Signal, 2014, 26: 1909-1917.
[16] Wang N, De Vuyst E, Ponsaerts R, et al. Selective inhibition of Cx43 hemichannels by Gap19 and its impact on myocardial ischemia/ reperfusion injury. Basic Res Cardiol, 2013, 108: 309.
[17] 李連東, 張存泰, 阮磊, 等. 胺碘酮與抗心律失常肽合用對陳舊性心肌梗死兔心縫隙鏈接蛋白43和室性心律失常誘發率的影響. 中華心血管病雜志, 2010, 38: 1102-1105.
[18] Easton JA, Petersen JS, Martin PE, et al. The anti-arrhythmic peptide AAP10 remodels Cx43 and Cx40 expression and function. Naunyn Schmiedebergs Arch Pharmacol, 2009, 380: 11-24.
[19] 胡秀芬, 王宏偉, 魯維偉, 等. 柯薩奇病毒B3引起心肌細胞鈣超載及細胞凋亡的研究. 中國循環雜志, 2001, 16: 299-302.
[20] 張海澄. 心血管急癥救治(10)抗心律失常藥物的合理應用. 中國循環雜志, 2014, 29: 567-569.
Effect of Anti-arrhythmic Peptide 10 on Connexin Expression in Mice Primary Cardiac Myocyte Infected by Coxsackie Virus B3
WU Qiong, YANG Bo.
Department of Cardiology, The Fifth Hospital of Wuhan City, Mercy Hospital of Wuhan University, Wuhan (430000), Hubei, China
Objective: To observe the effect of anti-arrhythmic peptide 10 (AAP10) on connexin 43 (Cx43) expression in mice primary myocardial cell infected with coxsackie virus B3 (CVB3) by establishing mice viral myocarditis model.
Anti-arrhythmic peptide; Viral myocarditis; Connexin; Primary cardiac myocyte
2014-08-02)
(編輯:漆利萍)
武漢市漢陽區軟科技計劃項目
430000 湖北省,武漢市第五醫院 武漢大學廣慈醫院 心血管內科(伍瓊); 武漢大學第一臨床學院 武漢大學人民醫院(楊波)
伍瓊 博士研究生 主要從事心電生理及心臟結構病學相關研究 Email:309325285@qq.com 通訊作者:楊波 Email:yybb1234@qq.com
R542.2
A
1000-3614(2015)04-0379-05
10.3969/j.issn.1000-3614.2015.04.019

