慢性應激對心臟交感神經和室性心律失常易感性的影響*
孫麗芳,楊波,石少波,劉韜,阮兵,梁錦軍
基礎與實驗研究
慢性應激對心臟交感神經和室性心律失常易感性的影響*
孫麗芳,楊波,石少波,劉韜,阮兵,梁錦軍
目的:探討慢性應激對心臟交感神經和室性心律失常易感性的影響。
方法:將30只SD大鼠隨機分為對照組和慢性應激組,每組15只。對照組正常條件下飼養,慢性應激組給予慢性不可控應激刺激4周,用曠場試驗和糖水試驗評估行為學,用短陣快速刺激(Burst刺激)評估麻醉狀態下室性心律失常誘發率,采用免疫組化法檢測心臟交感神經重構相關指標酪氨酸羥化酶的變化。
結果:造模后,慢性應激組較對照組糖水偏愛比及曠場實驗指標顯著下降,差異有統計學意義(P<0.05)。麻醉狀態下,慢性應激組血壓與對照組比差別無統計學意義(P>0.05),心率較對照組快(P<0.05),室性心律失常誘發率較對照組高 (P<0.05)。心肌Masson染色顯示:慢性應激組心室肌間質膠原容積分數(3.94±1.81)%高于對照組(2.71±1.64)%,但差異無統計學意義(P>0.05)。免疫組化結果:慢性應激組心室肌酪氨酸羥化酶含量(1397.8±268.8)μm2/mm2較對照組(995.0±232.3 )μm2/mm2增多,差異有統計學意義(P<0.05)。
結論:慢性應激能增加室性心律失常的易感性,心臟交感神經重構可能是其重要機制。
慢性應激;室性心律失常;交感重塑
Methods: A total of 30 SD rats were randomly assigned into two groups: Control group, the rats were fed with normal condition and Chronic stress group, the rats were fed with unpredictable chronic stimulus program. n=15 in each group and all animals were treated for 4 weeks. The behavior of rats was assessed by open field test and sucrose intake test, the susceptibility of ventricular arrhythmia was measured by Burst stimulus program under narcosis condition, and the sign of cardiac sympathetic nerve reconstruction, tyrosine hydroxylase content was examined by immunohistochemistry.
Results: Compared with Control group, Chronic stress group had decreased ratio of sucrose favorite/open field test, P<0.05 and increased susceptibility of ventricular arrhythmia, P<0.05. Masson staining showed that the ventricular collagen score was similar between 2 groups, P>0.05. Immunohistochemistry presented that Chronic stress group had much higher tyrosine hydroxylase content (1397.8 ± 268.8) um2/mm2than Control group (995 ± 232.3) um2/mm2, P<0.05.
Conclusion: Chronic stress may increase the susceptibility of ventricular arrhythmia in experimental rats, and the cardiac sympathetic nerve reconstruction might be an important mechanism.
(Chinese Circulation Journal, 2015,30:270.)
應激與心血管系統功能關系密切,嚴重的精神刺激損害心臟會導致應激性心肌病,而慢性應激或情緒障礙是心臟病的獨立危險因素[1]。心血管疾病患者常常伴有抑郁、焦慮或者憤怒等情緒,處于身體和心理應激狀態,慢性應激不僅嚴重降低患者的生活質量,而且顯著增加遠期心血管事件發生率[2,3]。研究表明抑郁使心血管疾病患者發生急性心血管事件的風險增加50%,盡管在校正了共存疾病及左心室射血分數后,風險仍然有顯著增加[1]。HUNT2研究顯示伴有抑郁或焦慮性情緒應激的心肌梗死患者,其心肌梗死再發率顯著增高[4]。上述研究提示慢性情緒應激可導致心血管疾病,增加心血管事件發生率。然而其具體病理機制尚未明確,可能與心臟神經重塑所致室性心律失常風險增加有關。為此,本研究通過4周慢性不可預見性慢性應激程序刺激動物,建立以抑郁為主要表現的慢性應激模型,探討慢性應激刺激對心臟自主神經系統的影響,試圖驗證上述假設。
1 材料與方法
實驗動物分組:本研究時間為2014-02至2014-07。將30只SD大鼠(180~220 g,購于武漢大學實驗動物中心,飼養于SPF級實驗室)隨機分為對照組(n=15)和慢性應激組(n=15)。實驗開始前在清潔級實驗室適應1周。
慢性應激刺激:慢性應激模型制作參考Gronli等[5]的方法。慢性應激組15只大鼠禁水24 h,潮濕墊料24 h,行為限制2 h,夜間頻閃燈8 h,禁食24 h,鼠籠傾斜45度24 h,冰水浴5 min。將上述7種刺激方法隨機安排到28 d內,每日1種刺激,同種刺激不連續出現,以使動物不可預料刺激的發生。刺激方案如下(表1):
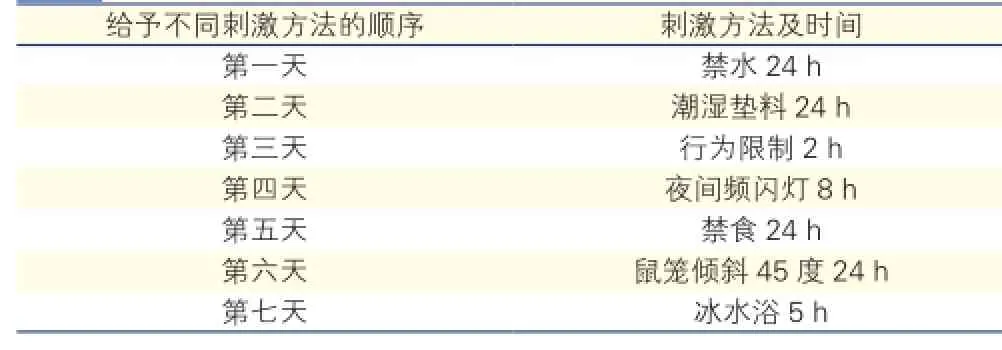
表1 慢性應激組15只大鼠刺激方案
行為學評價:采用糖水實驗[6]和曠場實驗[7]進行行為學評價。糖水實驗:大鼠單籠飼養并編號,實驗開始前給大鼠進行糖水適應性訓練,前12 h均給1瓶1%蔗糖水和1瓶純水,后12 h交換兩瓶水的位置,以防大鼠對飲水形成位置偏好。然后禁水禁食24 h,再給每只大鼠已稱重的1%蔗糖水和純水各1瓶,記錄1h后每只大鼠每瓶水的消耗量。計算糖水偏愛百分比[糖水偏愛百分比=糖水消耗量/(糖水消耗量+純水消耗量)×100%]。曠場實驗:曠場大小為120 cm×90 cm×35 cm,試驗在早9:00進行。將大鼠置于曠場中心內,使用動物行為自動跟蹤系統(Ethovision3.0)記錄并分析大鼠在曠場內10 min的行為:大鼠10 min內的總運動距離,直立次數(兩前爪騰空或攀附曠場壁)。單只獨立測試,每次測試完成后,均要將糞便清理干凈。
心電圖和血壓監測:動物在麻醉[鹽酸戊巴比妥鈉,40 mg/(ml·kg),腹腔注射,美國sigma公司]10 min 后, 游離右側頸總動脈,遠心端結扎,近心端插入動脈導管,記錄平均動脈壓。同時記錄體表Ⅱ導聯心電圖(PowerLab放大器,澳大利亞AD公司)10 min,運用Chart 7.0軟件分析血壓和心率。
室性心律失常誘發:在麻醉狀態下,進行氣管插管,開胸暴露心臟,行短陣快速脈沖刺激(Burst刺激),誘發室性心律失常。Burst刺激程序:將刺激電極置于右心室流出道,行每陣2 s的超速刺激,刺激周長為20 ms,電壓為2倍的閾電位。室性心律失常定義為大于2 s的心室快速激動,若未誘發,Burst刺激重復三次。根據室性心律失常的誘發率評價室性心律失常的易感性。本部分實驗在10 min內完成。
Masson染色及免疫組化:在電生理實驗完成后,迅速取出心臟,將心肌組織固定,脫水,石蠟包埋,每個心肌組織制備5張連續切片,依次滴加Masson復合染色液,磷鉬酸,苯胺藍,最后滴加分化液進行分化。免疫組化一抗為抗小鼠TH抗體(1:200,美國sigma公司),二抗為通用SP抗體(美國sigma公司),參照試劑盒提供的步驟進行染色。使用Image-Pro Plus 6.0軟件測定心室肌間質膠原容積分數(膠原面積/全視野組織面
積),比較兩組膠原的分布排列及纖維化的面積。使用Image-Pro plus6.0軟件對圖像進行量化分析,計算陽性纖維或結構在選區中表達量。采用免疫組化法檢測心臟交感神經重構相關指標酪氨酸羥化酶的變化。
2 結果
2.1 兩組行為學實驗結果比較
在造模前,評估兩組大鼠糖水偏愛比及曠場實驗指標,差異均無統計學意義(P均>0.05)。造模后,顯示慢性應激組較對照組糖水偏愛比及曠場實驗指標顯著下降,差異均有統計學意義(P均<0.05)。表2
2.2 兩組造模后血壓、心率、室性心律失常誘發率比較
麻醉狀態下,慢性應激組與對照組比血壓差別無統計學意義(P>0.05);心率較對照組快(P<0.05),室性心律失常誘發率較對照組高(P<0.05),差異均有統計學意義。表3
表2 兩組行為學實驗結果比較
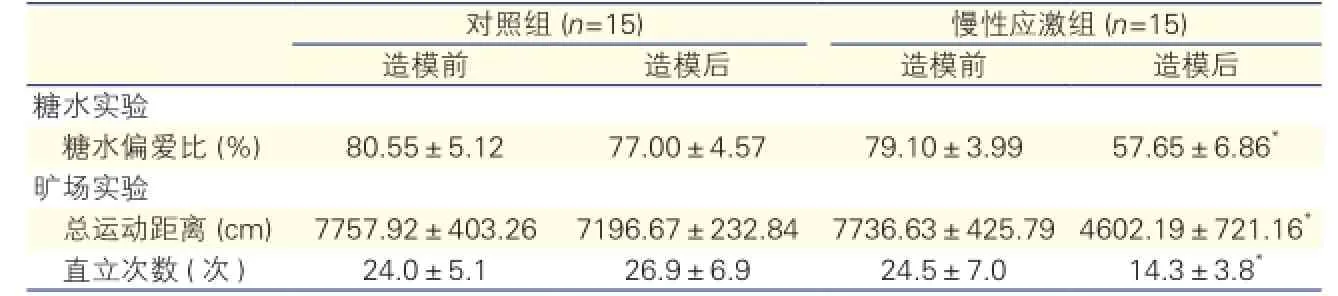
表2 兩組行為學實驗結果比較
注:與對照組造模后比較*P<0.05
?
表3 兩組造模后血壓、心率、室性心律失常誘發率比較
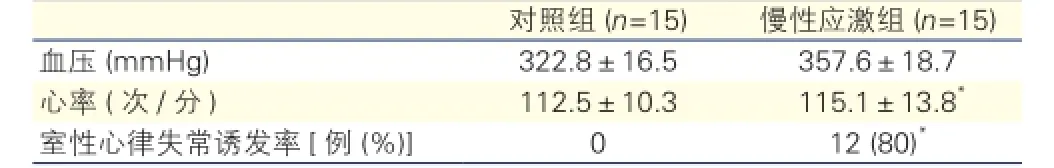
表3 兩組造模后血壓、心率、室性心律失常誘發率比較
注:與對照組比較*P<0.05。1 mmHg=0.133 kPa
?
2.3 兩組Masson染色及免疫組化結果
心肌Masson染色顯示:對照組心室肌間質空隙較小,少量膠原沉積;慢性應激組心室肌間質空隙大,心肌纖維排列紊亂,膠原沉積明顯(圖1);慢性應激組心室肌間質膠原容積分數(3.94±1.81)%高于對照組(2.71±1.64)%,但差異無統計學意義(P>0.05)。免疫組化結果:TH抗體表達量慢性應激組較對照組增多(圖2);慢性應激組心室肌酪氨酸羥化酶含量(1 397.8±268.8)μm2/mm2較對照組(995.0±232.3 )μm2/mm2增多,差異有統計學意義(P<0.05)。

圖1 兩組心室肌切片Masson染色圖片(×400)
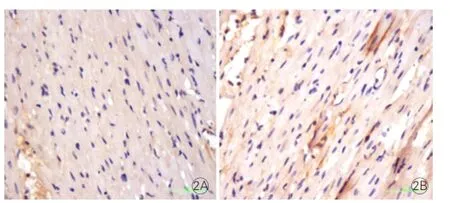
圖2 兩組心室肌切片免疫組化圖片(×400)
3 討論
盡管流行病學資料顯示長期慢性應激的存在會促進心臟疾病的發生,但其具體的致病機制并不十分清楚。動物實驗顯示慢性應激可導致心率變異性下降,心肌纖維化加重,心臟傳導系統受損,從而促進心律失常的發生[8]。臨床發現存在情緒應激的患者,多伴有心臟交感神經功能亢進[9]。心臟交感神經密度增加則促進了室性心律失常的發生[10]。焦慮抑郁情緒可能加重炎癥反應及內皮功能損害[11],而抗抑郁藥物能夠減少室性心律失常的發生[12]。為此我們擬通過慢性不可預見性溫和應激程序建立模型,采用心臟電生理及免疫組化等手段探討慢性應激與心律失常相關性及其可能存在的機制。
研究模型參照Willner等的研究,糖水偏愛比的下降提示快感缺乏,而曠場相關指標的下降顯示自發活動減少。本實驗發現慢性應激組大鼠糖水偏愛比及曠場實驗指標均顯著降低(P<0.01),表明本實驗慢性應激性刺激具有可行性、可靠性、有效性[6, 13-15]。
交感神經興奮最直接的反應是心率增快,而血壓更多受心輸出量、外周血管阻力、內分泌影響。本實驗在麻醉狀態下慢性應激組心率較對照組加快(P<0.01),血壓無明顯差別,室性心律失常誘發率顯著升高(P<0.01),提示慢性應激組大鼠存在交感神經功能亢進。
交感神經末梢與心肌形成突觸聯系,去甲腎上腺素是其釋放的主要神經遞質之一,交感神經高支配現象的發生可誘導心肌對兒茶酚胺產生超敏現象,使心肌復極離散度增加,構成觸發、啟動,甚至維持惡性心律失常的重要機制[16]。
另有研究發現心臟交感神經增生使心室肌瞬時外向鉀電流通道蛋白的表達減少,電流密度下降,從而引起復極延緩,導致心律失常易感性增加[17]。
酪氨酸羥化酶是兒茶酚胺合成的限速酶,本身具有不會接受吲哚的衍生物的性質,因此具有高度的特異性,可以作為交感神經特異性標志物,慢性應激大鼠心室肌中酪氨酸酶表達量的升高,提示心室交感神經密度增加[18]。從而印證了我們的推論:慢性應激通過影響心臟交感神經重構而增加了室性心律失常的易感性。
總而言之,越來越多的研究表明長期慢性應激已成為心血管疾病的發生、發展重要因素之一。而慢性應激引起交感神經重構的機制尚需更深層次的研究。對于心血管疾病患者,如何有效預防及治療慢性情緒應激也應引起我們的重視。
[1] Whooley MA, de Jonge P, Vittinghoff E, et al. Depressive symptoms, health behaviors, and risk of cardiovascular events in patients with coronary heart disease. JAMA, 2008, 300: 2379-2388.
[2] Rudisch B, Nemeroff CB. Epidemiology of comorbid coronary artery disease and depression. Biol Psychiatry, 2003, 54: 227-240.
[3] Egede LE. Major depression in individuals with chronic medical disorders: prevalence, correlates and association with health resource utilization, lost productivity and functional disability. Gen Hosp Psychiatry, 2007, 29: 409-416.
[4] Gustad LT, Laugsand LE, Janszky I, et al. Symptoms of anxiety and depression and risk of acute myocardial infarction: the HUNT 2 study. Eur Heart J, 2014, 35: 1394-1403.
[5] Gronli J, Murison R, Bjorvatn B, et al. Chronic mild stress affects sucrose intake and sleep in rats. Behav Brain Res, 2004, 150: 139-147.
[6] Moreau JL. Validation of an animal model of anhedonia, a major symptom of depression. Encephale, 1997, 23: 280-289.
[7] Katz RJ, Roth KA, Carroll BJ. Acute and chronic stress effects on open field activity in the rat: implications for a model of depression. NeurosciBiobehav Rev, 1981, 5: 247-251.
[8] Carnevali L, Trombini M, Rossi S, et al. Structural and electrical myocardial remodeling in a rodent model of depression. Psychosom Med, 2013, 75: 42-51.
[9] Barton DA, Dawood T, Lambert EA, et al. Sympathetic activity in major depressive disorder: identifying those at increased cardiac risk? J Hypertens, 2007, 25: 2117-2124.
[10] Cao JM, Fishbein MC, Han JB, et al. Relationship between regional cardiac hyperinnervation and ventricular arrhythmia. Circulation, 2000, 101: 1960-1969.
[11] 許晶晶, 李向平, 陳名杰. 焦慮抑郁情緒對冠心病患者血清炎癥因子及血管內皮功能的影響. 中國循環雜志, 2011: 426-429.
[12] 李建軍. 他汀類藥物非調脂作用及其機制. 中國循環雜志, 2011, 26: 313-314.
[13] Belzung C, Lemoine M. Criteria of validity for animal models of psychiatric disorders: focus on anxiety disorders and depression. Biol Mood Anxiety Disord, 2011, 1: 9.
[14] Willner P, Mitchell PJ. The validity of animal models of predisposition to depression. Behav Pharmacol, 2002, 13: 169-188.
[15] Willner P. Validity, reliability and utility of the chronic mild stress model of depression: a 10-year review and evaluation. Psychopharmacology (Berl), 1997, 134: 319-329.
[16] Shi S, Liang J, Liu T, et al. Depression increases sympathetic activity and exacerbates myocardial remodeling after myocardial infarction: evidence from an animal experiment. PLoS One, 2014, 9: e101734.
[17] Ren C, Wang F, Li G, et al. Nerve sprouting suppresses myocardial I(to) and I(K1) channels and increases severity to ventricular fibrillation in rat. Auton Neurosci, 2008, 144: 22-29.
[18] Burgi K, Cavalleri MT, Alves AS, et al. Tyrosine hydroxylase immunoreactivity as indicator of sympathetic activity: simultaneous evaluation in different tissues of hypertensive rats. Am J Physiol Regul Integr Comp Physiol, 2011, 300: R264-R271.
Effect of Chronic Stress on Cardiac Sympathetic Nerve Function and Susceptibility of Ventricular Arrhythmia in Experimental Rats
SUN Li-fang, YANG Bo, SHI Shao-bo, LIU Tao, RUAN Bing, LIANG Jin-jun.
Department of Cardiology, Wuhan University People’s Hospital, Wuhan (430060), Hubei, China
Objective: To investigate the changes of cardiac sympathetic nerve function and susceptibility of ventricular arrhythmia at chronic stress condition in experimental rats.
Chronic mild stress; Ventricular arrhythmia; Sympathetic reconstruction
2014-09-04)
(編輯:王寶茹)
中央高校基本科研業務費專項資金資助(2014302020201);湖北省基金重點項目(2014CFA061);國家自然科學基金(81200139)
430060 湖北省武漢市,武漢大學人民醫院 心血管內科
孫麗芳 碩士研究生 主要研究方向為心律失常研究 Email:summer19871105@163.com 通訊作者:楊波 Email:yybb112@whu.edu.cn
R54
A
1000-3614(2015)03-0272-04
10.3969/j.issn.1000-3614.2015.03.018

