多酚-蛋白質共價作用及其對食品體系的影響研究進展
闞茗銘,葉發銀,趙國華 *
(西南大學食品科學學院,重慶 400715)
多酚-蛋白質共價作用及其對食品體系的影響研究進展
闞茗銘,葉發銀,趙國華 *
(西南大學食品科學學院,重慶 400715)
近年來多酚與蛋白質間的相互作用及其對食品體系的影響受到人們的極大關注。按作用方式可將多酚與蛋白質之間的相互作用分為非共價作用和共價作用。有關非共價作用的研究較完善,相比之下共價作用的研究報道非常少。為推動對食品體系中多酚與蛋白質共價作用的研究,在廣泛查閱文獻的基礎上,本文綜述了多酚與蛋白質共價結合的機理、影響因素以及這種結合對食品體系感官特性、功能與營養特性、安全性的影響,并進一步提出了有關食品體系中多酚與蛋白質共價作用今后的研究方向。
多酚;蛋白質;共價作用;營養;食品
大多數食品是多成分共存的復雜體系。在生產、加工、包裝、流通等過程中,食品中的不同成分之間可能發生相互作用進而影響到食品的營養、質地、安全性等。近年來,針對食品成分之間的相互作用并據此調控食品品質的研究已成為食品科學新的研究熱點。食品成分之間相互作用的研究能對復雜食品體系和現象做出合理的解釋。如對食品多糖與蛋白質相互作用的研究能揭示食品體系的流動性、穩定性、質地與口感形成的內在原因[1]。作為食品體系常見的兩類物質,研究表明多酚與蛋白質能以非共價或共價方式在食品體系中發生相互作用。多酚與蛋白質分子通過氫鍵、疏水相互作用和范德華力等分子間作用力發生可逆的非共價相互作用并對食品體系產生明顯的影響。如多酚與淀粉酶的非共價復合作用直接導致了淀粉消化速率的降低[2]。對多酚蛋白質非共價作用的研究已有大量的報道和綜述,本文不再贅述。而有關多酚與蛋白質之間的共價作用的研究相對較薄弱,其作用規律及對食品體系的影響還鮮為人知。為快速推動這方面的研究,在廣泛調研文獻的基礎上,本文對食品體系中多酚與蛋白質共價作用的機理、影響因素及其對食品體系的影響進行了全面綜述,旨在為含有蛋白質和多酚的食品加工提供有益幫助,以提升這類產品的質量。
1 多酚與蛋白質的共價結合機理
當前的研究表明,多酚與蛋白質的共價結合機理主要包括鄰醌機制[3-4]與碳正離子機制[5]。
1.1 鄰醌機制
多酚與蛋白質的鄰醌結合機制主要分兩步完成。第一步是多酚被氧化形成鄰醌或半醌。多酚的氧化途徑主要有3 個:首先,在諸如酪氨酸酶或漆酶[4,6]的催化下,多酚發生酶促氧化生成鄰苯醌,酶促氧化的發生它需要同時出現3 個因素:氧、酚類化合物和多酚氧化酶;再者,食品體系中的活性氧可直接使多酚發生自動氧化形成鄰苯半醌,pH值的增加會促進自動氧化的發生,在堿性或中性pH值時酚類物質會以酚鹽形式存在,很容易由活性氧氧化形成鄰苯醌或鄰苯半醌[7];另外,某些金屬陽離子如Fe3+,也能誘導多酚氧化形成鄰苯醌或鄰苯半醌,特別是溫度的增加,熱導會使酚類化合物氧化形成鄰苯醌、鄰苯半醌或降解酚類化合物的結構[8-9]。多酚與蛋白質的共價結合的第二步是通過鄰醌或半醌與蛋白質分子中的巰基、氨基、亞氨基等發生親核加成反應使多酚和蛋白質之間形成C—N或C—S共價鍵[10-11]。圖1以咖啡酸為例給出了多酚與蛋白質共價結合的鄰醌機制。
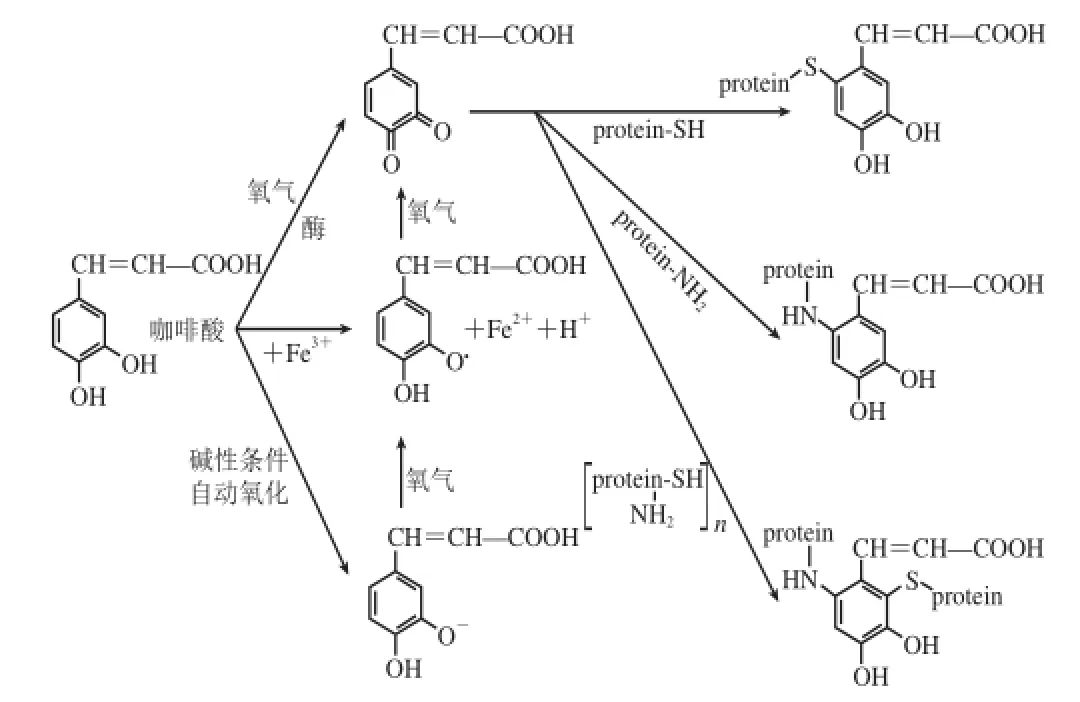
圖1 多酚與蛋白質共價結合鄰醌機制示意圖(以咖啡酸為例)Fig.1 O-Quinone mechanism of the polyphenol-protein covalent interaction (caffeic acid as an example)
1.2 碳正離子機制
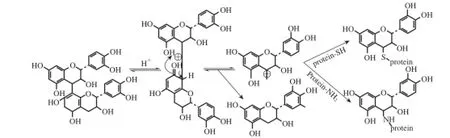
圖2 多酚與蛋白質共價結合的碳正離子機制示意圖Fig.2 Carbocation mechanism of the polyphenol-protein covalent interaction
多酚與蛋白質的碳正離子結合機制也主要分兩步完成。第一步是食品體系中的原花青素-黃烷復合物在酸性介質中相對不穩定,結構相對脆弱,容易發生裂解,導致高聚的黃烷-3-醇的C4位有碳正離子的生成以及低聚黃烷-3-醇會釋放出黃烷-3-醇單體[12-14]。第二步是裂解形成的碳正離子與蛋白質的親核基團如巰基、氨基等發生加成反應使多酚和蛋白質之間形成C—N或C—S共價鍵,或者與外源性多肽鏈發生交聯[12]。圖2給出了多酚與蛋白質共價結合的碳正離子機制。
2 影響多酚與蛋白質共價結合的因素
影響食品體系中多酚與蛋白質共價作用的因素主要包括多酚的濃度與性質、蛋白質的濃度與性質以及食品體系的環境條件。
2.1 多酚的影響
多酚與蛋白質的共價相互作用會受到多酚類型、濃度、分子質量等因素的影響。Rawel等[15]研究發現在相同條件下槲皮素比蘆丁更容易與乳清蛋白(whey protein,WP)發生共價結合。與沒食子酸相比,蘆丁能以更高的強度與來自鱈魚皮的明膠共價結合從而形成更高強度的多酚交聯明膠凝膠[16]。Prodpran等[17]發現在相同濃度下單寧酸與魚肌纖維蛋白的共價作用明顯比咖啡酸、兒茶素和阿魏酸強。這些多酚的加入可使魚肌纖維蛋白膜具有更好的機械性能,而單寧酸的效果最佳。Dubeau等[18]發現紅茶中分子質量較高的多酚(如茶黃素、茶紅素)更容易與牛奶蛋白結合。但Bartolome等[19]的結果則表明分子質量較低的多酚(如對香豆酸、原兒茶酸、咖啡酸和肉桂酸等)與牛血清白蛋白(bovine serum albumin,BSA)有強的結合親和力,而對羥基苯甲酸與牛血清白蛋白之間沒有顯著的結合作用。有關多酚結構對其與蛋白質共價作用的影響規律還需完善。
2.2 蛋白質的影響
蛋白質的疏水性、溶解度、等電點、濃度、氨基酸組成以及多酚與蛋白質的物質的量比對多酚與蛋白質的共價作用有明顯影響。Prigent等[20]發現蛋白質分子中賴氨酸殘基側鏈上的氨基(—NH2)比組氨酸和色氨酸殘基上的亞氨基(—NH—)更容易與鄰苯醌發生加成反應,所以酪氨酸含量越高的蛋白質與多酚發生共價結合作用的強度也越高。Rohn等[21]的研究則表明當牛血清白蛋白與槲皮素的物質的量比為2∶1時兩者的共價結合程度最高。
2.3 環境條件的影響
多酚與蛋白質的相互作用對pH值、溫度等環境條件敏感。Wang Xiaoya等[22]發現pH值對α-乳清蛋白與表沒食子兒茶素沒食子酸酯((-)-epigallocatechin gallate,EGCG)共價結合作用影響顯著。當pH值為8.0時,α-乳清蛋白與EGCG的共價結合程度最高,pH值降低對此共價結合作用有負面影響,其主要原因是EGCG在堿性條件下更容易被氧化形成醌。更有意思的是,環境pH值甚至會影響到多酚與蛋白質的作用方式。有研究發現綠原酸在中性或酸性條件下(pH≤7)與牛血清白蛋白、溶菌酶和α-乳清蛋白以非共價作用結合,而在堿性條件下這種作用轉變為共價方式,其根本原因仍然是多酚在堿性條件下更易被氧化形成醌。溫度對多酚蛋白質共價作用的發生與強度有明顯影響。Prigent等[23]研究發現5-O-咖啡酰奎寧酸與牛血清白蛋白在低溫下(如5、25 ℃)以非共價作用結合而在高溫下(60 ℃)會產生共價鍵,這是由于多酚在高溫容易發生氧化而生成醌類物質。
3 多酚與蛋白質共價作用對食品體系的影響
多酚與蛋白質的共價相互作用對食品體系的感官特性、安全性以及多酚與蛋白質的生物學與營養學特性能產生影響。表1總結了多酚與蛋白質相互作用對食品體系的影響。
3.1 對食品感官特性的影響
多酚與蛋白質的共價作用會引起食品體系混濁度、顏色、風味等的變化。Soares等[24]發現唾液蛋白(尤其是富含脯氨酸的酸性蛋白(acidic prolin e-rich proteins,APRPs))與單寧的共價相互作用會形成大量不溶性聚集體而體系的混濁度增加。Wang Xiaoya等[22]發現60 ℃時在接近中性條件時(pH 6~8),EGCG與α-乳清蛋白的共價作用會使體系的濁度降低。Xu等[25]發現來自油菜籽餅粕的蛋白質和多酚在水相體系中能形成共價復合物,這與油菜籽蛋白產品的顏色變暗和不良風味的出現關系密切。Prodpran等[17]發現多酚(咖啡酸、兒茶素、阿魏酸和單寧酸)與魚肌纖維蛋白的共價作用會導致可食性魚肌纖維蛋白膜的透明度下降、顏色變暗、亮度下降,且這種影響隨多酚用量的增加而更加明顯。
3.2 對多酚生物學效應的影響
多酚與蛋白質的共價相互作用對食品體系中的形態、抗氧化力和生物利用率均有明顯的影響。有多篇有關添加牛奶對茶或咖啡多酚抗氧化能力影響的文獻,但研究結果各不一樣。其主要原因是使用的抗氧化評價方法不一致。Niseteo等[27]發現添加牛奶會導致速溶咖啡中總酚、綠原酸衍生物、咖啡因含量及其抗氧化力明顯降低。咖啡中總酚、綠原酸衍生物、咖啡因含量實際是由于這些物質與蛋白質結合使多酚從游離態轉化為結合態而無法被作者所采用的Folin-Ciocalteu法測定。Dubeau等[18]用3 種抗氧化評價方法(ABTS+·清除法、伏安法和脂質過氧化抑制法)研究了牛奶對綠茶、大吉嶺茶和英國早餐茶中多酚抗氧化能力的影響。結果發現牛奶會使由ABTS+·清除法和伏安法測定的茶的抗氧化能力下降而使由脂質過氧化抑制法測定的茶的抗氧化能力提高。其原因與牛奶蛋白和茶葉中多酚物質的共價作用密切相關。ABTS+·清除法和伏安法測定的主要是體相中由游離多酚決定的抗氧化能力,多酚-蛋白質的共價相互作用明顯使這一能力削弱。而脂質過氧化抑制法測定的主要是油水界面上由蛋白質決定的抗氧化能力,多酚-蛋白質共價結合物比游離蛋白質具有更好的乳化活性和抗氧化性,使得這一結果得以提升。Rohn等[21]發現槲皮素與牛血清白蛋白的共價結合物的抗氧化性(Trolox當量抗氧化力)明顯低于游離的槲皮素。Duarte等[28]發現牛奶中的清蛋白和酪蛋白能與咖啡中的綠原酸發生共價作用,這是導致牛奶與咖啡同時攝入時機體對咖啡中綠原酸代謝效率急劇下降的直接原因。巧克力黃酮類化合物與牛奶蛋白的相互作用會大幅度降低巧克力中黃酮化合物被吸收進入血液的數量[30],而巧克力在加工時加入牛奶的影響比巧克力與牛奶同時攝入的影響要更嚴重。多酚與蛋白質的共價作用與非共價作用往往同時發生,很難完全區分開它們對食品體系的影響,再加上實驗方法、儀器、條件等的不同,導致研究結果也各不一樣,所以多酚與蛋白質相互作用對多酚生物學效應的影響還需要更深入的研究,希望在以后能在明確區分是共價作用還是非共價作用的情況下更深入的研究對多酚生物學效應的影響。
3.3 對蛋白質生物學效應的影響
多酚與蛋白質共價作用對蛋白質的影響主要表現在提高蛋白質的熱穩定性、抗氧化活性和乳化活性而降低蛋白質的生物利用率和抗原性等。Almajano等[26]認為蛋白質(酪蛋白等)與EGCG溶液在混合初期主要為非共價復合作用而在后期可能發生共價加合作用,而這種作用能使蛋白質的抗氧化能力明顯得以提升。Wang Xiaoya等[22]的研究也表明,與α-乳白蛋白相比,α-乳白蛋白-EGCG共價復合物的抗氧化活性和乳化活性更強。O’Connell等[8]發現添加5.5 mmol/L的咖啡酸能顯著提升牛奶在高溫(140~150 ℃)下的熱穩定性。但多酚對蛋白質的影響與多酚的種類和結構關系密切。Yan Mingyan等[16]研究發現用蘆丁交聯能顯著增加明膠干凝膠的熱穩定性,但溶脹率有所降低;而沒食子酸交聯對明膠干凝膠的熱穩定性和溶脹率均無影響。Strauss等[31]同樣發現用酚酸、槲皮素、蘆丁交聯能大幅度提升明膠微粒的熱穩定性。Rawel等[32]發現與酚酸、槲皮素、楊梅酮的共價作用對大豆球蛋白熱穩定性有益,但與黃酮、芹黃素、山奈酚的共價作用則對大豆球蛋白的熱穩定性無影響。
多酚與蛋白質的共價作用往往導致蛋白質的生物利用率降低但抗原性也明顯減弱。Arimboor等[29]發現沙棘原花青素與牛血清白蛋白的共價作用會導致后者被胃蛋白酶和胰蛋白酶水解的速度顯著下降,損害其生物利用率。Rawel等[33]研究發現與綠原酸的共價結合作用會極大地降低牛血清白蛋白被胃蛋白酶和胰蛋白酶消化的速率,且降低的幅度隨共價結合程度的增大而增大。但必須指出只有與綠原酸的共價結合程度較低時(5.1~7.1 mol綠原酸/mol BSA),牛血清白蛋白被胰凝乳蛋白酶消化的速率才有顯著降低。?wieca等[34]發現洋蔥皮多酚與小麥粉中蛋白質的相互作用直接導致了添加4%的洋蔥皮面包蛋白質的消化率(55%)顯著低于未添加者的(78.4%)。Tantoush等[35]發現與酸櫻桃酚類物質的非二硫鍵共價作用能明顯降低酶交聯β-乳球蛋白的過敏原性。咖啡酸對酶交聯β-酪蛋白的過敏原性也有減弱作用[36],同樣發現與咖啡酸的共價作用能使花生蛋白的致敏性降低[37]。常見多酚降低櫻桃過敏原Pru av 1的強弱順序為咖啡酸和表兒茶素>兒茶素和沒食子酸>槲皮素和蘆丁[38]。
4 結 語
在食品生產與加工過程中,酚類物質與蛋白質接觸而發生各種相互作用,常常會導致感官品質變壞,會降低蛋白質的營養價值,造成富含多酚食品的營養損失等。而且多酚與蛋白質的共價相互作用并非占主導,在一些研究中觀察到并非只有蛋白質與酚類化合物的相互作用,食物中的其他物質與此同時也可能發生作用、產生影響,所以如何有效區分多酚與蛋白質共價作用與非共價作用,以及如何區分多酚與其他物質作用對食品體系的影響還需要更深入的研究;其次,目前很多有關多酚與蛋白質相互作用的研究是在模擬體系中進行的,不同的消化酶、不同胃消化模擬模型等都對體外消化率的測定結果等有影響,從而還需要加強在真實食品體系中多酚與蛋白質的共價作用的研究;再者,我們還應進一步了解不同種類的多酚與蛋白質共價結合的確切作用機制,以及更深入地從化學反應的熱力學和動力學角度來分析兩者發生共價結合的可能性和反應的速度、程度等,從而可利用多酚與蛋白質的共價作用改良含有蛋白質和酚類食品的質地、加工工藝條件和工藝參數等,有利于幫助研發具有更高營養和健康價值的新食品產品;另外,腸道微生物對抗消化多酚-蛋白質共價結合物及其部分降解物的代謝機制還不清楚,有關這方面的研究也還亟需加強。總之,蛋白質和酚類化合物的相互作用是復雜的,尤其是兩者間的共價相互作用更需要做進一步的研究,以便更好地了解蛋白質-酚類化合物的相互作用機制及其影響因素。
[1] de KRUIF C G, TUINIER R. Polysaccharide protein interactions[J]. Food Hydrocolloids, 2001, 15(4/6): 555-563.
[2] CHAI Yanwei, WANG Mingzhu, ZHANG Genyi. Interaction between amylose and tea polyphenols modulates the postprandial glycemic response to high-amylose maize starch[J]. Journal of Agricultural and Food Chemistry, 2013, 61(36): 8608-8615.
[3] NICOLAS J J, RICHARD-FORGET F C, GOUPY P M, et al. Enzymatic browning reactions in apple and apple products[J]. Critical Reviews in Food Science and Nutrition, 1994, 34(2): 109-157.
[4] BEART J E, LILLEY T H, HASLAM E. Polyphenol interactions. part 2. Covalent binding of procyanidins to proteins during acid-catalysed decomposition, observation of some polymeric proanthocyanidins[J]. Journal of the Chemical Society, Perkin Transactions 2, 1985(9): 1439-1443.
[5] MATHEIS G, WHITAKER J R. Modification of proteins by polyphenol oxidase and peroxidase and their products[J]. Journal of Food Biochemistry, 1984, 8(3): 137-162.
[6] CILLIERS J J L, SINGLETON V L. Characterization of the products of nonenzymic autoxidative phenolic reactions in a caffeic acid model system[J]. Journal of Agricultural and Food Chemistry, 1991, 39(7): 1298-1303.
[7] de FREITAS V A P, GLORIES Y, LAGUERRE M. Incidence of molecular structure in oxidation of grape seed procyanidins[J]. Food Chemistry, 1998, 46(2): 376-382.
[8] O’CONNELL J E, FOX P F. Proposed mechanism for the effect of polyphenols on the heat stability of milk[J]. International Dairy Journal, 1999, 9(8): 523-536.
[9] BATE-SMITH E C. Leuco-anthocyanins. 1. Detection and identification of anthocyanidins formed leuco-anthocyanins in plant tissues[J]. Journal of Biochemistry, 1954, 58(1): 122-125.
[10] PETER M G. Chemical modifi cations of biopolymers by quinones and quinone methides[J]. Angewandte Chemie International Edition, 1989, 28(5): 555-570.
[11] CHEYNIER V F, TROUSDALE E K, SINGLETON V L, et al. Characterization of 2-S-glutathionylcaftaric acid and its hydrolysis in relation to grape wines[J]. Journal of Agricultural and Food Chemistry, 1986, 34(2): 217-221.
[12] THOMPSON R S, JACQUES D, HASLAM E, et al. Plant proanthocyanidins. Part I. Introduction: the isolation, structure and distribution in nature of plant procyanidins[J]. Journal of the Chemical Society, Perkin Transactions 1, 1972: 1387-1399.doi: 10.1039/ p19720001387.
[13] PORTER L J, HRSTICH L N, CHAN B G. The conversion of procyanidins and prodelphinidins to cyanidin and delphinidin[J]. Phytochemistry, 1985, 25(1): 223-230.
[14] JERVIS L, PIERPOINT W S. Purification technologies for plant proteins[J]. Journal of Biotechnology, 1989, 11(2/3): 161-198.
[15] RAWEL H M, ROHN S, KROLL J. Influence of a sugar moiety (rhamnosylglucoside) at 3-O position on the reactivity of quercetin with whey proteins[J]. International Journal of Bi ological Macromolecules, 2003, 32(3/5): 109-120.
[16] YAN Mingyan, LI Bafang, ZHAO Xue, et al. Physicochemical properties of gelatin gels from walleye pollock (Theragra chalcogramma) skin cross-linked by gallic acid and rutin[J]. Food Hydrocolloids, 2011, 25(5): 907-914.
[17] PRODPRAN T, BENJAKUL S, PHATCHARAT S. Effect of phenolic compounds on protein cross-linking and properties of film from fish myofibrillar protein[J]. International Journal of Biological Macromolecules, 2012, 51(5): 774-782.
[18] DUBEAU S, SAMSON G, TAJMIR-RIAHI H A. Dual effect of milk on the antioxidant capacity of green, Darjeeling, and English breakfast teas[J]. Food Chemistry, 2010, 122(3): 539-545.
[19] BARTOLOMé B, ESTRELLA I, HERNáNDEZ M T. Interaction of low molecular weight phenolics with proteins (BSA)[J]. Journal of Food Science, 2000, 65(4): 617-621.
[20] PRIGENT S V E, VORAGEN A G J, LI F, et al. Covalent interactions between amino acid side chains and oxidation products of caffeoylquinic acid (chlorogenic acid)[J]. Journal of the Science of Food and Agriculture, 2008, 88(10): 1748-1754.
[21] ROHN S, RAWEL H M, KROLL J. Antioxidant activity of proteinbound quercetin[J]. Journal of Agricultural and Food Chemistry, 2004, 52(15): 4725-4729.
[22] WANG Xiaoya, ZHANG Jiao, LEI Fei, et al. Covalent complexation and functional evaluation of (-)-epigallocatechin gallate and α-lactalbumin[J]. Food Chemistry, 2014, 150: 341-347.
[23] PRIGENT S V E, GRUPPEN H, VISSER A J W G, et al. Effects of non-covalent interactions with 5-O-caffeoylquinic acid (chlorogenic acid) on the heat denaturation and solubility of globular proteins[J]. Journal of Agricultural and Food Chemistry, 2003, 51(17): 5088-5095.
[24] SOARES S, MATEUS N, DE FREITAS V. Interaction of different classes of salivary proteins with food tannins[J]. Food Research International, 2012, 49(2): 807-813.
[25] XU L, DIOSADY L L. Interactions between canola proteins and phenolic compounds in aqueous media[J]. Food Research International, 2000, 33(9): 725-731.
[26] ALMAJANO M P, DELGADO M E, GORDON M H. Changes in the antioxidant properties of protein solutions in the presence of epigallocatechin gallate[J]. Food Chemistry, 2007, 101(1): 126-130.
[27] NISETEO T, KOMES D, BEL??AK-CVITANOVI? A, et al. Bioactive composition and antioxidant potential of different commonly consumed coffee brews affected by their preparation technique and milk addition[J]. Food Chemistry, 2012, 134(4): 1870-1877.
[28] DUARTE G S, FARAH A. Effect of simultaneous consumption of milk and coffee on chlorogenic acids’ bioavailability in humans[J]. Journal of Agricultural and Food Chemistry, 2011, 59(14): 7925-7931.
[29] ARIMBOOR R, ARUMUGHAN C. Sea buckthorn (Hippophae rhamnoides) proanthocyanidins inhibit in vitro enzymatic hydrolysis of protein[J]. Journal of Food Science, 2011, 76(6): 130-137.
[30] SERAFINI M, BUGIANESI R, MAIANI G, et al. Plasma antioxidants from chocolate[J]. Nature, 2003, 424(6952): 1013.
[31] STRAUSS G, GIBSON S M. Plant phenolics as cross-linkers of gelatin gels and gelatin-based coacervates for use as food ingredients[J]. Food Hydrocolloids, 2004, 18(1): 81-89.
[32] RAWEL H M, CZAJKA D, ROHN S, et al. Interactions of different phenolic acids and flavonoids with soy proteins[J]. International Journal of Biological Macromolecules, 2002, 30(3/4): 137-150.
[33] RAWEL H M, ROHN S, KRUSE H P, et al. Structural changes induced in bovine serum albumin by covalent attachment of chlorogenic acid[J]. Food Chemistry, 2002, 78(4): 443-455.
[34] ?WIECA M, GAWLIK-DZIKI U, DZIKI D, et al. The influence of protein-flavonoid interactions on protein digestibility in vitro and the antioxidant quality of breads enriched with onion skin[J]. Food Chemistry, 2013, 141(1): 451-458.
[35] TANTOUSH Z, STANIC D, STOJADINOVIC M, et al. Digestibility and allergenicity of β-lactoglobulin following laccase-mediated crosslinking in the presence of sour cherry phenolics[J]. Food Chemistry, 2011, 125(1): 84-91.
[36] STANIC D, MONOGIOUDI E, DILEK E, et al. Digestibility and allergenicity assessment of enzymatically crosslinked β-casein[J]. Molecular Nutrition Food Research, 2010, 54(9): 1273-1284.
[37] CHUNG S Y, KATO Y, CHAMPAGNE E T. Polyphenol oxidase/caffeic acid may reduce the allergenic properties of peanut allergens[J]. Journal of the Science of Food and Agriculture, 2005, 85(15): 2631-2637.
[38] GRUBER P, VIETHS S, WANGORSCH A, et al. Maillard reaction and enzymatic browning affect the allergenicity of Pru av 1, the major allergen from cherry (Prunus avium)[J]. Journal of Agricultural and Food Chemistry, 2004, 52(12): 4002-4007.
Advance in Research on Covalent Interactions of Polyphenol and Protein and Their Effects on Food System
KAN Mingming, YE Fayin, ZHAO Guohua*
(College of Food Science, Southwest University, Chongqing 400715, China)
Recently, the interactions between polyphenols and proteins have attracted increasing scientifi c interest. Based on the mode of their interactions, the interactions between polyphenols and proteins can be divided into two categories known as the non-covalent interaction and the covalent interaction. While extensive studies have been conducted on the non-covalent interactions, little research is available on the covalent interactions. Based on an extensive literature review, this paper overviews the mechanism of covalent interactions between polyphenols and proteins, factors affecting their interactions, and the effects of these interactions on the food system. It has been shown that the covalent interactions of polyphenol and protein are partially responsible for the sensory properties, functional and nutritional properties and safety of the food system. Finally, future research directions in this area are also discussed.
polyphenols; proteins; covalent interactions; nutrition; food
TS201.4
A
1002-6630(2015)01-0245-05
10.7506/spkx1002-6630-201501047
2014-02-09
國家自然科學基金面上項目(31371437)
闞茗銘(1990—),女,碩士研究生,研究方向為食品安全與質量控制。E-mail:kmm1212@yeah.net
*通信作者:趙國華(1971—),男,教授,博士,研究方向為食品化學與營養學。E-mail:zhaoguohua1971@163.com

