金頂側耳原生質體制備與再生條件的研究
張亞嬌 陳淮潔 盧木造 朱 堅*
?
金頂側耳原生質體制備與再生條件的研究
張亞嬌1,2陳淮潔1盧木造1朱 堅1,2*
(1.福建農林大學園藝學院,福州 350002;2.福建農林大學菌物研究中心,福州 350002 )
采用單因素以及正交試驗法探究金頂側耳原生質體的制備及再生條件,結果顯示:加富PDA液體培養基培養5天的菌絲,在以蔗糖為滲透壓穩定劑配制2%濃度的溶壁酶條件下,30 ℃酶解2.5 h,原生質體得率為2.36×107個/mL;選擇蔗糖再生培養基,再生率可達0.71%。
金頂側耳;原生質體;制備;再生;正交試驗
金頂側耳(Sing.)隸屬傘菌目、側耳科、側耳屬,別名金頂蘑、榆黃蘑[1],具有降低血脂、滋補強壯、抑制腫瘤、抗疲勞等多種營養保健功效[2]。原生質體的研究在食用菌育種中具有重要意義,有關金頂側耳的研究目前大多集中在栽培方法、子實體蛋白質和多糖的提取、液體菌種應用、深加工等方面,對其原生質體的制備與再生研究少見報道。而筆者則較為系統地研究了金頂側耳原生質體制備與再生的適宜條件,為今后新品種的選育、原生質體融合及遺傳轉化等研究工作奠定了基礎。
1 材料與方法
1.1 供試菌株
供試菌株為金頂側耳Pl.c0001,由福建省食用菌種質資源保藏與管理中心提供。
1.2 培養基配方
試管斜面培養基(PDA):馬鈴薯20%,葡萄糖2%,瓊脂2%。PDA液體培養基:馬鈴薯20%,葡萄糖2%。加富PDA液體培養基:馬鈴薯20%,葡萄糖2%,蛋白胨 0.2%,MgSO4·7H2O 0.05%,KH2PO40.05%,維生素B10.001%。MYG培養基:葡萄糖1%,麥芽糖 0.5%,酵母粉 0.5%。再生培養基:馬鈴薯20%,葡萄糖2%,酵母粉0.3%,蛋白胨0.2%,KH2PO40.3%,MgSO4·7H2O 0.15%,維生素B10.001%,瓊脂2%,穩滲劑0.6 mol/L。以上均為質量分數。
1.3 試劑
溶壁酶由廣東省微生物研究所提供,溶壁酶液和穩滲液分別用蔗糖、甘露醇、山梨醇、MgSO4·7H2O、KCl配制。
1.4 方法
(1)穩滲液的配制。分別精確稱取相應質量的蔗糖、甘露醇、山梨醇、MgSO4·7H2O、KCl溶于去離子水中,用容量瓶定容至終濃度為0.6 mol/L,高壓滅菌后備用。
(2)酶液配制。用0.6 mol/L的穩滲劑溶解適量的溶壁酶,分別配成酶濃度(/)為1%、1.5%、2%、2.5%、3%的溶壁酶液,0.22 μm微孔濾膜過濾除菌后備用。
(3)菌絲培養。首先將試管母種在斜面培養基(PDA)上進行活化,28 ℃培養7~8天后轉接到含有碎玻璃的液體培養基中靜置培養,每天搖床培養0.5 h(28 ℃,150 r/min),獲得純菌絲片斷。
(4)原生質體制備與計數。按試驗設計的菌齡,吸取相應培養天數的菌絲至無菌的帶蓋離心管中,6 500 r/min離心15 min后去上清液,再用無菌水和相應的穩滲劑先后洗滌菌絲1次。每100 mg濕菌絲加1 mL酶液,在相應水浴溫度下酶解一定時間。反應過程中每15 min輕微振蕩一次離心管,待酶解完畢時,吸取少量酶解液進行顯微鏡觀察并用血球計數板計數。
(5)原生質體純化。將制備的原生質體懸液用厚0.5 cm的無菌脫脂棉過濾,去除未酶解充分的菌絲,再經離心去除酶液。將離心后的原生質體沉淀用穩滲液洗滌2次,重新懸浮在等體積的穩滲液中,即得到純化的原生質體懸液。
(6)原生質體制備條件的單因素試驗設計。將上述菌絲液體培養基分別設為PDA液體培養基、加富PDA液體培養基、MYG培養基。酶濃度設1%、1.5%、2%、2.5%、3%,酶解時間設1 h、2 h、3 h、4 h、5 h,酶解溫度設26 ℃、28 ℃、30 ℃、32 ℃、34 ℃,菌齡設3天、5天、7天、9天、11天,穩滲劑為蔗糖、甘露醇、山梨醇、MgSO4·7H2O、KCl,進行單因素試驗。
(7)原生質體制備條件的正交試驗設計。在單因素試驗的基礎上選取酶解時間、菌齡和穩滲劑3個因素,以金頂側耳原生質體產量為指標,按照L9(34)正交表做正交試驗,對原生質體制備條件進行進一步的優化,水平因素見表1。

表1 原生質體制備條件優化試驗因素水平
(8)原生質體再生。取100 μL純化的原生質體懸液涂布于含有不同種類穩滲劑的固體再生培養基上進行培養。為了減少殘存菌絲片斷再生形成的菌落所產生的誤差,將原生質體用無菌的蒸餾水進行稀釋,待脹破后再涂平板培養作為對照。每10皿為一個處理。以上平板均放置于28 ℃恒溫培養箱培養,待3~4天菌落形成時進行統計。
(9)原生質體再生率的計算。參考王謙等的計算方法[3]。
2 結果與分析
2.1 不同單因素對原生質體產量的影響
(1)培養基。本實驗采用PDA液體、加富PDA液體,以及MYG3種培養基對供試菌株進行培養。經觀察發現,金頂側耳菌絲最先在MYG培養基中萌發,培養至5天時,加富PDA液體培養基中菌絲量最多。以甘露醇為穩滲劑,用2%的溶壁酶在30 ℃下酶解3 h時,加富PDA液體培養基得到的原生質體數目最多,MYG培養基為次,PDA液體培養基最少(圖1)。
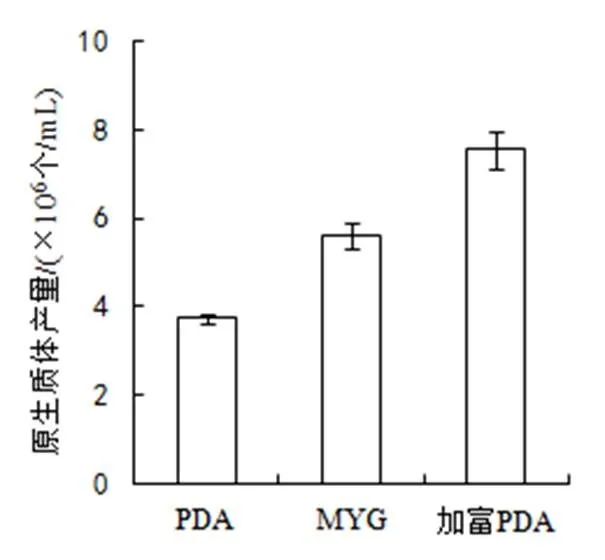
圖1 培養基對原生質體產量的影響
(2)酶濃度。選擇加富PDA液體培養基培養5天的菌絲,以甘露醇為穩滲劑,用不同濃度的酶溶液在30 ℃下酶解3 h,結果如圖2。其中,溶壁酶濃度在2.0%時產量最高,達到7.99×106個/mL,3.0%時最低,為1.23×106個/mL。由此看出,酶濃度過低或過高原生質體產量都較低,2%為較佳酶解濃度。
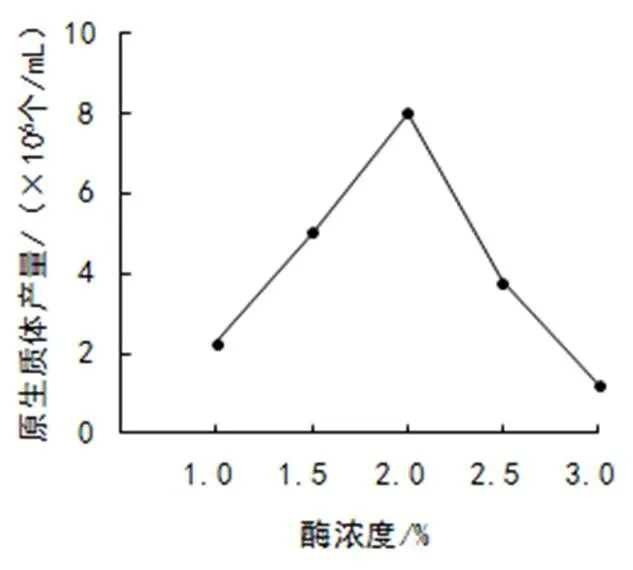
圖2 酶濃度對原生質體產量的影響
(3)酶解時間。選擇2%酶濃度,加富PDA液體培養基培養5天的菌絲,以甘露醇為穩滲劑,30 ℃下酶解不同時間,結果如圖3:酶解時間為2 h時,原生質體表現出最大釋放量,此時產量為9.83×106個/mL,之后隨著酶解時間的增加,產量開始下降。因此,確定2 h為金頂側耳較佳酶解時間。
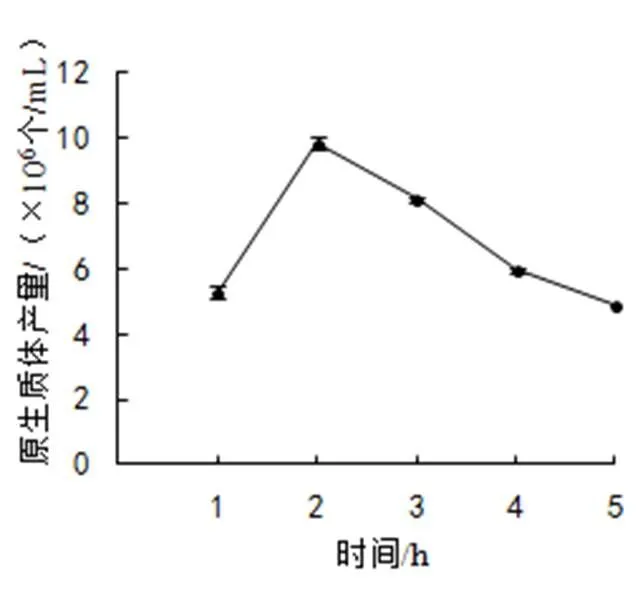
圖3 酶解時間對原生質體產量的影響
(4)酶解溫度。選擇加富PDA液體培養基培養5天的菌絲,以甘露醇為穩滲劑,2%濃度的酶在不同酶解溫度下酶解2 h,結果如圖4:在溫度低于30 ℃時,隨著溫度的升高酶解反應加快,原生質體的數目呈現出先迅速增加后趨于平緩增加的態勢;當溫度超過30 ℃后,原生質體產量開始降低。這可能是由于溫度過高,造成酶失活,破壞原生質體膜的結構,使其活性降低,甚至變形、裂解。因此,確定30 ℃為酶解反應的較佳溫度。
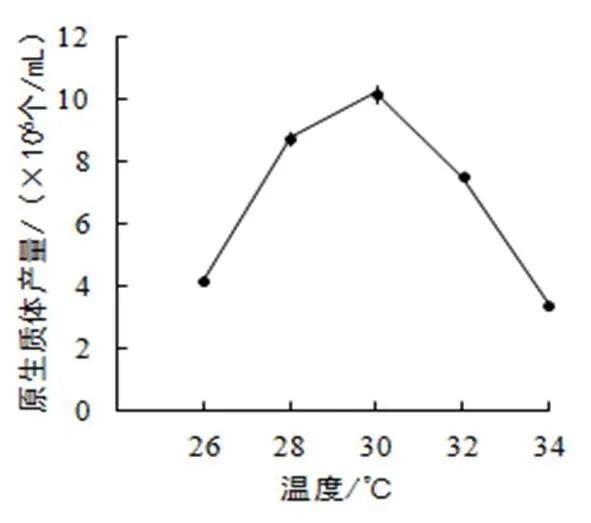
圖4 酶解溫度對原生質體產量的影響
(5)菌齡。選擇2%酶濃度,加富PDA液體培養基培養數天的菌絲,以甘露醇為穩滲劑,30 ℃下酶解2 h,結果如圖5:菌絲培養5天時,原生質體數目最多,達到1.03×107個/mL。之后隨著培養天數的增加,菌絲開始老化,原生質體產量降低。當菌絲長到11 天時,原生質體的產量降低到105數量級。
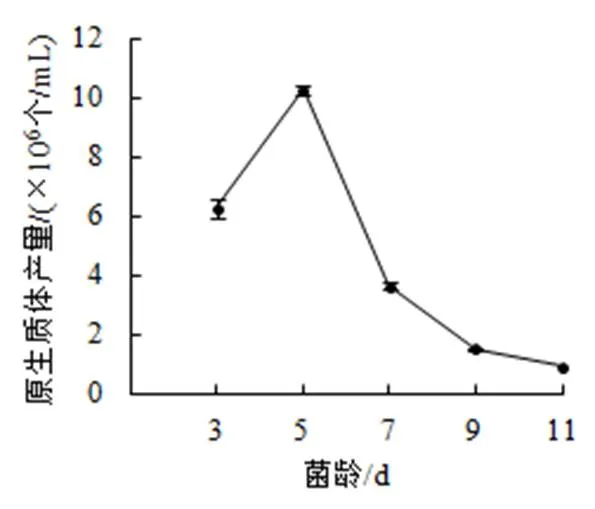
圖5 菌齡對原生質體產量的影響
(6)穩滲劑。原生質體在分離、再生及融合過程中都離不開滲透壓穩定劑的保護。由圖6可以看出,有機糖醇類的穩滲劑比無機鹽更適合金頂側耳原生質體的制備,其中,以蔗糖為穩滲液制備出的原生質體產量最高,為1.87×107個/mL,明顯高于其他4種穩滲劑,KCl最低。
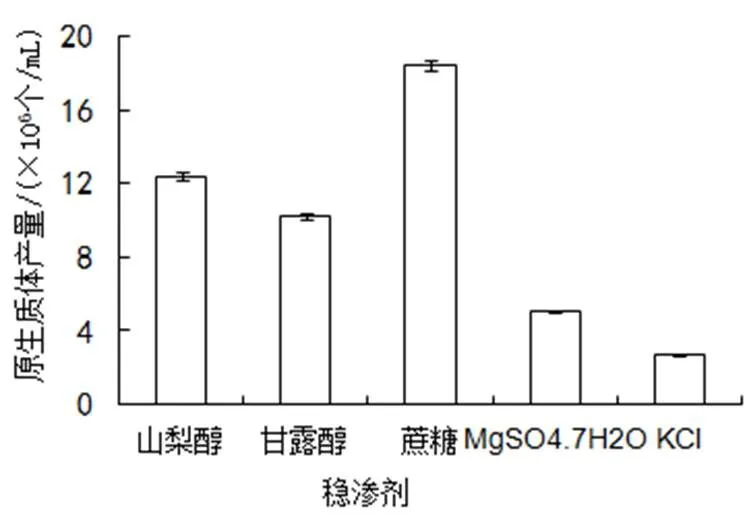
圖6 穩滲劑種類對原生質體產量的影響
2.2 復合因素對原生質體產量的影響
運用DPS7.05軟件對正交試驗結果進行統計分析。各處理平均數間的多重比較采用鄧肯式新復極差測驗(Duncan,s New Multiple Range Test),差異顯著性水平定為α=0.05,差異極顯著水平定為α=0.01進行分析,結果見表2。
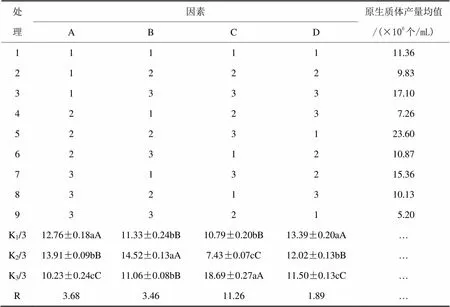
表2 原生質體制備條件正交試驗及結果
注:K為制備均值、R為制備極差。
由表2可知,各因素對原生質體制備結果產生影響的大小順序依次為穩滲液(C)>酶解時間(A)>菌齡(B),最優組合為A2B2C3。穩滲液(C)為蔗糖時,差異達到極顯著,這可能是蔗糖相比其他穩滲劑提供了更多的能源物質,為原生質體的穩定存在創造了更有利的環境。酶解時間(A)為2.5 h時,差異極顯著。菌齡(B)為5天的菌絲釋放的原生質體數目最多,差異達到極顯著,3天和7天的差異不顯著,可能是3天時菌齡過小,生成的菌絲量少,形成率低;7天時菌齡過大,由于營養等原因,菌絲對外界的抵御能力增強,而不利于原生質體的制備。因此最優組合為以蔗糖為穩滲液,酶解2.5 h,培養5天,此時菌絲釋放的原生質體數目最多。
2.3 再生培養基種類對原生質體再生率的影響
據部分文獻報道[4~6],選擇有機糖醇類的物質作為反應的穩滲劑比無機鹽類更適合原生質體的再生。所以本實驗并沒有就無機鹽類穩滲劑對再生的影響做深入研究。由表3可知,本實驗甘露醇作為穩滲劑時,金頂側耳的再生率很低,僅0.43%;蔗糖較高,為0.71%。
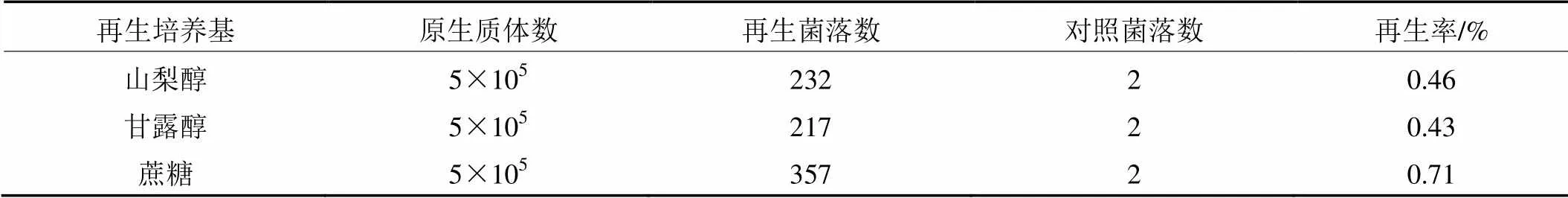
表3 不同再生培養基原生質體的再生率
注:以上結果均為10次重復的平均值。
3 討 論
本研究表明,金頂側耳原生質體最佳制備條件為:以0.6 mol/L蔗糖為穩滲劑,配制濃度為2%的酶液,在30 ℃條件下對加富PDA液體培養基中培養5天的菌絲酶解2.5 h,原生質體產量可高達2.36×107個/mL。其在蔗糖培養基上的再生率較高,達0.71%。
成功制備出原生質體以及保證其正常的再生是對其進行遺傳操作的關鍵。本實驗采用了單一酶即溶壁酶,通過酶解法制備原生質體,運用單因素和正交試驗,分別從多個相關因素進行優化,得到了較高數量的原生質體,以滿足其用于融合、再生及誘變育種、遺傳轉化等后續實驗的濃度要求。另外,在原生質體純化時,過濾介質的選擇,以及洗滌原生質體沉淀時轉速的控制也明顯影響其最終得率。本實驗還用2~4層擦鏡紙作為過濾介質進行了實驗,發現原生質體損失率也較高,而離心洗滌原生質體時,轉速過低,不利于其有效沉淀,轉速過高又會造成其大量破裂。因此,選擇有效的過濾介質并優化適合試驗菌株的離心轉速尚待進一步探究。
[1] 朱堅. 食用菌品種特性與栽培[M]. 福州: 海峽出版發行集團, 2011: 292.
[2] 薛冰. 榆黃蘑的抗氧化性和榆黃蘑飲料的抗疲勞作用研究[天]. 延吉: 延邊大學, 2011.
[3] 王謙, 劉敏, 王亞從. 大球蓋菇原生質體制備及紫外誘變[J].河北大學學報(自然科學版), 2011, 31(4): 413-417.
[4] 韓麗華, 郭成金. 黃傘原生質體制備與再生條件研究[J]. 天津師范大學學報(自然科學版), 2008, ,28(4): 9-12.
[5] 孫露, 姚方杰, 方明. 原生質體制備與再生條件的研究[J]. 中國食用菌, 2012, 31(3): 35-37.
[6] 周繼陽, 王勇, 祝長青. 原生質體制備與再生條件的建立[J]. 食品研究與開發, 2012, 33(3): 152-155
Study on preparation and regeneration conditions ofprotoplasts
Zhang Yajiao1,2Chen Huaijie1Lu Muzao1Zhu Jian1,2*
(1.College of Horticulture, Fujian Agriculture and Forestry University, Fuzhou, 350002;2.Mycological Research Center of Fujian Agriculture and Forestry University, Fuzhou, 350002)
Theprotoplasts preparation and regeneration conditions were studied by single factor and orthogonal experiment. The highest protoplasts yield with 2.36×107mL-1could be obtained on these conditions:mycelium were cultured in the enriched PDA liquid medium for 5 days, then digested at 30 ℃ for 2.5 h by 2% lywallzyme enzyme that dissolved in 0.6 mol/L sucrose. And the best regeneration rate was 0.71% using sucrose as osmotic pressure stabilizer.
; protoplast; preparation; regeneration; orthogonal experiment
S646
A
2095-0934(2015)01-39-04
國家星火計劃重大項目食用菌產業升級與可持續發展技術體系示范(編號:3011GA720008)
張亞嬌(1989—),在讀碩士研究生,主要從事食用菌育種研究。E-mail:yajiao1010@126.com
朱堅(1964—),碩士生導師,教授,主要從事食用菌栽培、育種和加工方面的教學科研。E-mail:zhujian6469@126.com

