六味地黃丸抑制移植性原發性肝癌小鼠腫瘤生長的實驗研究
羅春蕾 顧怡中 鐘 薏 周榮耀
(上海市靜安區中心醫院中醫內科,上海 200040)
1 上海市普陀區中醫醫院老年科,上海 200062
2 上海中醫藥大學附屬曙光醫院腫瘤科,上海 200021
原發性肝癌(以下簡稱肝癌)是指發生在肝細胞或肝內膽管細胞的腫瘤,我國肝癌發病率居世界前列,以肝細胞癌為多,后者不足5%[1]。六味地黃丸是中醫臨床常用滋陰補腎的中藥方劑,有研究表明其對肝癌的治療也有顯著療效[2-3]。本實驗觀察六味地黃丸對移植性肝癌模型小鼠腫瘤細胞生長的影響,探討其對肝癌的作用機制,以期為肝癌的中醫藥治療提供客觀依據。
1 材料與方法
1.1 實驗材料
1.1.1 動物 昆明種小鼠30只,雄性,體質量(20±2)g,無特定病原體(SPF)級條件下飼養,由上海中醫藥大學動物實驗中心提供,購自上海斯萊克實驗用動物責任有限公司,動物合格證號SCXK(滬)2009-0069。
1.1.2 試劑及儀器 腹水型肝癌 H22細胞株(中國科學院上海細胞庫);血管內皮生長因子(VEGF)酶聯免疫吸附測定法(ELISA)試劑盒(美國 R&D公司);RPMI-1640培養液(美國Gibco公司);小牛血清(美國Hyclone公司);酶標儀(美國Biotek公司);流式細胞儀(美國貝克曼庫爾特公司)。
1.1.3 藥物 氟尿嘧啶注射液(5-FU,上海旭東海普藥業有限公司,國藥準字H31020593),超凈工作臺避光條件下,以無菌0.9%氯化鈉注射液稀釋至2 mg/mL,環氧樹脂(EP)管分裝,錫紙遮蓋,保存于4℃冰箱。六味地黃丸藥物組成:山藥12 g,澤瀉9 g,熟地黃12 g,山茱萸9 g,牡丹皮9 g,茯苓12 g。中藥生藥由上海中醫藥大學附屬曙光醫院中藥房提供,采用標準水煎提取,制成湯劑,蒸餾提取至含生藥2 mg/mL的水煎液,4℃冰箱保存備用。
1.2 實驗方法
1.2.1 造模及分組 腹水型肝癌H22細胞株由上海中醫藥大學生化與分子生物學實驗室完成預處理,接種于小鼠右前肢腋窩下,皮下注射種植。造模24 h后,將30只小鼠按隨機數字表法隨機分為模型組、5-FU組及實驗組,每組10只,以苦味酸標記,分籠飼養,每籠5只,自由飲食。
1.2.2 給藥方法 造模后第5 d給藥,模型組和實驗組小鼠按0.1 mL/10 g分別予蒸餾水及六味地黃丸湯劑灌胃,每日1次,連續灌胃10 d;5-FU組按照0.1 mg/10 kg予5-FU腹腔注射,隔日1次,治療10 d。
1.3 觀察指標及方法
1.3.1 腫瘤表觀擴散系數(ADC) 各組小鼠造模后第14 d禁食1 d,第15 d稱取體質量,予0.5%戊巴比妥鈉0.1 mL/10 g腹腔注射麻醉,麻醉完成后進行核磁共振成像(MRI)檢查。由2位MRI診斷專家采用雙盲法測量各組小鼠ADC值,結合T1WI(T1加權像)及T2WI(T2加權像),選取病灶最大層面,在ADC圖上選取病灶實性部分,手工繪制橢圓形感興趣區(ROI),測量腫瘤實質部分的ADC值。若觀測者測量結果出現較大分歧,另由1位高年資經驗豐富的MRI診斷專家復核測量。
1.3.2 血清 VEGF 血清 VEGF的測定采用ELISA法。造模后第16 d,各組小鼠摘眼球取不抗凝血,血液樣本于2 h內以5 000 r/min速度離心20 min,離心后去血清,-20℃保存。
1.3.3 體質量、去瘤體質量、腫瘤質量、腫瘤指數及腫瘤生長抑制率(抑瘤率) 各組小鼠體質量固定于每日給藥前測定。各組小鼠摘眼球取血后脫頸椎處死,剖取瘤體,測定瘤體質量。去瘤體質量=處死前小鼠體質量-瘤體質量。腫瘤指數=瘤體質量/去瘤體質量。抑瘤率=[1-(用藥組瘤體質量/模型組瘤體質量)]×100%。
1.3.4 腫瘤細胞凋亡及細胞周期檢測 各組小鼠均取新鮮腫瘤組織0.5~1.0 g,由上海中醫藥大學生化與分子生物學實驗室采用流式細胞儀檢測肝癌細胞凋亡百分比,觀察細胞周期。
1.4 統計學方法 應用SPSS 16.0軟件進行統計學分析,計量資料用均數±標準差(ˉx±s)表示,組間比較先采用方差分析進行顯著性檢驗;多組樣本均數間兩兩比較采用q檢驗;非參數檢驗采用χ2檢驗。
2 結果
2.1 各組小鼠體質量及去瘤體質量比較 見表1。
表1 各組小鼠體質量及去瘤體質量比較g,±s
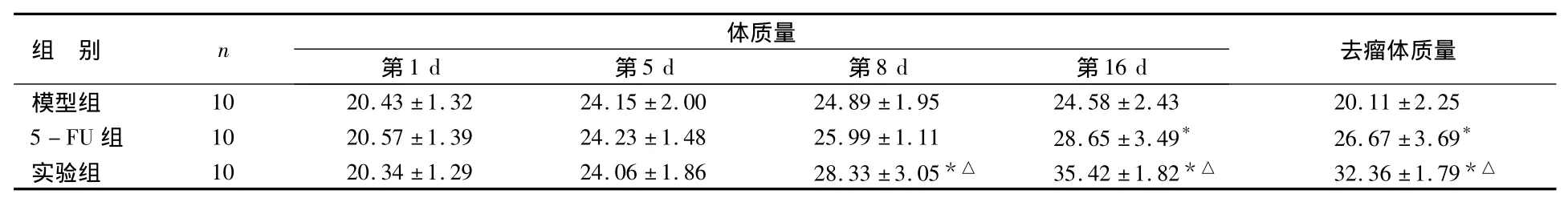
表1 各組小鼠體質量及去瘤體質量比較g,±s
與模型組比較,*P <0.05;與5-FU 組比較,△P <0.05
組 別 n體質量第1 d 第5 d 第8 d 第16 d 去瘤體質量模型組 10 20.43 ±1.32 24.15 ±2.00 24.89 ±1.95 24.58 ±2.43 20.11 ±2.25 5-FU 組 10 20.57 ±1.39 24.23 ±1.48 25.99 ±1.11 28.65 ±3.49* 26.67 ±3.69*實驗組 10 20.34±1.29 24.06±1.86 28.33±3.05*△ 35.42±1.82*△ 32.36±1.79*△
由表1可見,造模后第8 d,實驗組小鼠體質量均高于5-FU組及模型組(P<0.05),5-FU組與模型組體質量相當(P>0.05);造模后第16 d,實驗組及5-FU組小鼠體質量及去瘤體質量均高于模型組(P<0.05),且實驗組比5-FU組高出更明顯(P <0.05)。
2.2 各組小鼠腫瘤質量、腫瘤指數及抑瘤率比較見表2。
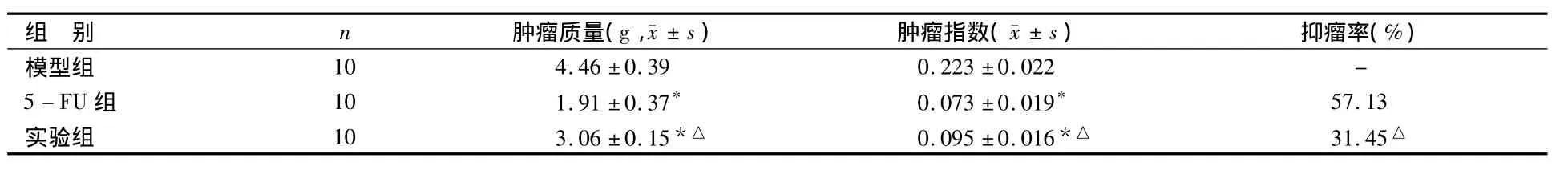
表2 各組小鼠腫瘤質量、腫瘤指數及抑瘤率比較
由表2可見,各組小鼠腫瘤質量及腫瘤指數比較,實驗組均低于模型組(P<0.05),均高于5-FU組(P<0.05),各組組間比較差異均有統計學意義(P<0.05);實驗組與5-FU組抑瘤率比較,實驗組低于5-FU組(P<0.05)。
2.3 各組小鼠腫瘤細胞凋亡及細胞周期所占百分比比較 見表3。
表3 各組小鼠腫瘤細胞凋亡及細胞周期所占百分比比較%,±s

表3 各組小鼠腫瘤細胞凋亡及細胞周期所占百分比比較%,±s
與模型組比較,*P <0.05;與5-FU 組比較,△P <0.05
組 別 n 細胞凋亡細胞周期G0-G1期 S期 G2-M期模型組 10 3.628 ±2.150 46.13 ±6.39 38.61 ±8.43 15.27 ±7.11 5-FU 組 10 24.296 ±2.748* 70.77 ±13.21* 15.33 ±6.10* 13.62 ±7.95實驗組 10 10.670±2.318*△ 57.50±5.86*△ 33.07±4.67△9.44 ±4.09
由表3可見,各組小鼠腫瘤細胞凋亡百分比比較,實驗組高于模型組(P<0.05),低于5-FU組(P<0.05),各組組間比較差異均有統計學意義(P<0.05)。各組小鼠細胞周期百分比比較,實驗組G0-G1期細胞高于模型組(P<0.05),低于5-FU組(P<0.05),各組組間比較差異均有統計學意義(P<0.05);實驗組S期細胞高于5-FU組(P <0.05),與模型組相當(P >0.05);各組G2-M期細胞組間比較差異均無統計學意義(P >0.05)。
2.4 各組小鼠血清VEGF水平及ADC值比較表4。
表4 各組小鼠血清VEGF水平及腫瘤ADC值比較 ±s

表4 各組小鼠血清VEGF水平及腫瘤ADC值比較 ±s
與模型組比較,*P <0.05;與5-FU 組比較,△P <0.05
組 別 n VEGF(pg/mL) ADC(mm2/s)模型組10 34.385 6 ±5.370 3 1421.058 ±159.903 5-FU 組 10 15.895 1 ±2.907 1* 743.777 ±104.882*實驗組 10 18.725 4±0.936 8*△ 940.376±124.263*△
由表4可見,各組小鼠血清VEGF水平及ADC值比較,實驗組均低于模型組(P<0.05),均高于5-FU組(P<0.05),各組組間比較差異均有統計學意義(P<0.05)。
3 討論
肝癌是我國最常見的惡性腫瘤之一,病因尚不完全清楚,易復發、轉移,死亡率高。VEGF是迄今為止已知人體內最強的血管生成因子[4],能直接或間接參與血管生成,大量臨床研究顯示,VEGF高表達與腫瘤惡性程度及患者預后不良密切相關[5]。因此,抗腫瘤血管生成藥物的研制和應用廣受國內外醫藥界關注,并有一些藥物應勢而生,但仍然存在一些問題不容忽視,因VEGF亞型較多,其作用機制尚未完全明晰,長期服用該類藥物是否會造成其他難以估測的損傷尚不明確[4]。氟尿嘧啶在體內先轉變為5-氟-2-脫氧尿嘧啶核苷酸,后者可抑制胸腺嘧啶核苷酸合成酶,阻斷脫氧尿嘧啶核苷酸轉變為脫氧胸腺嘧啶核苷酸,從而抑制DNA的生物合成,抑制腫瘤生長[6]。
影像學檢查是肝癌動物模型實驗的重要技術手段,彌散成像作為一種無創性成像技術,可根據組織的水分子張力差,別即擴散受限程度的不同進行成像,通過檢測生物體內水分子運動狀態的改變而間接反映組織結構和細胞密度等信息,提供的ADC值能消除T2穿透效應,提供量化指標,從分子水平分析組織內部特征以及對治療的反應[7]。腫瘤細胞增生活躍時,細胞、血管外周間隙增大,水分子擴散受限較低,故表現出較高的ADC值;而細胞發生凋亡時,胞漿濃縮,細胞固縮,細胞外周間隙相對偏小,水分子自由擴散受限較高,表現出較低的ADC值。
中醫學認為,肝癌之病位在肝,常累及周身。肝、腎母子相生,精血同源,且同寄相火,藏瀉互用,一者為病,常累及余者。又腎為先天之本,乃臟腑陰陽之根本,古有“久病及腎”之說,肝、腎功能息息相關,一榮俱榮,一辱俱辱,故在治法上有“乙癸同源,肝腎同治”之說,發展至今,于臨床廣為應用[8-9]。六味地黃丸為肝、腎同治的代表方。宋·錢仲陽論“腎主虛,無實也”,以腎氣丸裁桂枝、附子,成六味地黃此通補開闔之劑,大補肝、脾、腎,用治各類疾病過程中出現的腎陰虧損,或肝腎不足之證。六味,即苦、酸、甘、咸、辛、淡者也。熟地黃味苦,入腎,大補腎之精血,固封蟄之本;山茱萸味酸,入肝,補肝固精,緩罷極之牢;山藥味甘,入脾,健脾助運。此3味以后天之精助先天之用,謂曰“三補”。古人用補,必兼瀉邪,邪去則補方得力。方中“三瀉”即指澤瀉、牡丹皮、茯苓。澤瀉味咸,入膀胱,泄腎濁,兼制熟地黃之滋膩,開氣化之源,助熟地黃填少陰、太陽之精;牡丹皮味辛,入膽,清中正之氣,制山茱萸之溫,佐其補厥陰、少陽之精;茯苓味淡,入胃,利出入之器,滲脾利濕,以助山藥養脾陰,補太陰、陽明之精。三補三瀉合用,通方滋而不膩,相和相濟,不燥不寒,清·張秉成謂之曰“王道之方”。臨床研究表明,六味地黃可應用于腫瘤患者的放化療、手術前后、內分泌治療等多個階段,具有減毒、增效作用,可協同抑制腫瘤細胞生長和擴散,提高患者生活質量,調節機體免疫功能[10]。
本研究結果顯示,六味地黃丸可抑制肝癌小鼠腫瘤生長,對于細胞周期亦有影響,可促進腫瘤細胞凋亡,促使G0-G1期細胞聚集,減少S期細胞,干擾了小鼠肝癌細胞在細胞周期中的進程,鑒于細胞周期的調控復雜未明,因此具體的作用機制仍有待探究。六味地黃丸可抑制血清VEGF的表達,降低腫瘤ADC值,提示其抗癌作用可能與下調VEGF水平相關。綜上所述,六味地黃丸可明顯抑制肝癌小鼠瘤體生長,影響瘤體細胞周期,誘導小鼠肝癌細胞凋亡,降低血清VEGF水平,降低腫瘤ADC值,從而產生良好的抗腫瘤作用。
[1] 王吉耀.內科學(上冊)[M].北京:人民衛生出版社,2008:513.
[2] 周斌,曾柏榮.六味地黃丸在腫瘤治療中的作用[J].腫瘤基礎與臨床,2010,23(1):91-93.
[3] 任怡.六味地黃湯對小鼠原發性肝癌模型的作用機制研究[J].湖南中醫雜志,2013,29(2):124-126.
[4] 鄒文員,張自力.血管內皮生長因子與原發性肝癌血管新生關系及抗血管治療的進展[J].放射學實踐,2009,24(3):338-339.
[5] 羅春蕾,周榮耀.補腎健脾方治療肝腎陰虛兼脾氣虛肝癌30 例[J].中醫研究,2010,23(6):30-32.
[6] 高君,程研,孔健,等.氟尿嘧啶植入劑對H22肝癌移植瘤射頻消融后殘留癌的抑制作用及其機制[J].中華實驗外科雜志,2011,28(8):1299-1302.
[7] 汪洋,林從堯,周夏.大腸癌中β-catenin表達及與COX-2、VEGF表達的關系[J].腫瘤防治研究,2006,33(1):20-22.
[8] 張怡.原發性肝癌與脾腎關系之病機淺探[J].新中醫,2011,43(2):4-5.
[9] 譚程,李曉君.肝腎相關的病機及治療規律探討[J].北京中醫藥大學學報:中醫臨床版,2007,14(2):28-30.
[10] 周斌,曾柏榮.六味地黃丸在腫瘤治療中的作用[J].腫瘤基礎與臨床,2010,23(1):91-93.

