重組人鼠嵌合抗CD20單克隆抗體免疫原性檢測方法的建立
孟慶芳 ,馬志強,陳知航,李麗,劉運龍,單成啟,錢小紅,程遠國
1.北京理工大學 生命學院,北京 100081;2.軍事醫(yī)學科學院 微生物流行病研究所,北京 100071;3.軍事醫(yī)學科學院 放射醫(yī)學研究所,國家蛋白質組學重點實驗室,北京蛋白質組研究中心,北京 102206
CD20是B淋巴細胞表面特異性抗原之一,在淋巴細胞分化早期表達并且能激活淋巴細胞,導致淋巴細胞增殖分化。CD20 分子在95%以上的B 細胞性非霍奇金淋巴瘤(NHL)中均有表達,是治療B 細胞淋巴瘤的理想靶點[1]。人鼠嵌合抗CD20抗體由鼠抗CD20抗體可變區(qū)肽段和人抗體IgG1恒定區(qū)肽段組成,臨床實驗證明治療效果明顯且副反應小,已經(jīng)被美國FDA批準投入市場,商品名為Rituximab[2]。
本研究選擇實驗室構建并表達的重組抗CD20人鼠嵌合單克隆抗體TSLXK 進行。這種嵌合抗體雖然通過人源化改造,減少了鼠源組分,但給藥后仍然存在一定程度的免疫反應,導致抗藥物抗體(antidrug antibody,ADA)產生,尤其是在臨床前動物實驗中,由于種屬差異,抗體更易產生。在治療性蛋白質藥物臨床應用過程中,應對免疫原性給予關注,多家國際權威機構就蛋白質藥物免疫原性的評價發(fā)布了指導原則[3-5]。美國FDA 建議采用多重檢測法評價抗體藥物的免疫原性,建立一種靈敏度高、操作簡單快捷、通量高的篩選法,對臨床樣品進行初步篩選,篩選呈陽性結果的樣品還須進一步采用確證法確定檢測抗體特異性結合藥物抗體[6-7]。目前,抗體藥物免疫原性檢測方法很多,如橋連ELISA法、間接ELISA 法、放射免疫沉淀法(RIP)、表面等離子共振法(SPR)等,各種方法都具有其優(yōu)缺點。
為評價TSLXK 的免疫原性,我們建立了橋連ELISA法,對TSLXK臨床前樣品進行篩選,再以免疫清除法和交叉試驗進行確證,實驗結果顯示該檢測體系靈敏度高、重復性好、通量高,有望進一步應用于將來的臨床試驗研究。
1 材料和方法
1.1 材料
供試品重組人鼠嵌合抗CD20 單克隆抗體(TSLXK,批號20140402)及原研對照品利妥昔單抗注射液(Rituximab Injection Mabthera,批號H0135/SH0078)均由正大天晴藥業(yè)集團股份有限公司提供,每瓶100 mg/10 mL,2~8℃避光保存;陽性抗藥物抗體(鼠抗Rituximab 單抗,批號300914)購自BIO-RAD 公司,-20℃保存;空白食蟹猴血清由北京協(xié)爾鑫生物資源研究所提供;生物素標記試劑盒購自Dojindo Molecular Technologies 公司;辣根過氧化物酶標記鏈霉親和素(Streptavidin-HRP)購自R&D Systems公司;其他試劑均為國產分析純產品。
磷酸鹽 緩沖液(PBS,pH7.4):16 g NaCl、0.4023 g KCl、2.84 g Na2HPO4、0.544 g KH2PO4,溶解于2 L ddH2O;封閉液:用PBS配置5%脫脂奶粉;稀釋液:用PBS 配制1%牛血清白蛋白(BSA)溶液;顯色液:TMB 底物液A 液與B 液等體積混合;1 mol/L 硫酸終止液:將20.8 mL 硫酸緩慢加入100 mL 蒸餾水中,邊加邊攪拌;PBST 洗板液:將0.5 mL Tween-20加入999.5 mL PBS中。
1.2 對照品及血清樣本制備
用含10%食蟹猴空白血清的PBS稀釋液將鼠抗Rituximab 抗體分別稀釋至320、80、10 ng/mL,作為高、中、低濃度陽性對照樣品;空白猴血清用PBS 稀釋至1/10 作為陰性對照樣品;血清樣本用PBS 稀釋至1/10待測。
1.3 篩選法(橋連ELISA法)
用PBS 磷酸鹽緩沖液將TSLXK 或Rituximab 稀釋至5 μg/mL,100 μL/孔,4℃包被過夜;PBST 洗板3 次,用5%脫脂奶粉封閉,300 μL/孔,室溫孵育2 h;PBST洗板3次,拍干,分別加入100 μL待測樣品、陰性對照品及陽性對照品各3~6 孔,室溫孵育1 h;PBST洗板3次,用1% BSA稀釋生物素標記TSLXK/Rituximab 至1/10 萬,100 μL/孔,室溫孵育1 h;PBST洗板3次,用1% BSA稀釋Streptavidin-HRP至1/200,100 μL/孔,室溫孵育20 min;PBST洗板4次,TMB 顯色,100 μL/孔,室溫反應15 min;加終止液100 μL/孔,終止反應;酶標儀測定D450/560mm值。
1.4 確證法(免疫清除法)
篩選法檢測結果為陽性的樣本進一本采用此法進行確證。用PBS 將TSLXK 或Rituximab 稀釋至5 μg/mL,100 μL/孔,4℃包被過夜;PBST 洗板3 次,用5%脫脂奶粉封閉,300 μL/孔,室溫孵育2 h;TSLXK初篩為陽性的食蟹猴血清樣品分別用PBS 和900 μg/mL 的TSLXK 或Rituximab 稀釋至1/10,待 測;PBST洗板3次,拍干,分別加入100 μL待測樣品、陰性對照品及陽性對照品,室溫孵育1 h;PBST 洗板3次,用1% BSA 稀釋生物素標記TSLXK/ Rituximab至1/10 萬,100 μL/孔,室溫孵育1 h;PBST 洗板3次,用1% BSA 稀釋Streptavidin-HRP 至1/200,100 μL/孔,室溫孵育20 min;PBST洗板4次,TMB顯色,100 μL/孔,室溫反應15 min;加終止液100 μL/孔,終止反應;酶標儀測定雙波長D450/560mm值。
1.5 免疫交叉
為了考察ADA 對TSLXK 和Rituximab 的免疫反應有無差異,將初篩結果呈陽性的血清樣品交換包被藥物,重新測定。在篩選法中,TSLXK 和Rituximab 給藥組動物血清分別采用TSLXK 和Rituximab包板進行檢測;在免疫交叉反應中,則采用TSLXK包板檢測Rituximab 給藥組動物血清,采用Rituximab包板檢測TSLXK給藥組動物血清,進而與初篩結果進行對比。
2 結果
2.1 篩選(橋連ELISA法)
2.1.1 臨界值的確定 臨界值(cut-off)是判定樣品陰陽性的臨界點,高于臨界值判定為陽性,低于臨界值則判定為陰性。對32 只健康正常食蟹猴血清樣品進行橋連ELISA法測定,樣品平行測定3次,結果見圖1。臨界值等于每批測定的血清樣品平均值加2 倍標準差。由3 批供試品TSLXK 測得的數(shù)據(jù)得到的臨界值分別為0.0143、0.0142、0.0144,取其均值,臨界值設為0.0143;3 批原研對照品Rituximab 測得的數(shù)據(jù)得到的臨界值均為0.0124,其臨界值設為0.0124。
2.1.2 臨界值的歸一化 不同檢測批次的臨界值不盡相同,為了得到更準確的判定結果,F(xiàn)DA建議對臨界值進行歸一化。根據(jù)Anthony介紹的歸一化方法,臨界值可進行歸一化的必要條件是每批測定的血清樣本信號值(即D450/560mm值)標準偏差一致。對32 只食蟹猴血清樣品進行3次平行檢定,經(jīng)方差分析,各組間的P值均大于0.05(置信區(qū)間95%),說明不同批次測定的血清樣品信號值標準偏差一致,滿足歸一化條件。單一檢測批次臨界值等于本批次陰性對照樣品平均D450/560mm值+歸一化因子。其中歸一化因子為上述臨界值減去陰性對照品平均D450/560mm值,TSLXK 檢測的臨界值為0.0143,陰性血清D450/560mm值為0.0107,歸一化因子為0.0036;Rituximab檢測的臨界值為0.0124,陰性血清D450/560mm值為0.0097,歸一化因子為0.0027。
2.1.3 檢測靈敏度 本實驗采用鼠抗Rituximab 抗體作為陽性對照品,以反映該方法的靈敏度。用含10%食蟹猴空白血清的PBS緩沖液將鼠抗Rituximab抗體分別稀釋為400、200、100、50、25、12.5、6.25 ng/mL。取100 μL上述標準樣品加入預先處理的酶標板中(方法詳見1.3),根據(jù)標準曲線計算臨界值所對應的陽性抗體濃度,即為該方法的檢測限。
以濃度為橫坐標、D450/560mm值為縱坐標,雙對數(shù)作圖,線性回歸得到標準曲線(圖2)。TSLXK 臨界值(0.0143)所對應抗體濃度為0.35 ng/mL,因為血清樣品測定時須稀釋至1/10,故該方法測定血清中實際抗TSLXK抗體的檢測靈敏度為3.5 ng/mL;對照品Rituximab 臨界值(0.0124)所對應的濃度也是0.35 ng/mL,故該方法測定血清中實際抗Rituximab 抗體的檢測靈敏度為3.5 ng/mL。
2.1.4 精密度與準確度 精密度表示測定值之間的一致性或接近程度,一般用相對標準偏差(CV)表示;準確度表示測定值與真實值之間的符合程度,一般用相對誤差(RE)表示。對陽性高、中、低對照進行3 次重復檢測,每個濃度6 個平行孔,經(jīng)計算不同濃度樣本的板內或板間的CV均小于10%,板內或板間的RE均介于±10%之間(表1),說明該方法具有較高的精密度與準確度,滿足方法學要求
2.1.5 血藥濃度對檢測方法的影響 血樣中存在的藥物(TSLXK 或Rituximab)有可能會影響ADA 的檢測,因此需要考察樣品中存在的TSLXK或Rituximab對免疫原性檢測方法的影響程度。用含10%猴血清的PBS 將TSLXK 分別稀釋至5000、1000、200、40、8、1.6 μg/mL,將Rituximab 分別稀釋至320、64、12.8、2.56、0.512、0.102 ng/mL,進而用梯度稀釋的上述含藥溶液將鼠抗Rituximab 陽性抗體稀釋至320、80 和10 ng/mL,取100μL 加入已包被的酶標板孔中。圖3 為不同濃度的TSLXK 和Rituximab 對檢測方法的影響。結果顯示,二者的影響趨勢基本相同,隨著血中TSLXK或Rituximab濃度的增高,含有陽性抗體的樣品的檢測信號值逐漸降低,當藥物濃度增加到一定程度時,檢測信號值突降至臨界值以下,產生假陰性結果(本批次臨界值分別為0.0194和0.0148)。陽性樣本所含ADA 濃度越高(從10、80 到320 ng/mL),能夠耐受的血清藥物濃度越高(分別對應12.8、64和320 ng/mL),血清藥物濃度一旦超過耐受濃度,則檢測結果轉為陰性。
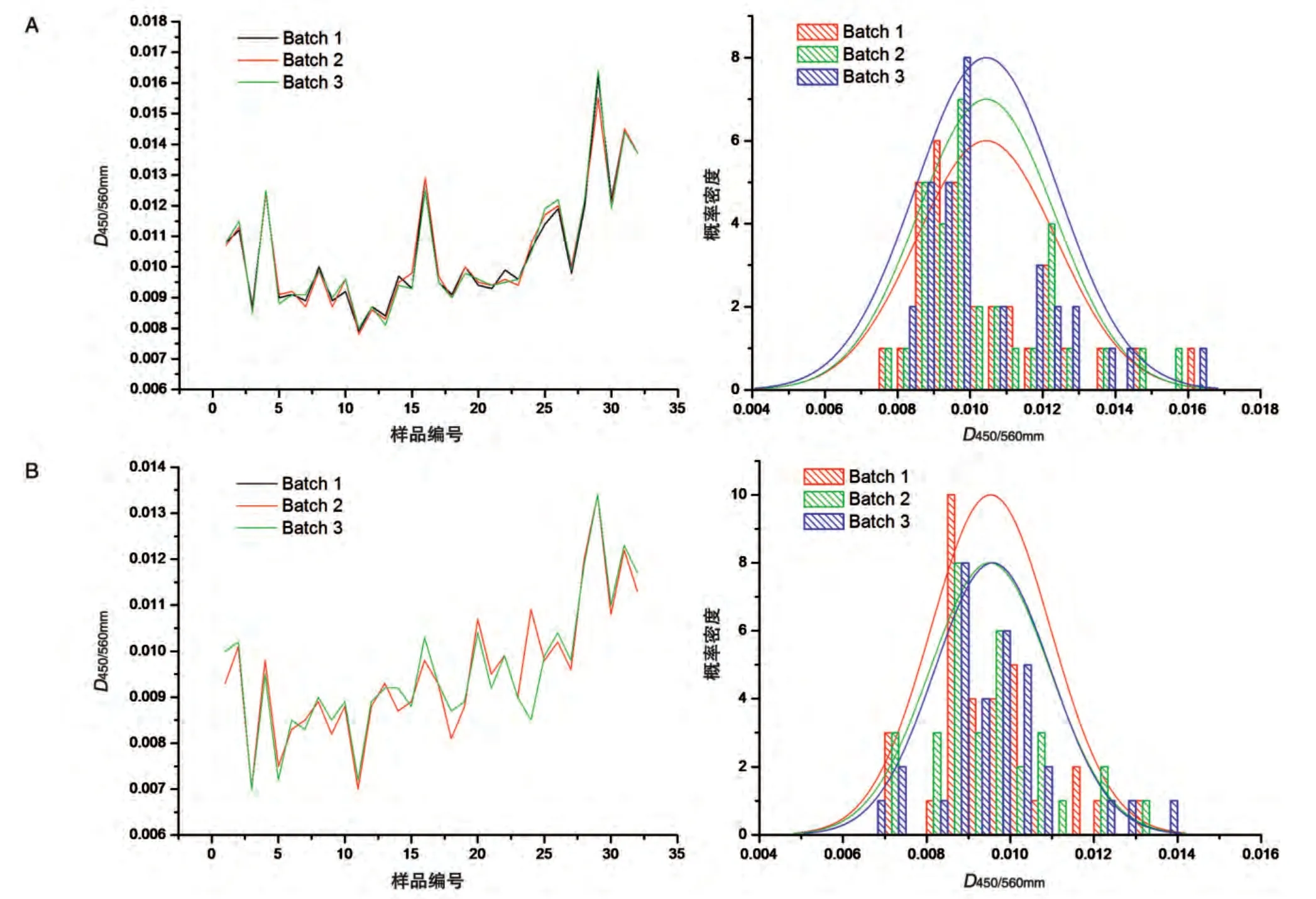
圖1 食蟹猴血清樣品不同檢定批次的D450/560mm值波動及分布圖(n=32)
2.2 篩選法檢測結果
表2 為食蟹猴TSLXK 重復靜脈給藥4 周、停藥恢復8 周毒性實驗中動物的分組情況,給藥期每組10 只動物(d29 前),恢復期每組4 只動物(d29 后)。表3為毒代樣本中ADA檢測結果,測定D450/560mm值大于本批次臨界值時,結果判定為陽性(+),否則判斷為陰性(-)。結果顯示TSLXK低劑量給藥組從給藥后第15 d開始陸續(xù)檢測到ADA,且動物抗體產生率達到90%;中劑量組僅有1 只在藥后22 d 開始檢測到抗體,另有2 只在最后一個檢測時間點產生抗體(d119);高劑量組無抗體產生。Rituximab 陽性對照組也有1 只動物在藥后22 d 開始出現(xiàn)抗體,一直維持到實驗結束。
2.3 確證法檢測結果
采用免疫清除法確證篩選法檢測結果呈陽性的血清樣品中是否確實含有抗藥物抗體。在檢測結果呈陽性的血清樣品中加入過量TSLXK,若樣品中含有ADA,則過量的TSLXK與包被的TSLXK競爭結合ADA,洗滌過程可將該部分液相中的結合抗體去除,包被TSLXK上結合的ADA減少,最終導致信號值降低。若加入過量TSLXK后信號值無顯著差異,陽性結果可能是血清基質非特異性結合所致。
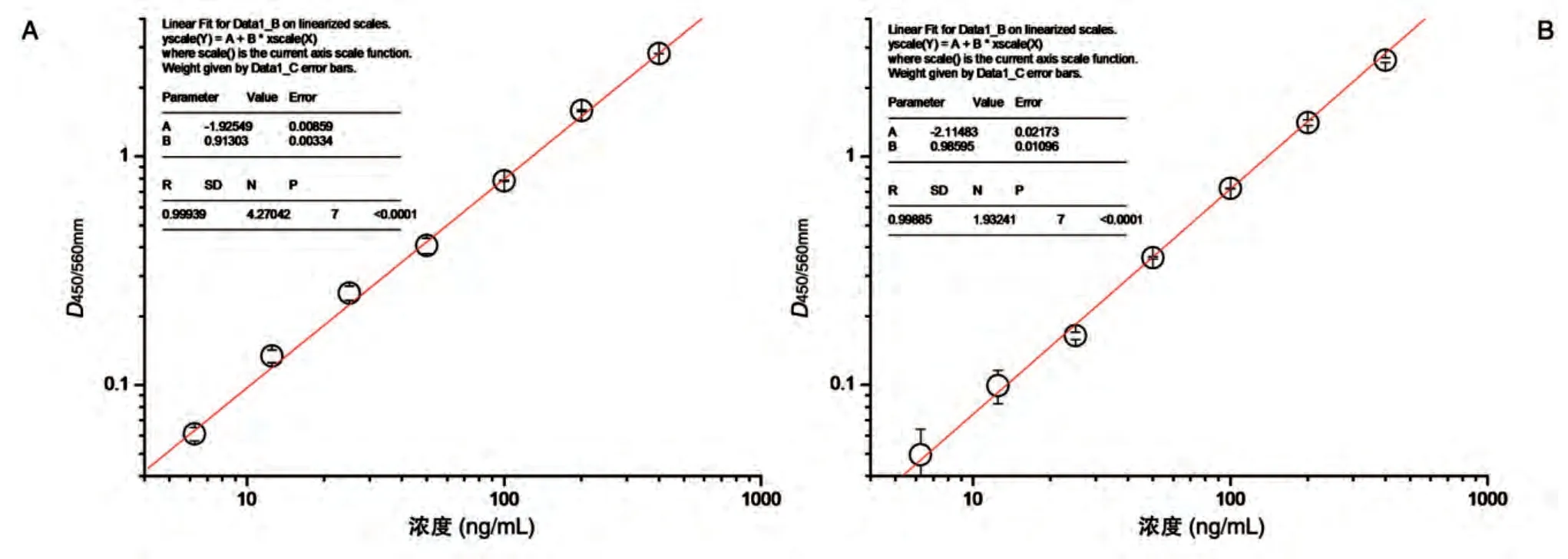
圖2 供試品與對照品橋連ELISA法檢測的標準曲線
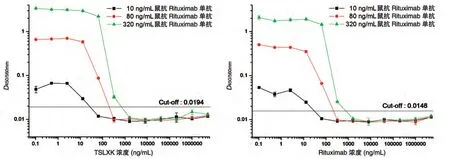
圖3 TSLXK及Rituximab血藥濃度對橋連ELISA法檢測抗藥物抗體的影響
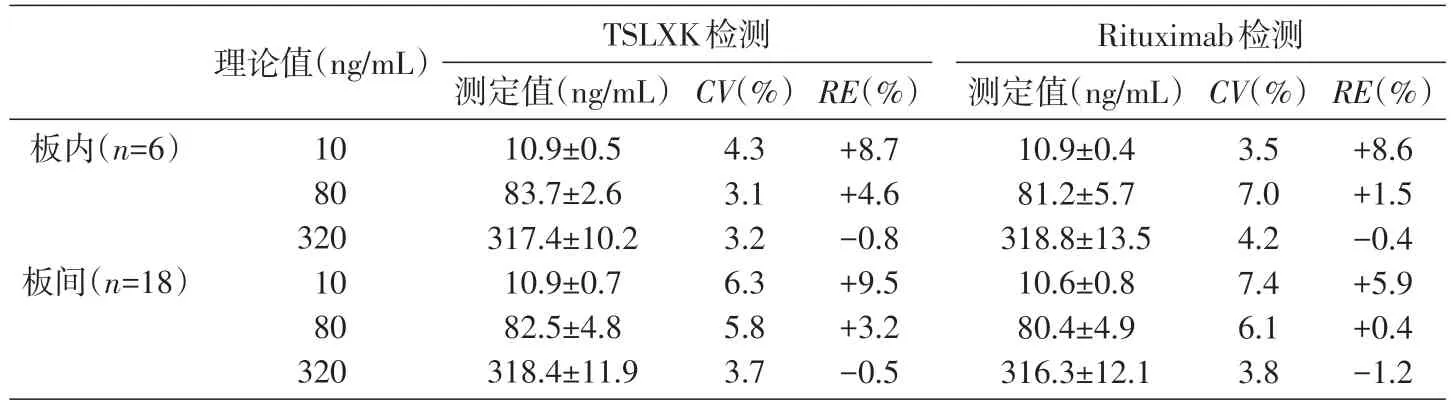
表1 橋連ELISA法檢測的板內和板間精密度與準確度
對篩選法檢測結果呈陽性的各采血點血清樣品進行免疫清除試驗,結果見圖4,以不加TSLXK的檢測孔所得D450/560mm值為橫坐標,以同一樣本加入過量TSLXK后所得D450/560mm值為縱坐標,繪制全部44個初篩為陽性樣本的散點圖。結果顯示,不加TSLXK時,初篩為陽性的全部44個樣品點D450/560mm值均大于臨界值(0.0145),介于0.189到3.648之間;當加入過量TSLXK后,信號值均顯著降低,僅有3個樣本點略高于臨界值,其余均轉為陰性。證實陽性樣品中確實含有抗TSLXK或Rituximab的特異性抗體。
2.4 免疫交叉反應
TSLXK 和Rituximab 給藥組動物血清在篩選法中分別采用TSLXK和Rituximab包板進行檢測,初篩結果呈陽性的血清樣品進一步交換包被藥物,重新測定,考察ADA 對TSLXK 和Rituximab 的免疫反應有無差異。以TSLXK 包被并檢測所得D450/560mm值為橫坐標,同一樣本用Rituximab 包被并檢測所得D450/560mm值為縱坐標繪圖(圖5),結果顯示供試品/原研對照品連續(xù)給藥在食蟹猴體內均可以引發(fā)抗體產生,且二者與二者產生的抗體間存在交叉反應。2種檢測方法均可以檢測抗體,檢測數(shù)值比較接近,在散點圖上呈現(xiàn)一定的線性回歸趨勢。
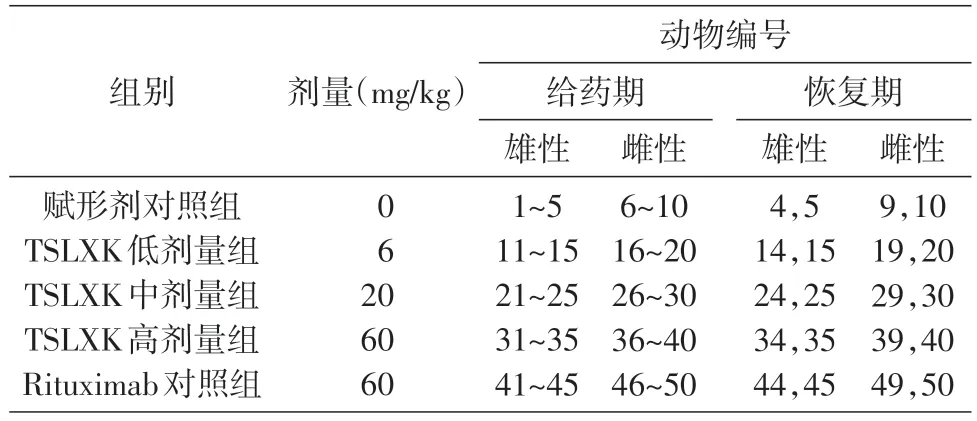
表2 TSLXK重復靜脈給藥4周、停藥恢復8周毒性實驗動物分組
2.5 抗體滴度檢測
將經(jīng)免疫確證后的陽性樣本進行一系列梯度稀釋,直至稀釋至檢測結果為陰性,則前一個滴度即為血清中抗TSLXK 和Rituximab 抗體的滴度。結果顯示食蟹猴血清抗體的滴度從1∶40~1∶1280 不等,隨時間延長,抗體滴度逐漸升高,給藥后第119 d(最后一個檢測時間點)抗體滴度達到最高值1∶1280。
3 討論
隨著基因重組技術的引入,將抗體可變區(qū)轉移至另一個抗體,使克服或減少鼠克隆抗體的某些局限性成為可能,將鼠抗體的可變區(qū)轉移至人抗體的恒定區(qū)可以明顯減少鼠源組分(大約減少2/3),從而生產一種被稱為嵌合單克隆抗體的抗體。這種嵌合抗體盡管大大減少了鼠源部分,但仍然存在免疫反應。本研究建立了檢測食蟹猴血清中抗CD52 單克隆抗體免疫原性的檢測方法并進行了確證,結果顯示TSLXK與Rituximab連續(xù)給藥后,部分個體產生針對TSLXK和Rituximab的特異性抗體,且隨時間延長抗體滴度逐漸增高。低、中、高劑量組隨劑量的增加,抗體產生率明顯降低,說明連續(xù)靜脈給予抗CD20單克隆抗體后,劑量對抗體的產生存在較大影響,低劑量連續(xù)給藥更易誘發(fā)抗體產生。TSLXK 和Rituximab 相同劑量給藥后,TSLXK 沒有抗體產生,而對照品Rituximab 卻有1 只動物出現(xiàn)抗體,考慮到動物樣本數(shù)有限且動物本身存在較大的個體差異,要判斷差異存在,尚須進一步研究。

表3 TSLXK重復靜脈給藥4周、停藥恢復8周抗藥物抗體檢測結果
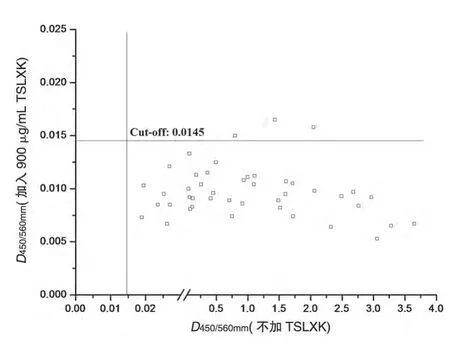
圖4 食蟹猴給藥4周恢復8周抗體陽性采血點確證法檢測結果(n=44)
圖5 食蟹猴給藥4周恢復8周抗體陽性采血點免疫交叉反應(n=44)
由于抗CD20單抗在體內半衰期較長,一段時期內猴體內會存在較高的血藥濃度,需要考察血藥濃度對ADA檢測的影響。方法學確證表明,供試品和原研對照品血清中的藥物濃度對抗體檢測的影響水平一致,陽性樣本所含ADA 濃度越高,能夠耐受的血清藥物濃度越高,血清藥物濃度一旦超過耐受濃度,則檢測結果轉為陰性。藥物與ADA本質上均為抗體,兩者分子大小接近,提示體外ELISA 實驗中,藥物與ADA 的結合比例接近1∶1,一旦血清中所含藥物超過所含ADA,即可干擾ADA 的檢測,產生假陰性結果。血藥濃度較高時雖然對抗體檢測有影響,但只是增加了假陰性率,不會增加假陽性率,所以檢測結果為陽性的樣本是可信的。
橋連ELISA法只是作為大量臨床樣品免疫原性的初篩,若樣品檢測結果為陽性,還須采用確證法確證血清中抗CD20 單抗特異性抗體的存在。本實驗采用免疫清除作為確證方法,降低了假陽性的發(fā)生。橋連ELISA 和免疫清除法的聯(lián)合,可以更好更客觀地評價藥物的免疫原性,也是目前國內臨床常用的方法之一。根據(jù)新的指導原則,免疫原性檢測過程中需要加入免疫交叉試驗,本實驗將實驗中檢測并確證為陽性抗體的樣本進行了免疫交叉試驗,結果表明,供試品/原研對照品連續(xù)給藥在食蟹猴體內均可以引發(fā)抗體產生,且二者與二者產生的抗體間存在較高的交叉反應率,這從另一方面證實供試品與原研對照品的結構和免疫反應性高度一致。
[1]Jemal A,Siegel R,Ward E,et al.Cancer statistics,2008[J].CA Cancer J Clin,2008,58(2):71-96.
[2]Pescovitz M D.Rituximab,an anti-CD20 monoclonal antibody:history and mechanism of action[J].Am J Transplantation,2006,6:859-866.
[3]Guidance for industry:assay development for immunogenicity testing of therapeutic proteins[EB/OL].http://www.fda.gov/downloads/drugs/guidancecomplianceregulatoryinformation/guidances/ucm192750.pdf,2009.
[4]Guidance on immunogenicity assessment of biotechnology-derived therapeutic protein[EB/OL].http://www.ema.europa.eu/docs/en_GB/document_library/Scientific_guideline/2009/09/WC500003 46.pdf,2007.
[5]周海鈞.藥品注冊的國際技術要求(安全性部分)[M].北京:人民衛(wèi)生出版社,2001:121-134.
[6]Kelley M,Ahene A B,Gorovits B,et al.Theoretical considerations and practical approaches to address the effect of antidrug antibody on quantification of biotherapeutics in circulation[J].AAPS J,2013,15(3):646-658.
[7]Guidance for industry:bioanalytical method validation[EB/OL].http://www.fda.gov/ucm/groups/fdagov-public/@fdagov-drugs-gen/documents/document/ucm368107.pdf,2013.

