利用CRISPR/Cas9n系統敲除人源SNF5基因
孫琰,劉超,毛赟赟,王璽
1.天津醫科大學 基礎醫學院,天津 300070;2.軍事醫學科學院 生物工程研究所,北京 100071
成簇的規律間隔的短回文重復序列(clustered regularly interspaced short palindromic repeats,CRISPR)是細菌的一種獲得性免疫系統,用以保護細菌和古細菌不受病毒侵害。細菌被病毒侵染后,CRISPR關聯蛋白(CRISPR-associated proteins,Cas)位點會編碼多個核酸酶和解旋酶,形成Cas 蛋白復合物,對入侵的病毒DNA 進行切割,產生的新片段會整合到CRISPR重復序列中,從而對該病毒產生特異性免疫記憶[1-2]。當細菌再次遭到該病毒入侵時,便會轉錄出與入侵病毒DNA 序列相匹配的小分子RNA,Cas 蛋白復合物利用這些RNA 去切割外源病毒DNA,導致病毒不能在細菌內進行復制。CRISPR/Cas9 系統是基于細菌和古細菌的這種免疫防御機制而改造的一種基因組編輯技術[3],利用人工設計的單向導RNA(single-guide RNA,sgRNA)介導外源Cas9 蛋白與靶基因結合,切割帶有5'-NGG 的間隔相鄰基序(protospacer adjacent motifs,PAM),從而實現對靶基因DNA的特異性切割[4]。
表觀遺傳在癌癥發生發展中有重要作用,染色質重塑是表觀遺傳的重要機制之一,染色質重塑復合物通過水解ATP 產生的能量來改變染色質結構,進而調節基因表達。染色質重塑復合物是較大的多亞基復合物,已知有SWI/SNF、ISWI、CHD 和IN080四大類。其中SWI/SNF是目前研究最多的,SNF5是SWI/SNF 染色質重塑復合物的核心組分之一,高度保守。研究發現SNF5是一個強抑癌基因,在許多惡性腫瘤中突變或缺失,如橫紋肌樣瘤、神經鞘瘤、淋巴瘤、乳腺癌、上皮樣肉瘤及其他軟組織的惡性腫瘤等[5-12]。目前有關SNF5的抗腫瘤機制研究不多。我們設計了針對SNF5基因的sgRNA,構建了SNF5基因的CRISPR/Cas9n 表達載體,旨在通過敲除SNF5基因為深入研究SNF5的抗腫瘤機制奠定基礎。
1 材料與方法
1.1 材料
人胚腎293T 細胞、大腸桿菌DH5α、pX461 和pX462 質粒(本研究室保存);BbsⅠ、磷酸酯酶(Fermentas 公司);T4DNA 連接酶、T4多聚核苷酸激酶(NEB公司);膠回收試劑盒、無內毒素質粒提取試劑盒(天根生化科技有限公司);DMEM 高糖培養基(Gibco 公 司);胎牛血 清(PAN 公 司);LipofectAMINE 2000(Invitrogen 公 司);抗SNF5 抗 體(Abcam 公司);β-actin 抗體、辣根過氧化物酶偶聯的羊抗鼠IgG(Santa Cruz公司)。
1.2 sgRNA靶點選擇及其寡核苷酸鏈設計
應用CRISPR 在線設計工具(http://crispr.mit.edu/),在人源SNF5基因外顯子1 處設計了一對sgRNA。設計過程如下:①從SNF5基因起始密碼子處開始尋找長度約200 bp、富含NGG且位于同一外顯子上的序列,將序列提交至該網站;②根據提交后網站顯示的結果,選擇分數較高的一對序列,自動生成的靶序列都是5'到3'共23 bp;③去掉序列3'端的NGG,并在5'端加上酶切位點CACC,其反向互補序列的5'端添加酶切位點AAAC,以便2條互補的寡核苷酸序列退火后,能夠與經BbsⅠ酶切的質粒的粘性末端互補;如果靶序列5'端第一個堿基不是G,那么應先在5'端添加一個G,再加上酶切位點CACC,相應地其反向互補序列的3'端再增加一個C。
1.3 SNF5sgRNA表達載體的構建
首先用T4多聚核苷酸激酶對合成的2組引物分別進行磷酸化和退火,退火后的sgRNA 分別插入經BbsⅠ酶切的表達載體pSpCas9n(BB)-2A-GFP(簡稱pX461)和pSpCas9n(BB)-2A-Puro(簡稱pX462)中,然后將連接產物轉化大腸桿菌DH5α感受態細胞,挑取單克隆菌落進行測序鑒定(由北京六合華大基因科技股份有限公司完成),測序引物為5'-ATACGATACAAGGCTGTTAGAGAGATA-3'。
1.4 細胞培養和轉染
用含10%胎牛血清的DMEM 培養基培養293T細胞,將處于對數期生長的細胞接種于12 孔板,接種量以轉染時細胞密度達到90%為宜,培養24 h后進行轉染。轉染過程按照LipofectAMINE 2000的說明書進行。
1.5 Westen印跡分析
轉染293T 細胞后24~48 h 收集細胞,加入SDS上樣緩沖液,煮沸10 min,離心后取上清液進行SDS-PAGE;電泳完畢轉移至硝酸纖維素膜上,用5%脫脂奶粉室溫封閉1 h,然后加入用5%脫脂奶粉稀釋的SNF5 抗體,4℃過夜,TBST 洗膜3 次,每次7 min;加入用5%脫脂奶粉稀釋的辣根過氧化物酶偶聯的羊抗鼠IgG,室溫輕搖1 h,TBST洗膜3次,每次7 min;顯色后壓片顯影。
2 結果
2.1 sgRNA靶點及寡核苷酸序列設計
將選擇的人源SNF5基因序列在線提交上述網站后,在外顯子1 處設計了一對sgRNA(圖1),網站生成的序列為5'-GACGGCGAGTTCTACATGATCG G-3'和5'-CTTCACGGGCTTCTGCCCGAAGG-3'。根據生成的靶序列,設計了4 條寡核苷酸序列(表1)。將合成的2 組寡核苷酸序列分別退火,退火后插入經BbsⅠ酶切的表達載體pX461和pX462,構建的表達載體分別為pX461-hSNF5sgRNA1、pX461-hSNF5sgRNA2、pX462-hSNF5sgRNA1 和pX462-hSNF5sgRNA2。
2.2 SNF5sgRNA表達載體構建的測序結果
將構建的4 個表達載體分別測序,結果顯示sgRNA 靶序列均正確插入pX461 和pX462,證明SNF5sgRNA表達載體構建成功(圖2)。
2.3 sgRNA對SNF5表達的影響
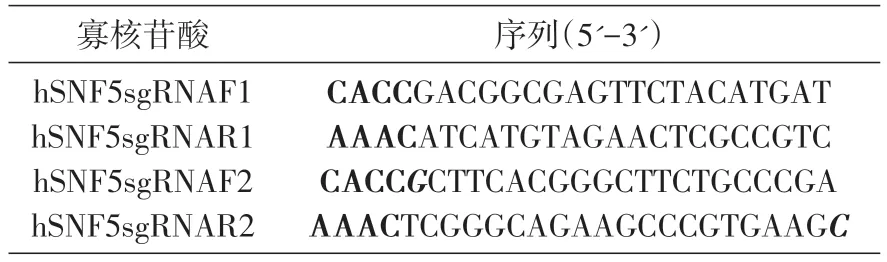
表1 合成的寡核苷酸序列

圖1 一對靶向SNF5第1個外顯子的sgRNA
將pX461、pX461-hSNF5sgRNA1 和pX461-hSNF5sgRNA2、pX462、pX462-hSNF5sgRNA1 和pX462-hSNF5sgRNA2 分別轉染293T 細胞,轉染后24、48 h 收集細胞裂解液進行Western 印跡。結果顯示,與轉染pX461 空載體組比,轉染pX461-hSNF5sgRNA1 和pX461-hSNF5sgRNA2 后24 h,SNF5表達水平明顯降低,轉染后48 h,SNF5表達水平開始恢復;與轉染pX462 空載體組比,轉染pX462-hSNF5sgRNA1 和pX462-hSNF5sgRNA2 后24 h,SNF5 表達水平沒有明顯改變,轉染后48 h,SNF5 表達水平顯著降低(圖3)。此現象表明,不同標簽載體表達的sgRNA 起效時間并不一致,需要根據實驗的具體情況進行摸索。實驗結果表明,我們構建的針對人源SNF5基因的CRISPR/Cas9n系統能夠敲除細胞中SNF5基因的表達。
3 討論
Cas9 核酸內切酶有HNH 和RuvC 兩個活性位點,切割后產生雙鏈DNA斷裂。基因組DNA通過啟動同源重組和非同源末端連接機制進行修復,可能產生基因突變、插入或缺失[13]。CRISPR/Cas9的特異性與跟sgRNA 配對且靠近PAM 處的7~12 個堿基有關,因此CRISPR/Cas9 的靶向特異性非常低[14],會造成研究結果的不確定性及工作量的大量增加,這種脫靶效應會導致基因組中癌基因激活、其他序列突變等不良后果,給臨床應用帶來風險。張峰課題組將Cas9 的RuvC 催化位點進行突變,形成產生單鏈切口的核酸酶Cas9 nickase(Cas9n),通過一對sgRNA 引導來實現靶向雙鏈切割,此方法能顯著降低(約1/50~1/1500)CRISPR/Cas9系統在細胞系中的脫靶效應[15]。
本研究采用的即為上述CRISPR-Cas9n系統,本系統所用質粒是CRISPR 與Cas9n 的共質粒表達系統,可以提高基因敲除效率。在設計sgRNA 靶序列時應注意:靶序列應位于基因同一個外顯子內,不能在外顯子與內含子交界處,且靶序列應位于基因的CDS 區;如果外顯子內CDS 序列少于60 bp,則沒必要再進行設計,即使設計了效果也不佳;選擇的靶序列離ATG 越近越好。在線提交所選基因序列后,得出的評分結果是針對脫靶效應的,分值越高脫靶效應越小。
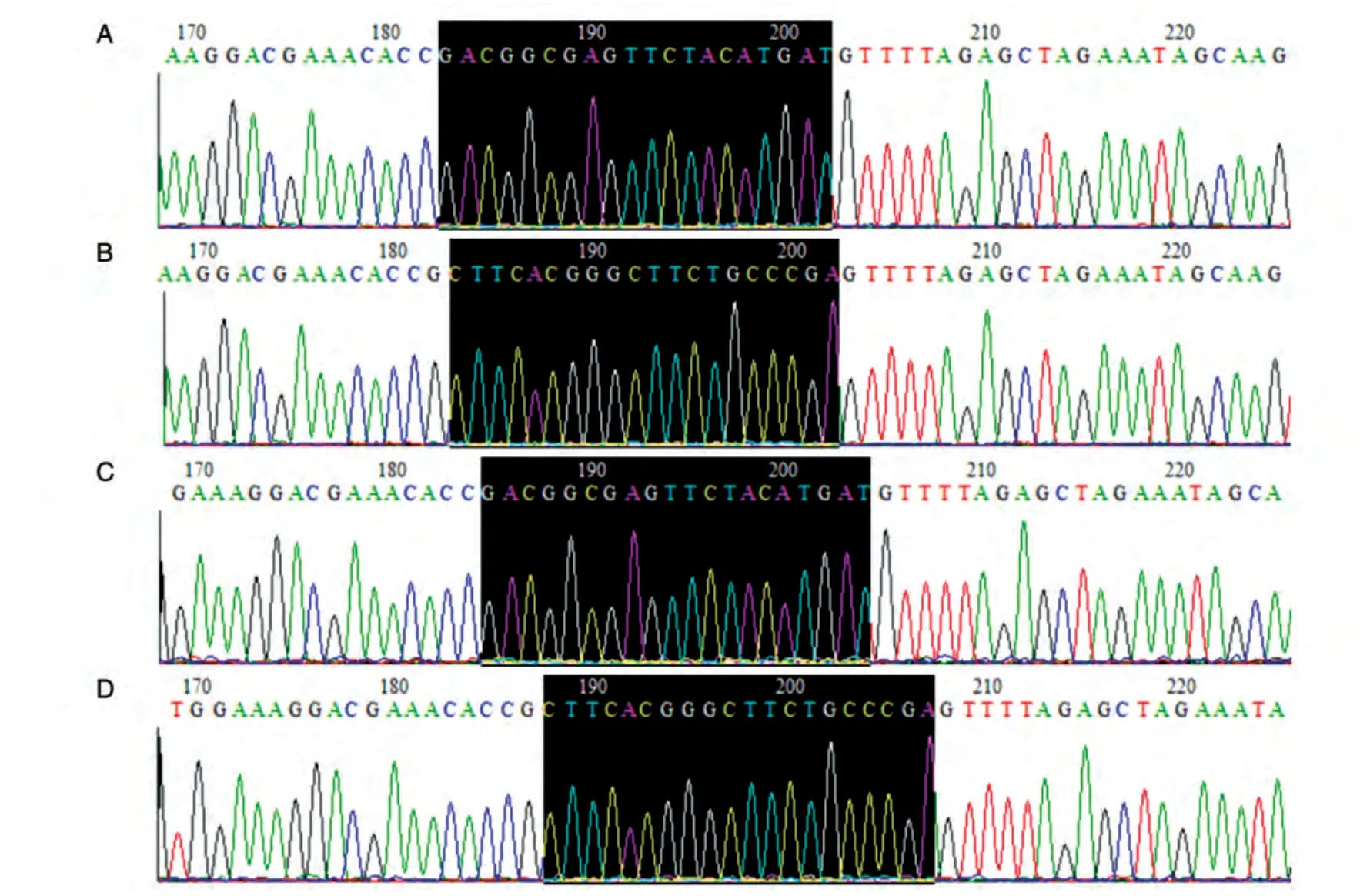
圖2 構建的SNF5sgRNA表達載體測序峰圖

圖3 Westren印跡檢測SNF5蛋白表達水平
我們發現,293T 細胞內轉入SNF5sgRNA 后,與轉染空載體組比,SNF5 表達水平顯著降低。這種SNF5表達水平改變反映的是SNF5在細胞群體水平敲除后的變化,CRISPR/Cas9 系統切割基因組DNA后,細胞會啟動同源重組和非同源末端連接機制進行修復,這些修復是隨機的,不同細胞個體突變修復后的基因型各不相同。本實驗中我們選擇了表達綠色熒光蛋白的pX461和表達嘌呤霉素的pX462兩種載體,可以借助綠色熒光蛋白進行流式分選或借助嘌呤霉素進行抗性篩選,實現目的細胞的聚集,便于通過有限稀釋法獲取SNF5基因穩定敲除的單克隆細胞,通過測序即可得到基因型確定的敲除細胞株。
研究發現,SNF5基因的缺失是非典型畸胎瘤、橫紋肌樣瘤、黑色素瘤患者診斷的一個很好的標記物[16-18]。Roberts 等發現,SNF5條件性失活小鼠在平均11周內發生T細胞淋巴瘤,明顯快于p53、RB等重要腫瘤抑制基因[19]。然而SNF5突變后如何導致染色質結構的改變,如何影響基因的轉錄,進而如何導致癌癥的具體機制在很大程度上仍然不清楚。
綜上,我們利用CRISPR/Cas9 技術建立了SNF5基因靶向敲除系統,通過敲除細胞株中SNF5基因,為研究其在疾病中的功能和具體作用機制提供了很好的工具。
[1]Chylinski K,Le Rhun A,Charpentier E.The tracrRNA and Cas9 families of type II CRISPRCas immunity systems[J].RNA Biol,2013,10(5):726-737.
[2]Jinek M,Chylinski K,Fonfara I,et al.A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity[J].Science,2012,337(6096):816-821.
[3]Sapranauskas R,Gasiunas G,Fremaux C,et al.The Streptococcus thermophilus CRISPR/Cas system provides immunity in Escherichia coli[J].Nucleic Acids Res,2011,39(21):9275-9282.
[4]Mali P,Esvelt K M,Church G M.Cas9 as a versatile tool for engineering biology[J].Nat Methods,2013,10(10):957-963.
[5]Brenca M,Rossi S,Lorenzetto E,et al.SMARCB1/INI1 genetic inactivation is responsible for tumorigenic properties of epithelioid sarcoma cell line VAESBJ[J].Mol Cancer Ther,2013,12(6):1060-1072.
[6]Carter J M,O'Hara C,Dundas G,et al.Epithelioid malig-nant peripheral nerve sheath tumor arising in a schwannoma,in a patient with“neuroblastoma-like”schwannomatosis and a novel germline SMARCB1 mutation[J].Am J Surg Pathol,2012,36(1):154-160.
[7]Hulsebos T J,Plomp A S,Wolterman R A,et al.Germline mutation of INI1/SMARCB1 in familial schwannomatosis[J].Am J Hum Genet,2007,80(4):805-810.
[8]Kohashi K,Oda Y,Yamamoto H,et al.SMARCB1/INI1 protein expression in round cell soft tissue sarcomas associated with chromosomal translocations involving EWS:a special reference to SMARCB1/INI1 negative variant extraskeletal myxoid chondrosarcoma[J].Am J Surg Pathol,2008,32(8):1168-1174.
[9]Mimori K,Inoue H,Shiraishi T,et al.A single-nucleotide polymorphism of SMARCB1 in human breast cancers[J].Genomics,2002,80(3):254-258.
[10]Rizzo D,Freneaux P,Brisse H,et al.SMARCB1 deficiency in tumors from the peripheral nervous system:a link between schwannomas and rhabdoid tumors[J]? Am J Surg Pathol,2012,36(7):964-972.
[11]Sullivan L M,Folpe A L,Pawel B R,et al.Epithelioid sarcoma is associated with a high percentage of SMARCB1 deletions[J].Mod Pathol,2013,26(3):385-392.
[12]Yuge M,Nagai H,Uchida T,et al.HSNF5/INI1 gene mutations in lymphoid malignancy[J].Cancer Genet Cytogenet,2000,122(1):37-42.
[13]Jinek M,Chylinski K,Fonfara I,et al.A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity[J].Science,2012,337(6096):816-821.
[14]Pattanayak V,Lin S,Guilinger J P,et al.High-throughput profiling of off-target DNA cleavage reveals RNA-programmed Cas9 nuclease specificity[J].Nat Biotechnol,2013,31(9):839-843.
[15]Ran F A,Hsu P D,Lin C Y,et al.Double nicking by RNA-guided CRISPR Cas9 for enhanced genome editing specificity[J].Cell,2013,154(6):1380-1389.
[16]Vu-Han T L,Fruhwald M C,Hasselblatt M,et al.Identifying molecular markers for the sensitive detection of residual atypical teratoid rhabdoid tumor cells[J].Cancer Genet,2014,207(9):390-397.
[17]Kerl K,Oyen F,Leuschner I,et al.Detection of SMARCB1 loss in ascites cells in the diagnosis of an abdominal rhabdoid tumor[J].Pediatr Blood Cancer,2015,62(5):897-900.
[18]Stockman D L,Curry J L,Torres-Cabala C A,et al.Use of clinical next-generation sequencing to identified melanomas harboring SMARCB1 mutations[J].J Cutan Pathol,2015,42(5):308-317.
[19]Roberts C W,Leroux M M,Fleming M D,et al.Highly penetrant,rapid tumorigenesis through conditional inversion of the tumor suppressor gene Snf5[J].Cancer Cell,2002,2(5):415-425.

