耐熱乳酸菌的篩選及其β-半乳糖苷酶性質分析
李夢菲,孫慶惠,張 彥,楊洪江,*(.工業(yè)微生物教育部重點實驗室,天津市工業(yè)微生物重點實驗室,天津科技大學生物工程學院,天津300457;.天津雙聯(lián)科鑫生物科技有限公司,天津300403)
耐熱乳酸菌的篩選及其β-半乳糖苷酶性質分析
李夢菲1,孫慶惠1,張彥2,楊洪江1,*
(1.工業(yè)微生物教育部重點實驗室,天津市工業(yè)微生物重點實驗室,天津科技大學生物工程學院,天津300457;2.天津雙聯(lián)科鑫生物科技有限公司,天津300403)
本研究從雞糞樣品中分離高產β-半乳糖苷酶的耐熱乳酸菌,經(jīng)16S rRNA序列鑒定,分離得到的6株菌株均為羅伊氏乳桿菌(Lactobacillus reuteri)。初步分析分離菌株所產β-半乳糖苷酶,其最適pH均為6.5。熱穩(wěn)定性實驗發(fā)現(xiàn),菌株MF1567產生的β-半乳糖苷酶在55℃溫育1 h,仍保持51.2%的酶活力。分析菌株MF1567的β-半乳糖苷酶氨基酸序列和蛋白質結構,發(fā)現(xiàn)該菌株中β-半乳糖苷酶LacZ存在22個氨基酸替代,其二級結構α-螺旋的比例較高(26.5%)。結果顯示,蛋白質一級和二級結構的改變可能是該酶具有較好耐熱性的原因。
乳酸菌,β-半乳糖苷酶,耐熱,氨基酸序列
乳糖是乳及乳制品中特有的糖類,是人體正常代謝和生長發(fā)育的能量來源之一。人體攝入乳糖后,存在于小腸粘膜絨毛膜表面的β-半乳糖苷酶(betagalactosidase,EC3.2.1.23)將乳糖水解成葡萄糖和半乳糖,從而被人體吸收利用。當人體缺乏β-半乳糖苷酶或酶活力較低時,乳糖不能被消化吸收,滯留在腸道,從而導致人體出現(xiàn)腸脹氣、腸痙攣、腹瀉等癥狀,稱為乳糖不耐癥(Lactose Intolerance,LI)[1]。我國β-半乳糖苷酶缺乏的發(fā)生率為75%~95%,在0~6歲兒童中的發(fā)生率為47%,而且發(fā)生率隨兒童年齡的增加而上升[2-3]。利用β-半乳糖苷酶水解乳糖的能力生產低乳糖乳制品能有效消除人體對乳糖的不耐受癥狀,是目前β-半乳糖苷酶在食品工業(yè)中最主要的用途[4]。
1998年我國食品添加劑標準委員會正式確定β-半乳糖苷酶為食品添加劑新品種,β-半乳糖苷酶進入工業(yè)化生產階段。微生物由于具有生長迅速、代謝效率高等特性,而成為商品β-半乳糖苷酶的主要來源。在實際工業(yè)生產中,利用熱穩(wěn)定的中性β-半乳糖苷酶生產低乳糖乳制品不僅能有效防止微生物污染,還能縮短生產周期。然而,商業(yè)化的產酶菌株必須是美國FDA認定的GRAS(generally regarded as safe)安全菌株。乳酸菌(lactic acid bacteria,LAB)作為公認的食品級微生物,其產生的β-半乳糖苷酶被認為具有工業(yè)應用潛力。目前,人們已篩選出多株產β-半乳糖苷酶的乳酸菌菌株,如嗜熱鏈球菌(Streptococcus thermophilus)、卷曲乳桿菌(Lactobacillus crispatus)、德氏乳桿菌保加利亞亞種(Lactobacillus delbrueckii ssp.bulgaricus)和乳酸乳球菌(Lactococcus lactis)等[5]。然而,大多數(shù)乳酸菌合成的β-半乳糖苷酶都不具有熱穩(wěn)定性。異源表達卷曲乳桿菌(Lactobacillus crispatus)β-半乳糖苷酶基因,獲得的重組β-半乳糖苷酶在50℃溫育30 min后幾乎失去全部活力[6]。嗜酸乳桿菌(Lactobacillus acidophilus)R22合成的β-半乳糖苷酶已被證明可用于乳品工業(yè),但該酶僅在4℃最穩(wěn)定,也不具有熱穩(wěn)定性[7]。
雞腸道中有著豐富的微生物菌群,乳酸桿菌是雞腸道中的優(yōu)勢菌群,成熟的雞腸道中大約70%的微生物是乳酸桿菌[8-9]。此外,禽類的正常體溫略高于其他動物,因此本文選擇從雞糞樣品中篩選能夠產生耐熱β-半乳糖苷酶的乳酸菌,對高產酶的耐熱菌株進行了鑒定,對其酶學性質進行了測定,并對其β-半乳糖苷酶編碼基因進行了同源性分析,以期為β-半乳糖苷酶的應用奠定基礎。
1 材料與方法
1.1材料與儀器
新鮮雞糞從北京周邊地區(qū)的3個養(yǎng)雞場采集新鮮雞糞樣品共11份;鄰硝基苯β-D-半乳吡喃糖苷(ONPG,超純級)、β-巰基乙醇(生化級) 北京鼎國生物技術有限公司;5-溴-4-氯-3-吲哚-β-D-半乳糖苷(X-gal) Promega公司;乳糖分析純,北京奧博星生物技術有限公司;PCR緩沖液(超純級)、Taq DNA聚合酶(超級純)、三磷酸堿基脫氧核苷酸(dNTPs,超級純) 上海生工生物工程有限公司;Z-buffer(pH7.0) 磷酸氫二鈉16.68 g,磷酸二氫鈉5.64 g,氯化鉀0.745 g,硫酸鎂0.246 g,用雙蒸水溶解,定容到1000 mL,使用前加β-巰基乙醇2.7 mL;分離、純化培養(yǎng)基(g/L)蛋白胨10,牛肉膏8,酵母浸粉4,乳糖20,乙酸鈉5,檸檬酸三銨2,硫酸鎂0.2,磷酸二氫鉀2,Tween-80 1 mL,硫酸錳0.05,瓊脂15,pH5.0;乳糖-MRS(L-MRS)培養(yǎng)基(g/L) 蛋白胨10,牛肉膏8,酵母浸粉4,乳糖20,乙酸鈉5,檸檬酸三銨2,硫酸鎂0.2,磷酸二氫鉀2,Tween-80 1 mL,硫酸錳0.05,pH6.4。
752紫外光柵分光光度計上海精密科學儀器有限公司;TDA-8002型水浴鍋天津市中環(huán)實驗室電爐有限公司;電熱恒溫培養(yǎng)箱賽默世爾科技公司;PCR基因擴增儀美國BIO-RAD公司;pH計Mettler-Toledo公司。
1.2實驗方法
1.2.1產β-半乳糖苷酶耐熱乳酸菌的分離分別稱取不同雞糞樣品1 g至盛有9 mL滅菌生理鹽水的試管中,充分振蕩混勻后,放入50℃水浴鍋中溫育2 h。將熱處理的雞糞樣品液稀釋至10-3,取稀釋度為10-1、 10-2、10-3的菌懸液各100 μL涂布在含有20 mg/mL X-gal的分離培養(yǎng)基上,35℃培養(yǎng)至長出菌落。挑取藍色菌落、編號并進行純化。
將純化的單菌落接種至含有5 mL L-MRS液體培養(yǎng)基的試管中,35℃靜置培養(yǎng)10 h后轉接二級種子,二級種子經(jīng)35℃靜置培養(yǎng)12 h后轉接至L-MRS發(fā)酵培養(yǎng)基(100 mL/250 mL),接種量均為1%。取1 mL各菌株的發(fā)酵液至試管中,加入3 mL Z-buffer,混勻后加入80 μL氯仿,充分振蕩后在50℃溫育2 h,在37℃分別測定溫育前后的β-半乳糖苷酶活力。
1.2.2β-半乳糖苷酶活力的測定β-半乳糖苷酶活力的測定方法主要參考文獻的方法進行[10-11]。取1 mL發(fā)酵液至試管中,加入3 mL Z-buffer,混勻后加入80 μL氯仿充分振蕩,在37℃水浴條件下加入800 μL ONPG(4 mg/L)并開始計時,觀察溶液變成黃色時,立即加入1 mL 1 mol/L Na2CO3終止反應,12000 r/min離心3 min,取上清液測定OD420。
β-半乳糖苷酶活力單位(U)定義為:在實驗條件下以1 μmol/min的速率釋放鄰硝基酚(ONP)所需的酶量。
計算公式:β-半乳糖苷酶活力(U/g)=(OD420×f× V)/(4.5254×t×m),其中:f為粗酶液稀釋倍數(shù);V為反應體積(mL);4.5254為420 nm處1 μmol/mL ONP的吸光度,即ONP標準曲線的斜率;t為反應時間(min);m為1 mL發(fā)酵液中的菌體干重(g)。
相對酶活力(%)定義為:以不同條件下測定的最大酶活力為100%,不同條件下測定的酶活力與最大酶活力的比率。
1.2.3分離菌株的分子鑒定收集35℃靜置培養(yǎng)12 h的菌體細胞,按參考文獻的方法提取細菌基因組DNA[12],作為擴增16S rRNA基因的DNA模板。用PCR方法擴增高產β-半乳糖苷酶菌株16S rRNA基因,引物為27f(5’AGAGTTTGATCCTGGCTCAG 3’)和1492r(5’GGTTACCTTGTTACGACTT 3’)[13]。PCR產物進行DNA序列測定,并在NCBI網(wǎng)站上利用BLAST軟件對所得的DNA序列進行同源性比對,在GenBank中選擇嗜熱鏈球菌(Streptococcus thermophilus)、乳明串珠菌(Leuconostoc lactis)、雙歧桿菌(Bifidobacterium)和多株乳酸桿菌(Lactobacillus)作為參比菌株,用MEGA 5.0軟件構建系統(tǒng)發(fā)育樹,分析高產β-半乳糖苷酶菌株的進化地位[14]。
1.2.4β-半乳糖苷酶酶學性質測定
1.2.4.1β-半乳糖苷酶最適pH的測定配制pH為5.0、5.5、6.0的0.1 mol/L檸檬酸-檸檬酸鈉緩沖液,配制pH為6.5、7.0、7.5、8.0的0.1 mol/L PBS緩沖液。取1 mL發(fā)酵液至試管中,加入3 mL不同pH的緩沖液和80 μL氯仿充分振蕩,按1.2.2方法測定β-半乳糖苷酶活力。
1.2.4.2β-半乳糖苷酶熱穩(wěn)定性的測定取1 mL發(fā)酵液至試管中,加入3 mL Z-buffer和80 μL氯仿,充分振蕩后將試管分別至于45、50、55℃水浴鍋中溫育4 h,按1.2.2方法測定β-半乳糖苷酶活力。
1.2.5β-半乳糖苷酶基因序列分析分別以羅伊氏乳桿菌SD2112(Lactobacillus reuteri SD2112)的β-半乳糖苷酶編碼基因lacZ(GenBank accession no. AEI56354)、lacL(GenBank accession no.AEI57702)和lacM(GenBank accession No.AEI57703)的序列為模板設計引物。引物lacZ-F(5’TGGTAGCAAAGAA GTTATTGACGAG 3’)和lacZ-R(5’ACACTGGTTGA TTGAAAAAGGGTAG 3’)擴增基因lacZ;引物lacL-F(5’CCTCTCCTCTTGCTATCTCA 3)和lacL-R(5’CCGTCACCACTAAGTCCTAA 3’)擴增基因lacL;引物lacM-F(5’ACTTGACAAATACCCACA 3’)和lacMR(5’GAACATAGCAGCATAGAA 3’)擴增基因lacM。PCR反應條件:95℃預變性5 min后進入30個循環(huán)(94℃變性1 min,退火1 min,72℃延伸1 min),循環(huán)結束后72℃終延伸10 min。
PCR產物經(jīng)測序后,使用ORF Finder(Open Reading Frame Finder)軟件預測β-半乳糖苷酶的氨基酸序列[15],采用Compute pI/Mw在線分析軟件預測編碼蛋白質的分子量和等電點[16-17],采用PSIPRED預測β-半乳糖苷酶的二級結構[18]。在UniProt數(shù)據(jù)庫中查找多個乳酸桿菌的β-半乳糖苷酶序列,并在EBI網(wǎng)站上運用Clustal Omega軟件進行比對分析[19-20]。
2 結果與分析
2.1產β-半乳糖苷酶耐熱乳酸菌的篩選
共分離得到11株產β-半乳糖苷酶的耐熱乳酸菌。進一步將分離菌株的β-半乳糖苷酶粗酶液在50℃水浴鍋中溫育2 h,測定β-半乳糖苷酶剩余活力,結果見表1。
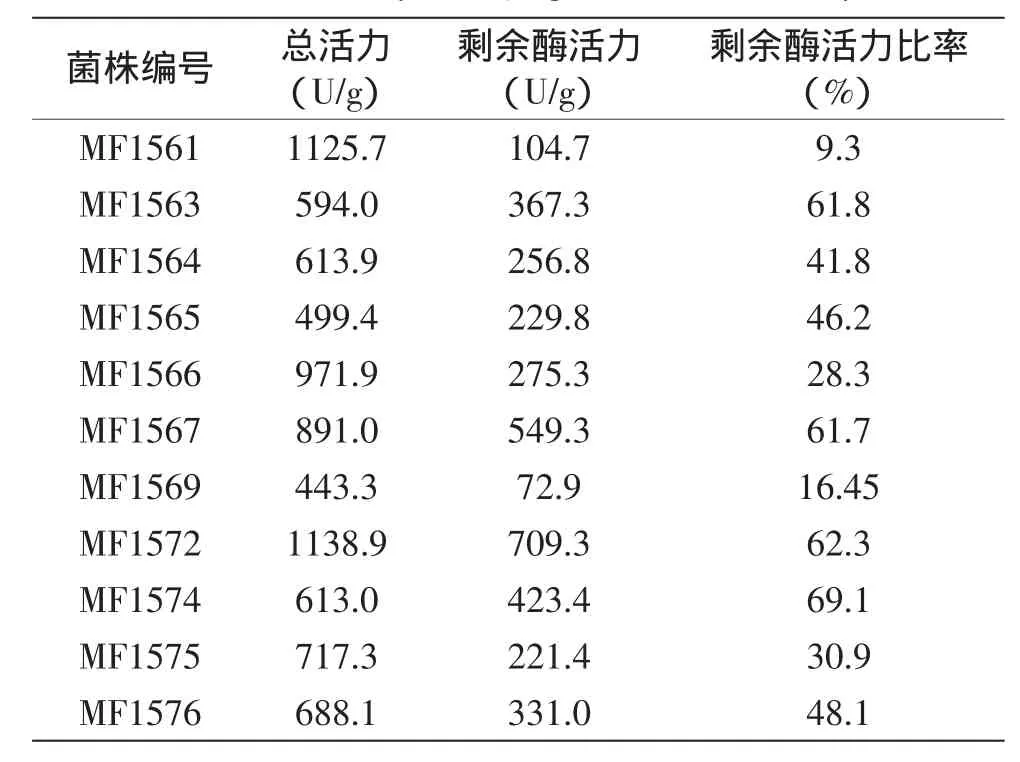
表1 產β-半乳糖苷酶耐熱乳酸菌β-半乳糖苷酶活力的測定Table 1 Analysis of β-galactosidase activity
由表1可知,分離菌株MF1561、MF1566、MF1567和MF1572在37℃具有很高的酶活力,分別為1125.7、971.9、891.0和1138.9 U/g。50℃溫育后,菌株MF1561產生的β-半乳糖苷酶活力僅剩9.3%,分離菌株MF1566、MF1567和MF1572的剩余酶活力比率分別為28.3%、61.7%和62.3%。此外,分離菌株MF1563、MF1574和MF1576的剩余酶活力比率較高,分別為61.8%、69.1%和48.1%。因此,最終選擇菌株MF1563、MF1566、MF1567、MF1572、MF1574和MF1576,共6株分離菌株進行分析。
2.2分離菌株的16S rRNA鑒定
同源性比對結果見圖1,顯示6株分離菌株MF1563、MF1566、MF1567、MF1572、MF1574和MF1576與羅伊氏乳桿菌(Lactobacillus reuteri)的同源程度均為99%,因此確定6株菌株均為羅伊氏乳桿菌。羅伊氏乳桿菌是天然存在于脊椎動物和哺乳動物腸道內的乳酸菌,可改善腸道菌群的分布,并具有拮抗有害菌定植等益生功能[21]。我國衛(wèi)生部于2003年批準了羅伊氏乳桿菌為可用于保健食品的益生菌菌株。
由圖1可以看出,根據(jù)16S rRNA基因序列,6株分離得到的羅伊氏乳桿菌分為兩類,羅伊氏乳桿菌MF1572為一類,其他羅伊氏乳桿菌為另一類。羅伊氏乳桿菌除與陰道乳桿菌(L.vaginalis)的親源關系最近外,與發(fā)酵乳桿菌(L.fermentum)的親源關系最近,而與嗜熱鏈球菌(Streptococcus thermophilus)、乳明串珠菌(Leuconostoc lactis)的親源關系較遠,與雙歧桿菌(Bifidobacterium)的親源關系最遠。
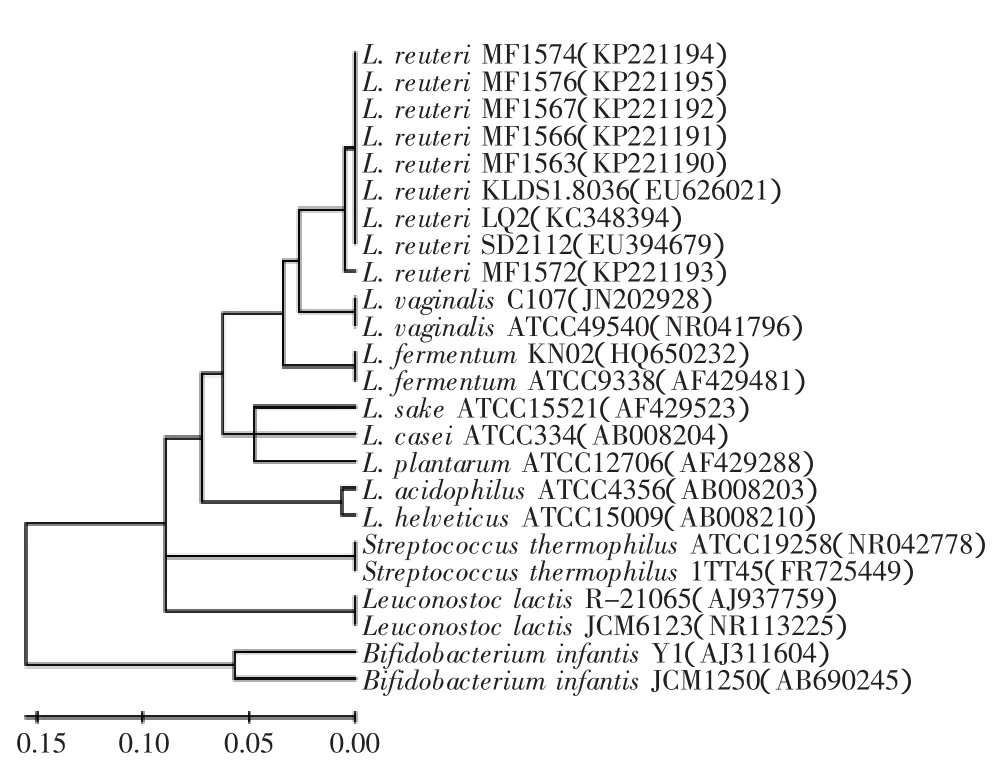
圖1 基于16S rRNA構建的系統(tǒng)發(fā)育樹Fig.1 Phylogenetic tree based on 16S rRNA gene sequences
2.3β-半乳糖苷酶最適pH的測定
結果見圖2。6株羅伊氏乳桿菌在pH6.5時酶活力最高,即6株羅伊氏乳桿菌的最適pH均為6.5。
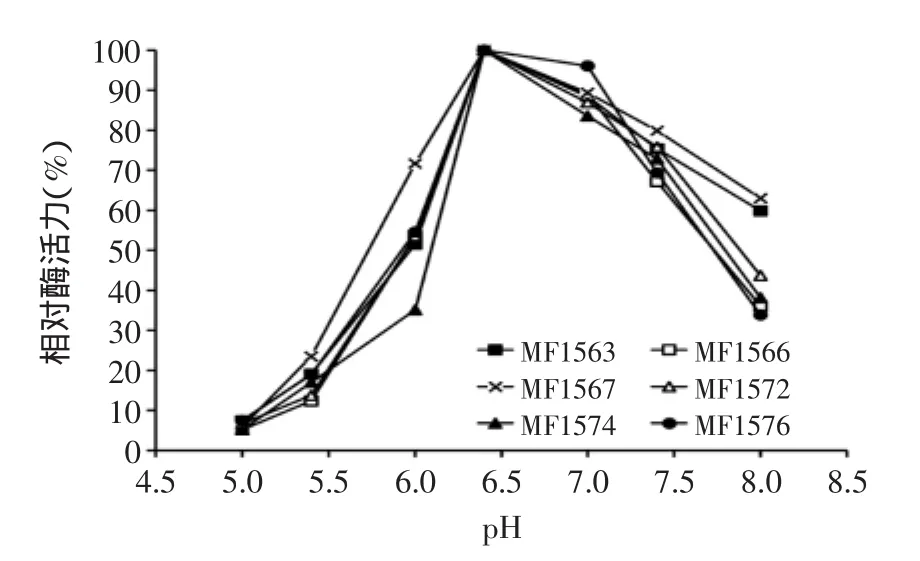
圖2 羅伊氏乳桿菌β-半乳糖苷酶最適pHFig.2 Optimum pH of the β-galactosidase from isolated L.reuteri strains
2.4β-半乳糖苷酶熱穩(wěn)定性的測定
進一步考察MF1563、MF1566、MF1567、MF1572、MF1574、MF1576,6株羅伊氏乳桿菌β-半乳糖苷酶的熱穩(wěn)定性。結果分別見圖3中的(a~c)。
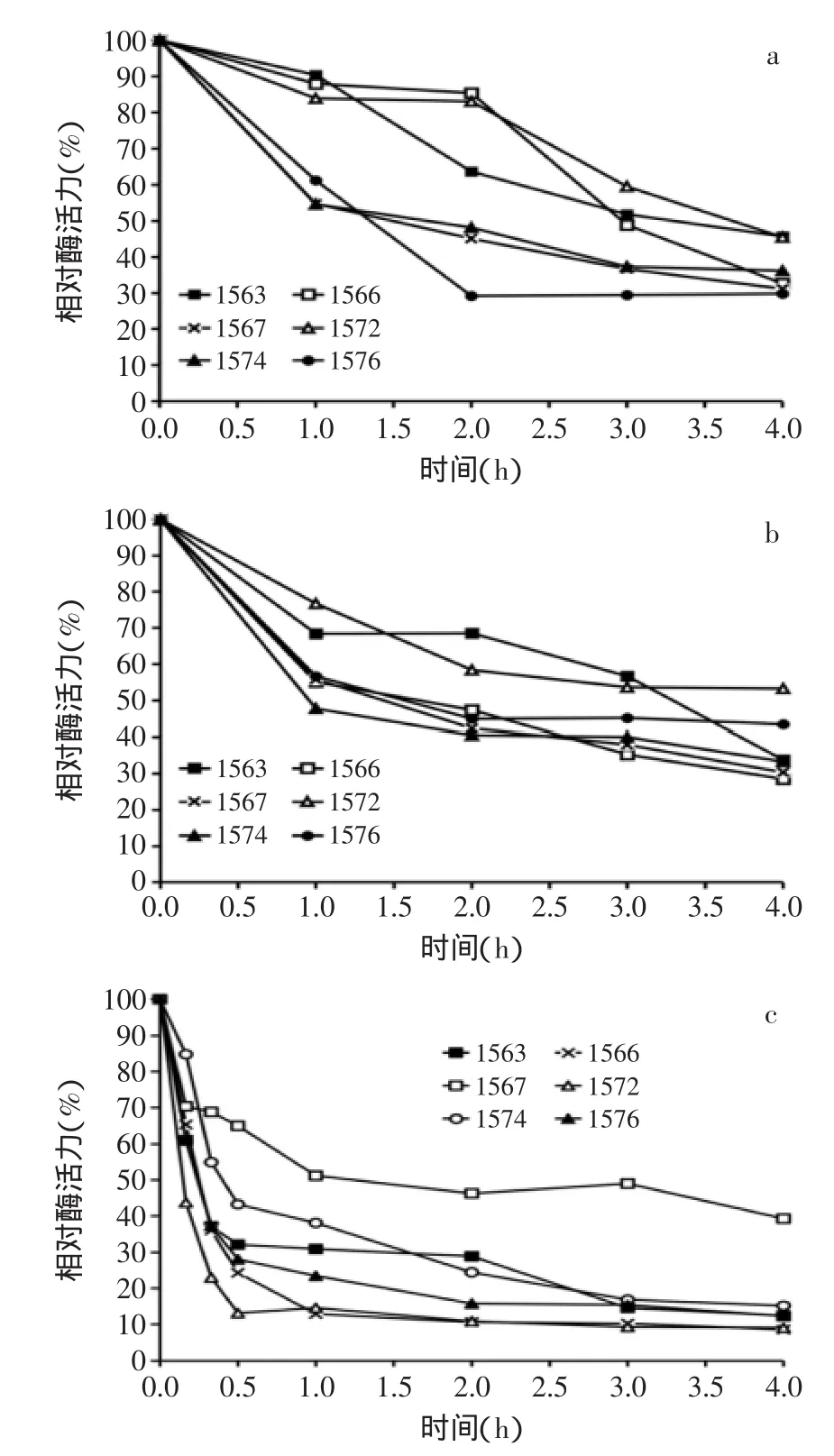
圖3 羅伊氏乳桿菌β-半乳糖苷酶熱穩(wěn)定性Fig.3 Thermostable of β-galactosidase from L.reuteri strains
6株羅伊氏乳桿菌的β-半乳糖苷酶粗酶液在45℃溫育1 h后,菌株MF1563、MF1566和MF1572合成的β-半乳糖苷酶比較穩(wěn)定,分別剩余90.5%、88.0%和84.0%的酶活力;在45℃溫育2 h后,菌株MF1563的酶活力降低至63.7%,而菌株MF1566和MF1567仍具有85.4%和83.0%的酶活力;在45℃溫育4 h后,所有菌株的剩余酶活力均低于50%。
6株羅伊氏乳桿菌的粗酶液在50℃溫育1 h后,菌株MF1563和MF1572仍有超過65%的酶活力,菌株MF1566、MF1567和MF1576的剩余酶活力大于55%,繼續(xù)溫育,各菌株的酶活力逐漸降低。
6株羅伊氏乳桿菌的β-半乳糖苷酶粗酶液在55℃溫育15 min,菌株MF1572的酶活力迅速降低至43.8%,其余菌株仍具有超過60%的酶活力。55℃溫育30 min后,菌株MF1567剩余65.0%的酶活力,而其余5株羅伊氏乳桿菌的酶活力均迅速下降至50%以下,繼續(xù)溫育至1 h后,菌株MF1567剩余51.2%的酶活力,此后繼續(xù)保溫,菌株MF1567的剩余酶活力趨于穩(wěn)定,4 h后剩余酶活力為39.3%,而其余5株菌的酶活力隨著溫育時間的延長而逐漸降低,4 h后剩余約10%的酶活力。由此猜測,羅伊氏乳桿菌MF1567可能同時合成兩種β-半乳糖苷酶,其中一種不具有熱穩(wěn)定性,在55℃溫育1 h失去全部活力,而另一種β-半乳糖苷酶則具有相對熱穩(wěn)定性。
2.5β-半乳糖苷酶氨基酸序列同源性分析
將6株羅伊氏乳桿菌(MF1563、MF1566、MF1567、MF1572、MF1574和MF1576)的β-半乳糖苷酶基因擴增產物送至北京華大基因公司進行序列測定。將測序的β-半乳糖苷酶基因序列上傳至GenBank,獲得的序列接收號見表2。
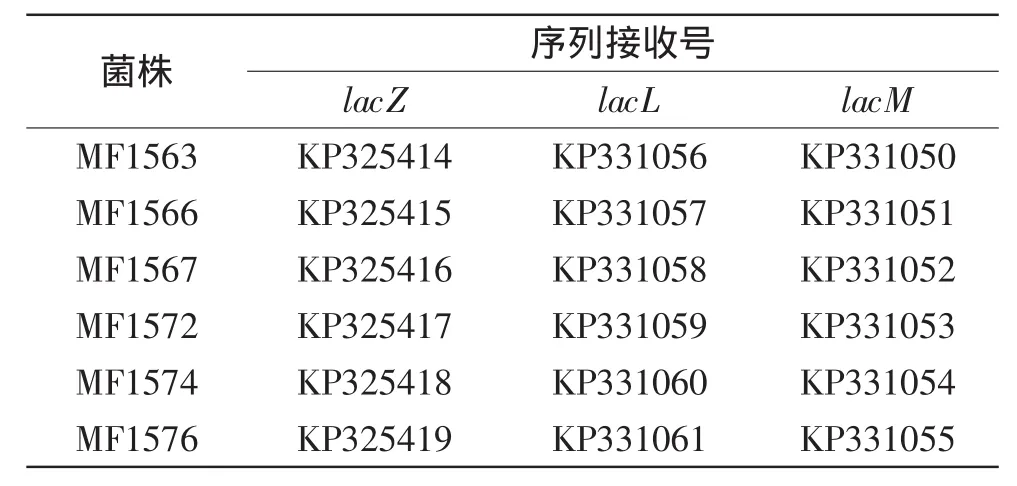
表2 分離菌株β-半乳糖苷酶基因序列接收號Table 2 β-galactosidase gene GenBank accession no.of 6 isolated strains
由于密碼子具有簡并性,某個堿基的突變可能不會引起氨基酸序列的改變。在UniProt數(shù)據(jù)庫中檢索多株乳酸桿菌LacZ、LacL和LacM的氨基酸序列,分別與分離得到的6株羅伊氏乳桿菌進行同源性比對。以羅伊氏乳桿菌SD2112的LacZ、LacL和LacM為100%,6株分離得到的羅伊氏乳桿菌的LacZ、LacL和LacM與羅伊氏乳桿菌SD2112的同源程度均大于97%,其中羅伊氏乳桿菌MF1567的LacL和LacM與羅伊氏乳桿菌SD2112的相似度達到100%。
2.6β-半乳糖苷酶LacZ的結構分析
羅伊氏乳桿菌SD2112 LacZ的氨基酸活性位點Glu-150為質子給予體,Glu-309為親核試劑;底物結合位點分別為Arg-111、Asn-149和Trp-317;金屬鋅離子結合位點分別為Cys-115、Cys-155、Cys-157和Cys-160[22]。在EBI網(wǎng)站上運用Clustal Omega軟件將分離得到的6株羅伊氏乳桿菌LacZ序列與UniProt數(shù)據(jù)庫中的羅伊氏乳桿菌SD2112和MF2-2的LacZ氨基酸序列進行比對,分離得到的6株羅伊氏乳桿菌與羅伊氏乳桿菌SD2112和MF2-2具有相同的保守氨基酸,結果見圖4。
然而,產耐熱β-半乳糖苷酶的羅伊氏乳桿菌MF1567的LacZ與參比菌株羅伊氏乳桿菌SD2112有22個氨基酸不同,通過PSIPRED蛋白質結構預測軟件,在線預測羅伊氏乳桿菌MF1567 lacZ基因編碼的β-半乳糖苷酶二級結構,結果顯示菌株MF1567的LacZ含有26.5%的α-螺旋和17.6%的β-折疊,而羅伊氏乳桿菌SD2112含有26.0%的α-螺旋和17.7%的β-折疊。羅伊氏乳桿菌MF1567比菌株SD2112多含有0.5%的α-螺旋結構,這可能與其具有較好的熱穩(wěn)定性有關[23-24]。

圖4 LacZ氨基酸序列比對Fig.4 Amino acid sequences alignment of LacZ
2.7β-半乳糖苷酶LacLM的活性中心位點分析
羅伊氏乳桿菌lacL和lacM基因編碼的異源二聚體β-半乳糖苷酶屬于糖苷水解酶2族(GHF-2),lacL基因編碼β-半乳糖苷酶的大亞基,lacM基因編碼小亞基,而且單獨的LacL和LacM都沒有催化活性,只有當lacL和lacM兩個基因同時表達時,才能獲得具有催化活性的β-半乳糖苷酶[25]。
利用POSITE在線分析羅伊氏乳桿菌GHF-2 LacLM的結構域和功能標記,結果發(fā)現(xiàn)LacL氨基酸序列存在兩個高度保守的序列,LacM無任何活性氨基酸位點。將同屬于糖苷水解酶2族的LacLM和大腸桿菌LacZ的保守序列進行對比,結果見表3。屬于同一糖苷水解酶家族的LacLM和大腸桿菌LacZ分別有41個保守氨基酸,其中有17個氨基酸有顯著性差異,占保守序列的41.5%。

表3 糖苷水解酶2族LacLM和LacZ保守序列對比Table 3 Comparison of conservative sequences of GHF-2 LacLM and LacZ
3 結論
本研究采用加熱預處理的方式,首先從新鮮雞糞樣品中分離出11株產β-半乳糖苷酶的耐熱乳酸菌,通過酶活力測定和對粗酶液的熱處理,進一步篩選出6株產酶活力高而且所產生的β-半乳糖苷酶具有一定耐熱性的乳酸菌。經(jīng)16S rRNA鑒定,6株分離菌株均為羅伊氏乳桿菌。其中菌株MF1567編碼的β-半乳糖苷酶在55℃保溫1 h仍能保持51.2%的酶活力,將來可以通過育種進一步提高β-半乳糖苷酶活力,最終用于工業(yè)化生產。
[1]呂曉華,劉世貴,高榮.生物技術在乳糖不耐受防止中的應用[J].中國乳品工業(yè),2002,30(1):44-47.
[2]楊月欣,何梅,崔紅梅,等.中國兒童乳糖不耐受發(fā)病率的調查研究[J].衛(wèi)生研究,1999,28(1):44-46.
[3]龔群,張鳳玲,何琳,等.0~6歲兒童乳糖缺乏的現(xiàn)狀與健康關系的研究[J].中國兒童保健雜志,2008,16(5):567-569.
[4]張敏文,顧取良,張博,等.乳糖酶研究進展[J].微生物學雜志,2011,31(3):81-86.
[5]Parvez S,Malik K A,Kang S A,et al.Probiotics and their fermented food products are beneficial for health[J].Journal of Applied Microbiology,2006,100:1171-1185.
[6]Chunming N,Bo L,Yuhong Z,et al.Production and secretion of Lactobacillus crispatus β-galactosidase in Pichia pastoris[J].Protein expression and purification,2013,92:88-93.
[7]Nguyen T H,Barbara S,Krasteva S,et al.Characterization and molecular cloning of a heterodimeric beta-galactosidase from the probiotic strain Lactobacillus acidophilus R22[J].FEMS Microbiol Lett,2007,269(1):136-144.
[8]王麗鳳,張家超,馬晨,等.雞腸道微生物研究進展[J].動物營養(yǎng)學報,2013,25(3):494-502.
[9]Lu J,Idris U,Harmon B,et al.Diversity and succession of the intestinal bacterial community of the maturing broiler chicken[J].Applied and Environmental Microbiology,2003,69(11):6816-6824.
[10]Dagbagli S,Goksungur Y.Optimization of β-galactosidase production using Kluyveromyces lactis NRRL Y-8279 by response surface methodology[J].Electronic Journal of Biotechnology,2008,11(4):1-12.
[11]Lodi T,Donnini C.Lactose-induced cell death of betagalactosidase mutants in Kluyveromyces lactis[J].FEMS Yeast Research,2005,5(8):727-734.
[12]Sambrook J,F(xiàn)ritsch E F,Maniatis T.Molecular cloning[M].New York:Cold Spring Harbor Laboratory Press,1989.
[13]Suzuki M T,Giovannoni S J.Bias caused by template annealing in the amplification of mixtures of 16S rRNA genes by PCR[J].Applied and Environmental microbiology,1996,62(2):625-630.
[14]Tamura K,Peterson D,Peterson N,et al.MEGA5:Molecular evolutionarygeneticsanalysisusingmaximumlikelihood,evolutionary distance,and maximum parsimony methods[J].Molecular Biology and Evolution,2011,28:2731-2739.
[15]Morgulis A,Coulouris G,Raytselis Y,et al.Database indexing for production Mega BLAST searches[J].Bioinformatics,2008,[16]Bjellqvist B,Hughes G J,Pasquali C,et al.The focusing positions of polypeptides in immobilized pH gradients can be predicted from their amino acid sequences[J].Electrophoresis,1993,14:1023-1031.
15:1757-1764.
[17]Bjellqvist B,Basse B,Olsen E,et al.Reference points for comparisons of two-dimensional maps of proteins from different human cell types defined in a pH scale where isoelectric points correlate with polypeptide compositions[J].Electrophoresis,1994,15:529-539.
[18]Kosciolek T,Jones D T.De novo structure prediction of globular proteins aided by sequence variation-derived contacts[J].PloS one,2014,9(3):e92197A.
[19]The UniProt Consortium.Activities at the universal protein resource(UniProt)[J].Nucleic Acids Research,2014,42:191-198.
[20]Sievers F,Wilm A,Dineen D,et al.Fast,scalable generation of high-quality protein multiple sequence alignments using Clustal Omega[J].Molecular systems biology,2011,7:539.
[21]龐潔,周娜,劉鵬,等.羅伊氏乳桿菌的益生功能[J].中國生物工程雜志,2011,31(5):131-137.
[22]Muzny D,Qin X,Buhay C,et al.The complete genome of LactobacillusreuteriATCC55730/SD2112[DB].GenBank databases.
[23]Schulz G E,Schirmer R H.Principles of protein structure in“Springer advanced texts in chemistry”[M].New York:Springer-Verlag,1990.
[24]Branden C,Tooze J.Introduction to protein structure[M].New York:Garland Pub.
[25]Nguyen T H,Splechtna B,Yamabhai M,et al.Cloning and expression of the β-galactosidase genes from Lactobacillus reuteri in Escherichia coli[J].Journal of Biotechnology,2007,129:581-591.
Screening of heat tolerable lactic acid bacteria and characterization of their β-galactosidases
LI Meng-fei1,SUN Qing-hui1,ZHANG Yan2,YANG Hong-jiang1,*
(1.Key Laboratory of Industrial Microbiology,Ministry of Education,Tianjin Key Laboratory of Industrial Microbiology,College of Biotechnology,Tianjin University of Science&Technology,Tianjin 300457,China;2.Tianjin Shuang Lian Ke Xin Biotechnology Co.,Ltd.,Tianjin 300403,China)
In this study,heat tolerable LAB strains producing high level β-galactosidase were isolated from chicken feces samples.With 16S rRNA gene sequence analysis,6 isolated strains were all identified as Lactobacillus reuteri.All β-galactosidases from the isolated L.reuteri strains had the same optimum pH of 6.5. After incubating for 1 h at 55℃,51.2%of β-galactosidase of strain MF1567 activity was retained.The amino acid sequence analysis showed that 22 amino acid residues of β-galactosidase LacZ were substituted.The secondary protein structure was further predicted and LacZ had a relatively higher degree of α-helix(26.5%),which might contribute to the heat stability of β-galactosidase LacZ from L.reuteri MF1567.
lactic acid bacteria;β-galactosidase;heat tolerable;amino acid sequences
TS201.2
A
1002-0306(2015)18-0209-06
10.13386/j.issn1002-0306.2015.18.033
2015-01-16
李夢菲(1989-),女,碩士研究生,研究方向:微生物遺傳與育種,E-mail:lemonphy23@sina.com。
楊洪江(1966-),男,博士,教授,研究方向:微生物學,E-mail:hongjiangyang@tust.edu.cn。
天津市科技支撐計劃重點項目(13ZCZDNC00600)。

