HPLC法同時測定棗葉中5種黃酮的含量
李喜悅,高 哲,王榮芳,崔 璨,安小楠,崔 同(河北農業大學食品科技學院,河北保定071000)
HPLC法同時測定棗葉中5種黃酮的含量
李喜悅,高哲,王榮芳,崔璨,安小楠,崔同*
(河北農業大學食品科技學院,河北保定071000)
建立了一種棗葉中黃酮類成分定量分析的HPLC方法,并對14個品種的大棗及酸棗葉中這5種黃酮的含量進行了分析。結果得到采用Hypersil BDS C18色譜柱,以乙腈與0.1%甲酸水溶液為流動相梯度洗脫,流速1 mL/min,柱溫30℃,檢測波長360 nm,實現了槲皮素-3-O-洋槐糖苷、蘆丁、槲皮素-3-O-β-D-葡萄糖苷、山奈酚-3-O-蕓香糖苷、槲皮素-3-O-α-L-阿拉伯糖-(1→2)-α-L-鼠李糖苷5種黃酮苷的同時檢測,最低檢出限為1.44~2.59 μg/mL,加標回收率在93.8%~105.9%之間。5種黃酮苷的含量測定結果表明不同品種的棗葉中黃酮類成分的組成和含量差異較大,其中蘆丁和槲皮素-3-O-洋槐糖苷的含量較高,平均為7.83 mg/g D.W和4.61 mg/g D.W;8個品種棗葉中檢測到槲皮素-3-O-α-L-阿拉伯糖-(1→2)-α-L-鼠李糖苷,平均5.32 mg/g D.W;而槲皮素-3-O-β-D-葡萄糖苷和山奈酚-3-O-蕓香糖苷的含量較低,分別為0.14 mg/g D.W和0.41 mg/g D.W。
HPLC,棗葉,黃酮,蘆丁,槲皮素-3-O-洋槐糖苷
棗葉是鼠李科(Rhamnaceae)棗屬植物棗(Ziziphus Jujuba Mill.)和酸棗[Ziziphus jujuba Mill.var.spinosa(Bunge)Hu ex H.F.Chow]的葉子。據《日華子本草》記載,棗葉性味“溫,無毒”。而據《本草綱目》記載,酸棗葉可“斂瘡解毒,治脛臁瘡”。
據報道,黃酮類成分是棗葉中含量較高的活性成分[1-3],然而目前對棗葉中黃酮類成分定量分析方面的研究并不多見。李蘭芳等[4]采用薄層掃描法測定了不同采收期酸棗葉中蘆丁的含量。裴香萍等[5]利用HPLC法測定了不同產地、不同采收期酸棗葉中蘆丁的含量,但其采用的色譜條件沒有將蘆丁與其前面的色譜峰有效分離。張倩倩等[6]經DAD檢測發現蘆丁與其色譜峰前面的組分不是同一種化學成分,但并沒有進一步確證其化學結構。Guo Sheng等[1]建立了同時測定3種黃酮(蘆丁、槲皮素-3-O-α-L-阿拉伯糖-(1→2)-α-L-鼠李糖苷、槲皮素-3-O-β-D-木糖-(1→2)-α-L-鼠李糖苷)以及2種皂苷和9種三萜的HPLC-ELSD分析方法,但是需要使用特殊的檢測器。最近本實驗室研究結果表明,大棗和酸棗的葉中有多種黃酮苷類成分,對其中5種含量較高的黃酮苷進行了分離純化和結構鑒定[7]。本研究擬在前期研究基礎上,建立一種同時測定棗葉中這5種黃酮含量的HPLC方法,并對不同品種的大棗及酸棗葉中的這5種黃酮的含量進行測定,為棗葉資源開發利用及相關產品質量控制提供新的檢測手段。
1 材料與方法
1.1材料與儀器
棗葉樣品共計14個品種(大酸棗、冬棗、贊皇大棗、敦煌大棗、大木棗、金絲小棗、串鈴、茶壺棗、無核棗、梨棗、晉棗、宣城圓棗、板棗、連縣木棗),均采自河北省滄縣國家棗樹良種繁育基地,采樣時間為2013年10月7日,采回后經真空冷凍干燥,放置在真空干燥器中備用;對照品:槲皮素-3-O-洋槐糖苷、蘆丁(槲皮素-3-O-蕓香糖苷)、槲皮素-3-O-β-D-葡萄糖苷、山奈酚-3-O-蕓香糖苷、槲皮素-3-O-α-L-阿拉伯糖-(1→2)-α-L-鼠李糖苷均由本實驗室從棗葉中分離提純,經HPLC-ESI-MS、1H-NMR和13C-NMR法鑒定[7]并與相關文獻[8-11]對比得到確證,通過HPLC峰面積歸一化法測得其純度≥95%;乙腈Honeywell Burdick&Jackson公司,色譜純,高效液相色譜(HPLC)流動相用;純凈水杭州娃哈哈集團有限公司;其余試劑為分析純。
Agilent 1200型HPLC由在線脫氣機,四元輸液泵,光電二極管陣列檢測器以及Agilent Chemstation色譜工作站組成,Agilent公司;配用CO-3010柱恒溫控制箱天津美瑞泰克科技有限公司;Hypersil BDS C18(4.6 mm×250 mm,5 μm)、Thermo Hypersil BDS C18(4.6 mm×250 mm,5 μm)、Lab Alliance Kromasil C18(4.6 mm×250 mm,5 μm)色譜柱大連依利特公司;TB-215D型微量分析天平德國賽多利斯股份有限公司;SK5200H型超聲振動儀上海波龍電子設備有限公司;FD-1B-50型冷凍干燥機北京博醫康實驗儀器有限公司;Anke TDL-5型離心機上海安亭科學儀器廠。
1.2實驗方法
1.2.1樣品前處理考察不同的提取溶劑:80%甲醇、50%甲醇、70%乙醇、95%乙醇的提取效果。準確稱取凍干的棗葉樣品1.000 g,放入研缽中,加入20 mL上述四種提取溶劑,研磨均勻后轉移至25 mL容量瓶中,超聲波(80 W)提取30 min,用提取溶劑定容,靜置3 min,取部分上清液于離心機上4000 r/min離心5 min,經0.45 μm濾膜過濾,用于HPLC測定。
1.2.2HPLC分析條件的選擇比較Hypersil BDS C18(4.6 mm×250 mm,5 μm),Thermo Hypersil BDS C18(4.6 mm×250 mm,5 μm),Lab Alliance Kromasil C18(4.6 mm×250 mm,5 μm)三種不同色譜柱的分離效果;比較甲醇-0.05%甲酸、甲醇-0.1%甲酸、乙腈-0.05%甲酸、乙腈-0.1%甲酸等不同流動相及不同的梯度洗脫程序;分析5種黃酮的檢測波長(掃描范圍210~400 nm),確定最合適的檢測波長。
1.2.3HPLC分析條件色譜柱Hypersil BDS C18(4.6 mm×250 mm,5 μm);流動相:A:1 mL/L甲酸水溶液;B:乙腈含1 mL/L的甲酸;梯度洗脫程序:0~16 min,15%B;16~20 min,15%~17%B;20~28 min,17%B;28~30 min,17%~22%B;30~35 min,22%~100%B;35~40 min,100%B;40~42 min,100%~15%B;42~52 min,15%B;流速為1 mL/min;柱溫30℃;DAD檢測器,檢測波長360 nm;進樣量:10 μL。
1.2.4標準溶液的配制與曲線的繪制精確稱取槲皮素-3-O-洋槐糖苷、蘆丁、槲皮素-3-O-β-D-葡萄糖苷、山奈酚-3-O-蕓香糖苷、槲皮素-3-O-α-L-阿拉伯糖-(1→2)-α-L-鼠李糖苷對照品溶于甲醇中,配制成1000 μg/mL的混合對照品貯備液。精密吸取貯備液,分別稀釋成500、250、100、50、10 μg/mL的混標溶液,置于樣品瓶中,4℃保存待用。按照1.2.3的色譜條件進行HPLC測定,以進樣濃度(X,μg/mL)為橫坐標,峰面積(Y,mv·s)為縱坐標,求出直線回歸方程,繪制標準曲線。
1.3數據處理
數據統計及處理軟件為Origin 6.0。
2 結果與分析
2.1提取溶劑的選擇
結果表明,采用70%乙醇作為提取溶劑時,5種黃酮類成分的峰面積均達到最大值,因此,確定70%乙醇水溶液為棗葉黃酮的提取溶劑。
2.2色譜柱及填料的比較
結果表明,盡管3種色譜柱的裝填尺寸相同,但使用Lab Alliance Kromasil C18色譜柱時槲皮素-3-O-洋槐糖苷與蘆丁會重合為一個峰,而使用Thermo Hypersil BDS C18色譜柱時,山奈酚-3-O-蕓香糖苷與槲皮素-3-O-α-L-阿拉伯糖-(1→2)-α-L-鼠李糖苷不能實現基線分離,而Hypersil BDS C18(4.6 mm× 250 mm,5 μm)色譜柱對5種黃酮均能實現很好的分離。
2.3檢測波長的選擇
鑒于實驗中5種黃酮苷成分母核骨架為槲皮素或山奈酚,在此僅列出槲皮素-3-O-洋槐糖苷和山奈酚-3-O-蕓香糖苷的紫外吸收光譜圖,見圖1,由圖1可以看出,紫外吸收光譜接近一致,分別在255~265 nm和355~360 nm有2個強吸收帶,且360 nm吸收帶更強,為提高方法的靈敏度,減少干擾,本實驗選擇波長更長的360 nm為檢測波長,使各組分均能得到較高的響應值。
2.4流動相的選擇
結果顯示,當用甲醇-水作為流動相梯度洗脫時,槲皮素-3-O-洋槐糖苷與蘆丁會重合為一個峰,不能實現分離。樣品用乙腈和水并按照上述1.2.3的梯度程序洗脫時,目標峰之間分離效果以及靈敏度均較好,所得色譜圖基線平穩。由于黃酮苷屬于多酚類成分,流動相中加入適量的酸可抑制拖尾,改善峰形,從而提高組分的分離度,因此實驗采用含0.1%甲酸的乙腈水溶液為流動相,采用15%乙腈的洗脫強度,16 min的等度洗脫,使難分離組分槲皮素-3-O-洋槐糖苷和蘆丁實現了分離,而在隨后的梯度洗脫條件下,樣品中的其他3種黃酮也都實現了基線分離。5種對照品和晉棗棗葉樣品的色譜圖見圖2。由圖2可以看到,在選定的分析條件下,樣品中的5種黃酮的色譜峰與其他雜峰在30 min內實現了良好分離,峰形對稱不拖尾。

圖1 槲皮素-3-O-洋槐糖苷(A)和山奈酚-3-O-蕓香糖苷(B)的紫外吸收光譜圖Fig.1 UV absorption spectra of quercetin 3-O-robinobioside(A)and kaempferol-3-O-rutinoside(B)

圖2 5種黃酮混合對照品(A)和晉棗棗葉樣品(B)的HPLC圖Fig.2 HPLC profile of flavonoid references(A)and jujube leaves sample(B)
2.5HPLC分析方法的評價
2.5.1精密度實驗取混合對照品溶液(槲皮素-3-O-洋槐糖苷、蘆丁、槲皮素-3-O-β-D-葡萄糖苷、山奈酚-3-O-蕓香糖苷、槲皮素-3-O-α-L-阿拉伯糖-(1→2)-α-L-鼠李糖苷的質量濃度均為0.25 μg/mL),按1.2.3中的色譜條件重復進樣分析,平行進樣5次,統計色譜峰的面積,計算相對標準偏差以評價方法的精密度,結果見表1,相對標準偏差(RSD)在0.59%~1.14%之間,表明儀器精密度良好。

表1 方法精密度的評價結果Table 1 Evaluation of the precision
2.5.2方法的回歸方程、線性范圍和最低檢出限按1.2.4步驟配制混合對照品系列標準溶液,按1.2.3色譜條件在10~1000 μg/mL濃度范圍進樣分析,評價方法的線性回歸方程、相關系數和線性范圍,并以3倍信噪比所對應的進樣濃度求得最低檢出限,結果列于表2。結果表明,響應值與進樣量之間具有良好線性相關性,相關系數介于0.9996~0.9999之間,最低檢出限較低(1.44~2.59 μg/mL),可以滿足常規樣品的定量分析。

表2 回歸方程、相關系數、線性范圍和最低檢出限Table 2 The regression equation,correlation coefficient,linear range and minimum detection limit
2.5.3方法的加標回收率實驗分別準確稱取已知質量的對照品,按其在棗葉中常規含量確定相應的加標水平,并以棗葉(冬棗)為樣品按1.2.1所述方法進行處理,平行做5份加標實驗,并按1.2.3中的色譜條件分別測定未加標樣品和加標樣品,進行分析。統計計算各成分的加標回收率,結果見表3。結果表明,5種黃酮的回收率介于93.8%~105.9%之間,RSD為0.84%~2.42%,回收率均較高,可滿足常規定量分析需要。
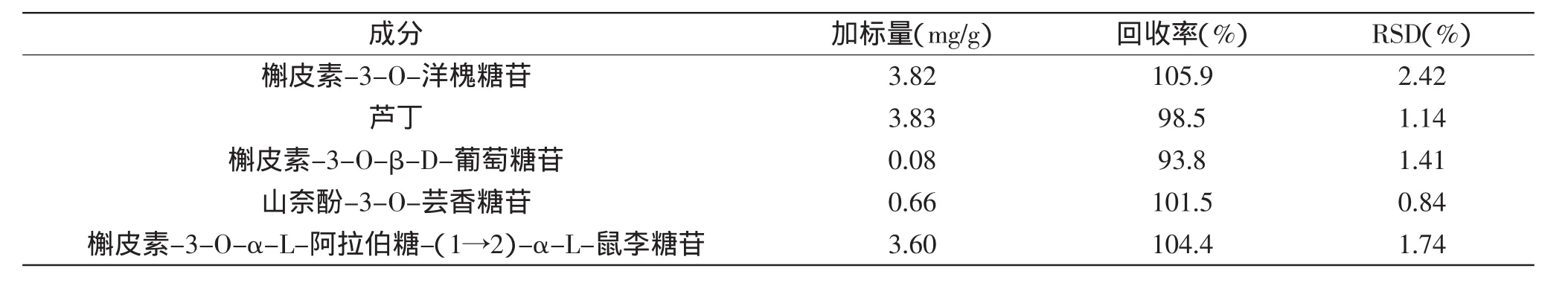
表3 5種黃酮的加標回收率Table 3 Recoveries of 5 flavonoids
2.6不同品種棗葉中5種黃酮的含量測定
按照1.2所述的方法,對秋季采集的14個品種棗葉中5種黃酮的含量進行分析,結果見表4。
表4 不同品種棗葉中5種黃酮的含量測定結果(±SD,mg/g D.W)Table 4 Determination results of 5 flavonoids content in jujube leaves among different cultivars(±SD,mg/g D.W)
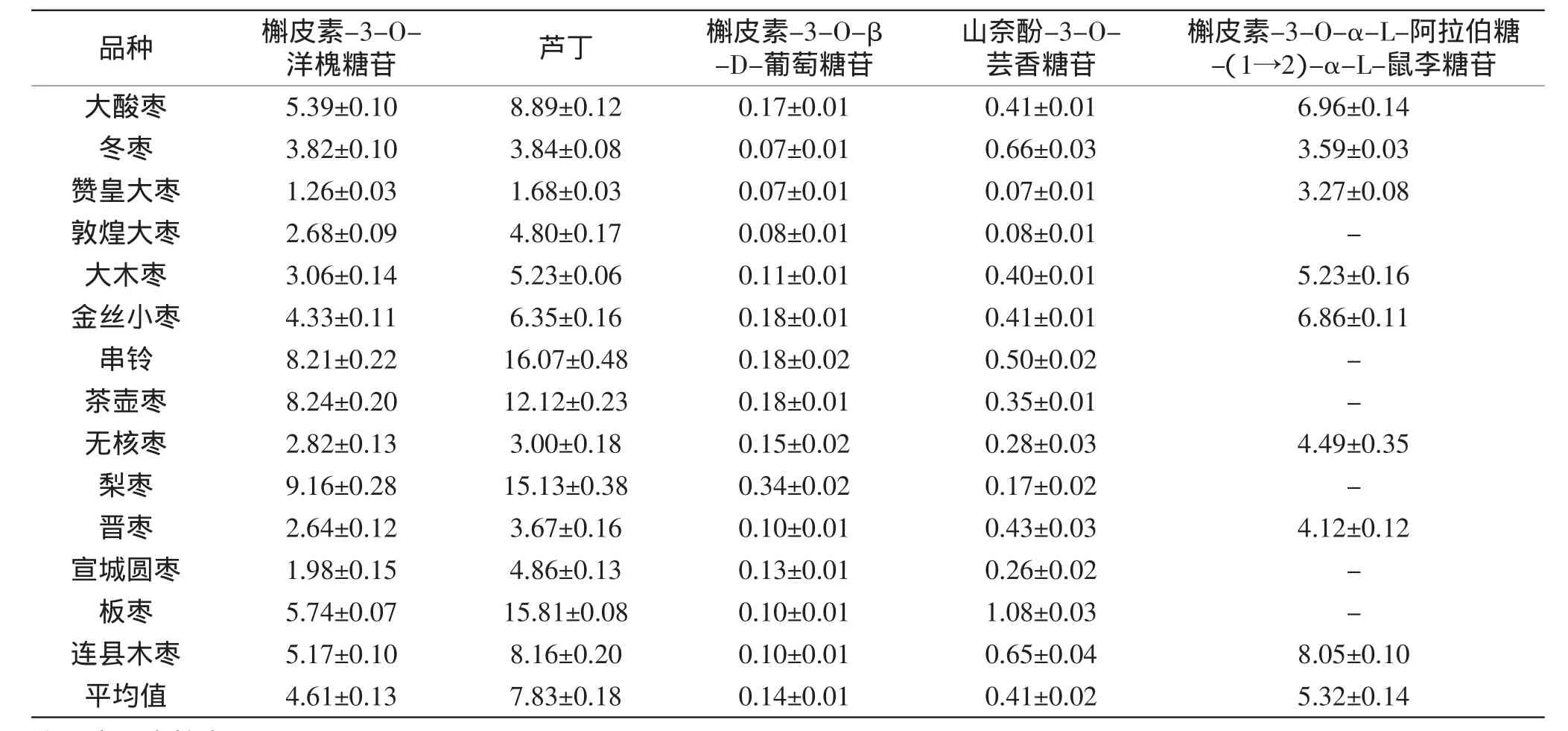
表4 不同品種棗葉中5種黃酮的含量測定結果(±SD,mg/g D.W)Table 4 Determination results of 5 flavonoids content in jujube leaves among different cultivars(±SD,mg/g D.W)
注:-表示未檢出。
品種 槲皮素-3-O-洋槐糖苷 蘆丁 槲皮素-3-O-β-D-葡萄糖苷山奈酚-3-O-蕓香糖苷槲皮素-3-O-α-L-阿拉伯糖-(1→2)-α-L-鼠李糖苷大酸棗 5.39±0.10 8.89±0.12 0.17±0.01 0.41±0.01 6.96±0.14冬棗 3.82±0.10 3.84±0.08 0.07±0.01 0.66±0.03 3.59±0.03贊皇大棗 1.26±0.03 1.68±0.03 0.07±0.01 0.07±0.01 3.27±0.08敦煌大棗 2.68±0.09 4.80±0.17 0.08±0.01 0.08±0.01 -大木棗 3.06±0.14 5.23±0.06 0.11±0.01 0.40±0.01 5.23±0.16金絲小棗 4.33±0.11 6.35±0.16 0.18±0.01 0.41±0.01 6.86±0.11串鈴 8.21±0.22 16.07±0.48 0.18±0.02 0.50±0.02 -茶壺棗 8.24±0.20 12.12±0.23 0.18±0.01 0.35±0.01 -無核棗 2.82±0.13 3.00±0.18 0.15±0.02 0.28±0.03 4.49±0.35梨棗 9.16±0.28 15.13±0.38 0.34±0.02 0.17±0.02 -晉棗 2.64±0.12 3.67±0.16 0.10±0.01 0.43±0.03 4.12±0.12宣城圓棗 1.98±0.15 4.86±0.13 0.13±0.01 0.26±0.02 -板棗 5.74±0.07 15.81±0.08 0.10±0.01 1.08±0.03 -連縣木棗 5.17±0.10 8.16±0.20 0.10±0.01 0.65±0.04 8.05±0.10平均值 4.61±0.13 7.83±0.18 0.14±0.01 0.41±0.02 5.32±0.14
由表4可以看出,在14個不同品種的棗葉中均檢測出槲皮素-3-O-洋槐糖苷、蘆丁、槲皮素-3-O-β-D-葡萄糖苷、山奈酚-3-O-蕓香糖苷4種黃酮,但其含量存在較大差異。14個品種棗葉中蘆丁的含量最高,平均7.83 mg/g,其中串鈴、梨棗和板棗中的含量高達15~16mg/g;在本研究中由于實現了槲皮素-3-O-洋槐糖苷與蘆丁的分離,使得前者的含量可以單獨進行統計,其在14個品種中的含量僅次于蘆丁,平均4.61 mg/g,在串鈴、茶壺棗和梨棗中其含量均超過8 mg/g,是棗葉中的重要黃酮成分。槲皮素-3-O-α-L-阿拉伯糖-(1→2)-α-L-鼠李糖苷是一種特殊的黃酮成分,僅在8個品種中檢出,平均含量為5.32 mg/g。其余2種黃酮,槲皮素-3-O-β-D-葡萄糖苷和山奈酚-3-O-蕓香糖苷,在14個品種棗葉中含量較低,平均值分別為0.14和0.41 mg/g。
3 結論
本文建立了一種同時測定棗葉中5種黃酮的反相高效液相色譜法,通過對色譜條件的優化,在選定的分析條件下,5種黃酮在30 min內實現了良好的分離,且該方法最低檢出限較低(1.44~2.59 μg/mL),加標回收率均在93%以上。該方法簡單準確、靈敏、重復性好,可用于棗葉中黃酮成分的定量分析。采用建立的方法對14個不同品種棗葉5種黃酮的含量進行了分析,結果表明,不同品種棗葉中這些黃酮類成分的組成和含量有較大差異,蘆丁和槲皮素-3-O-洋槐糖苷是棗葉中含量最高的兩種黃酮。
[1]Guo S,Duan J A,Tang Y P,et al.Simultaneous qualitative and quantitative analysis of triterpenic acids,saponins and flavonoids in the leaves of two Ziziphus species by HPLC-PDAMS/ELSD[J].J Pharm Biomed Anal,2011,56(2):264-270.
[2]Zhang R,Chen J,Shi Q,et al.Quality control method for commercially available wild jujube leaf tea based on HPLC characteristic fingerprint analysis of flavonoid compounds[J].J Sep Sci,2014,37(1-2):45-52.
[3]Zhang R,Chen J,Shi Q,et al.Phytochemical analysis of Chinese commercial available Ziziphus jujube leaf tea using high performance liquid chromatography-electrospray ionization-time[4]李蘭芳,趙淑云.不同生長期酸棗葉中總黃酮和蘆丁的含量測定[J].中國中藥雜志,1992,17(2):81.
of flight mass spectrometry[J].Food Res Int,2014,56:47-54.
[5]裴香萍,杜晨暉,閆艷,等.HPLC-UV測定不同產地及不同采收期酸棗葉中蘆丁的含量[J].中國實驗方劑學雜志,2011,17(21):94-96.
[6]張倩倩,崔慶玲,劉曉秋,等.HPLC法同時測定酸棗葉中蘆丁等4種黃酮苷的含量[J].沈陽藥科大學學報,2014,1:7.
[7]李喜悅,高哲,崔璨,等.棗葉黃酮類成分的分離鑒定及其抗氧化活性研究[J].食品工業科技,2015,36,(10):135-138.
[8]郝福玲,方訪,凌鐵軍,等.夾竹桃葉化學成分的研究[J].安徽農業大學學報,2013,40(5):795-801.
[9]Deng S,Deng Z,Fan Y,et al.Isolation and purification of three flavonoid glycosides from the leaves of Nelumbo nucifera(Lotus)by high-speed counter-current chromatography[J].J Chromatogr B,2009,877(24):2487-2492.
[10]Juan-Badaturuge M,Habtemariam S,Thomas M J K. Antioxidant compounds from a South Asian beverage and medicinal plant,Cassia auriculata[J].Food Chem,2011,125(1):221-225.
[11]石心紅,王宇行,孔令義.準噶爾大戟根中黃酮類成分的研究[J].中國藥學雜志,2006,41(20):1538-1540.
Determination of five flavonoids in jujube leaves by HPLC
LI Xi-yue,GAO Zhe,WANG Rong-fang,CUI Can,AN Xiao-nan,CUI Tong*
(College of Food Science and Technology,Agricultural University of Hebei,Baoding 071000,China)
The purpose was to establish a method for determining flavonoids in jujube leaves using HPLC,and analyze flavonoids contents in jujube leaves from 14 different cultivars by this method.The samples were separated on a Hypersil BDS C18column,the mobile phase consisted acetonitrile and water with 0.1%formic acid,separations were achieved by a gradient elution program,the flow rate was 1 mL/min,the column temperature was 30℃ and the detection wavelength was at 360 nm.Under these conditions,five flavonoids including quercetin-3-O-robinobioside,rutin,quercetin-3-O-β-D-glucoside,kaempferol-3-O-rutinoside and quercetin-3-O-α-L-arabinosyl-(1→2)-α-L-rhamnoside were detected by one injection.The minimum detection limit was 1.44~2.59 μg/mL.The average recovery rate was 93.8%~105.8%.The results revealed that in terms of flavonoids,the difference of the composition and contents among the different cultivars was siginificant.The average contents of rutin and quercetin-3-O-robinobioside were 7.83 and 4.61 mg/g D.W,respectively,which were higher compared with other flavonoids.Only 8 cultivars detected the existence of quercetin-3-O-α-L-arabinosyl-(1→2)-α-L-rhamnoside,whose average contents was 5.32 mg/g D.W. However,the contents of quercetin-3-O-β-D-glucoside and kaempferol-3-O-rutinoside were lower,they were 0.14 and 0.41 mg/g D.W,respectively.
HPLC;jujube leaves;flavonoids;rutin;quercetin-3-O-robinobioside
TS201.1
A
1002-0306(2015)18-0049-05
10.13386/j.issn1002-0306.2015.18.001
2015-01-16
李喜悅(1990-),女,在讀碩士研究生,研究方向:功能食品化學,E-mail:lixiyue123456@163.com。
崔同(1956-),男,教授,研究方向:天然產物活性成分分析,E-mail:cuitong98@aliyun.com。
國家林業公益性行業科研專項(201304708)。

