脂質體在食品中的應用及體外消化研究進展
劉瑋琳,魏富強,韓劍眾*
(浙江工商大學食品與生物工程學院,浙江省食品安全重點實驗室,浙江 杭州 310035)
脂質體在食品中的應用及體外消化研究進展
劉瑋琳,魏富強,韓劍眾*
(浙江工商大學食品與生物工程學院,浙江省食品安全重點實驗室,浙江 杭州310035)
脂質體是由雙親性物質如磷脂組成的內部為水相、具有類細胞膜結構的雙分子層閉合囊泡,因其具有保護、運載、靶向和緩釋等特點,目前已在食品營養、醫藥、化妝品、農業等領域表現出極大的應用潛能。本文簡要介紹了脂質體的性質及特點,重點綜述了脂質體在脂類、抗氧化劑、酶與蛋白質以及維生素和礦物質等食品領域的研究及應用,最后概述了脂質體作為食品營養因子運載體系在模擬體外胃和腸道消化的研究進展。
脂質體;食品;體外消化
脂質體是由雙親性物質如磷脂組成的內部為水相、具有類細胞膜結構的雙分子層閉合囊泡,基于脂類的運載體系可將其分為兩類,一類由簡單的油脂構成,另一類由油相、水相、表面活性劑以及助表面活性劑等通過自分散方式形成。后者研究應用較廣,如微乳液、脂質體、固相脂質納米粒、納米結構化脂質運載體等。自1965年英國的Bangham等[1]發現磷脂在水中可以自發形成脂質體以來,經過近50a的發展,作為一種代表性的脂類運載體,脂質體的研究已形成了較為成熟的科學理論,在食品營養、藥品、化妝品、農業等諸多領域已有廣泛運用。利用脂質體對油溶性成分如中鏈脂肪酸和二十二碳六烯酸(docosahexaenoic acid,DHA)、水溶性成分如水溶性維生素和水溶性的抗氧化劑等功能成分的包封與運載,可提高其穩定性和生物利用率,達到定時、定位釋放的目的。作為口服運載體系,脂質體在胃腸道中的消化行為是功能成分能否被有效利用的關鍵,揭示在此過程中壁材結構變化和芯材釋放動力學,是脂質體當前最具挑戰和最有價值的研究。因此,本文對脂質體在食品領域的研究現狀進行了綜述,并總結了脂質體在體外模擬胃腸道消化的研究進展,為拓展脂質體在食品領域中的應用和脂質體的消化研究提供一定的信息和依據。
1 脂質體簡介
脂質體(liposome)是脂類分子(類脂)的自組裝體,具有一個或多個具有類似生物膜結構的脂類雙分子層中間包覆微水相的結構,可以天然存在也可以人工合成,是一種被廣泛研究的遞送系統[2]。根據脂質體的大小和磷脂雙層膜的數量,目前主要將脂質體分為三類:多層(multilamellar vesicle,MLV)、多囊(multivescular vesicle,MV)和單層的脂質體,其中單層又可細分為大單層(large unilamellar vesicles,LUV)和小單層(single unilamellar vesicles,SUV)等。脂質體壁材主要由磷脂和膽固醇組成,其中磷脂主要有天然磷脂(如大豆磷脂和蛋黃卵磷脂)、改性磷脂(天然磷脂改性物如改性大豆磷脂,以及合成類脂分子如二棕櫚酰磷脂酰膽堿(dipalmitoyl phosphatidylcholine,DPPC)、二棕櫚酰磷脂酰乙醇胺(1,2-dipalmitoyl-sn-glycero-3-phosphoethanolamine,DPPE)、二硬脂酰磷脂酰膽堿(disaturated phosphatidylcholine,DSPC)等)。脂質體的形成機理尚無完全定論,最具代表性的觀點是基于兩親性化合物(主要是磷脂)和水分子之間發生相互作用,磷脂的親水性頭部處于膜的內外表面層,疏水性的尾端則位于膜的中間,形成了頭對頭、尾接尾的膜壁厚度約為5~7 nm的囊泡結構。該結構使其能夠同時運載疏水、親水和兩親性的物質,或被包封在內部水相,或是嵌插入類脂雙分子層之間[3-4]。脂質體的制備技術較為成熟,傳統方法主要有薄膜分散法[5]、逆向蒸發法[6]、乙醇注入法[7]、高壓均質法[8]、超聲法[9]等;新開發的有薄膜分散-動態高壓微射流法[10]、動態高壓微射流-凍融法[11]、動態高壓微射流-乙醇注入法[12]、加熱法[13]等。脂質體的制備方法不同,得到的脂質體性質亦有差異。基于脂質體獨特的性質,目前脂質體的研究和應用主要集中在醫藥、食品、化妝品、農業、礦業等領域。其中,在食品領域主要用于保護和控制不穩定或易揮發的親水、親油性功能因子的釋放,例如抗氧化劑、酶、抗菌劑等[14-16];另外,脂質體作為口服運載體系,其最大的價值是在胃腸道消化過程中對包埋物的保護、控釋、靶向和提高生物利用率等作用[17-20],近幾年對于脂質體在胃腸道消化的研究已成前沿陣地。
2 脂質體在食品中的研究進展
食品級脂質體用于營養因子及功能成分的包埋和運載具有無毒、雙親性和生物可降解等特點,主要體現在以下三個方面:1)提高功能性營養物在貯藏和消化過程的穩定性和生物利用度;2)控制被包埋物質的定點、定時釋放;3)改善食品質構。
2.1脂質體包埋脂類
脂類如DHA、二十碳五烯酸 (eicosapntemacnioc acid,EPA)和精油等分子含有不飽和鍵,易被氧化及光照破壞結構,遇到金屬離子或是受熱則會加速其分解。將脂類包裹于脂質體是近年開拓的新方向[21],目前已有部分相關報道:Bai Chunqing等[22]采用乙醇注入法結合噴霧干燥制備脂質體包封薏米油,克服薏米油的生物性不穩定和水溶性差等缺點,提高其在腸道的吸收。Eckert等[23]采用薄膜分散法制備脂質體包埋DHA,其能維持或恢復生理膜的性能,并增強細胞膜的流動性,促進N端淀粉樣前蛋白片段的分泌,進而提高神經元存活率。Liu Weilin等[24]采用動態高壓微射流-凍融法制備中鏈脂肪酸(medium chain fatty acids,MCFAs)脂質體,既能克服MCFAs口感差的缺點,亦可作為肥胖癥者潛在的能量物質替代品,減少和抑制其體內能量和脂肪的蓄積。Nieto等[25]采用薄膜分散結合超聲法制備脂質體包埋迷迭香葉蒸餾提取精油和百里香葉蒸餾提取精油,結果發現該脂質體在食品和肉類的保護上能起到良好的作用。Liu Wei等[21]采用高壓微射流技術結合傳統薄膜分散法制備的MCFAs脂質體,能為小鼠快速提供能量,達到抗疲勞的功能。另外,Yang Shuibing[26]和Liu Chengmei[27]等還分別報道了采用凍干法制備MCFAs-VC脂質體和MCFAs脂質體。Liolios等[28]采用薄膜分散法制備脂質體包埋百里香油,提高百里香油的穩定性。Martin-Creuzburg等[29]采用薄膜分散法制備脂質體包埋膽固醇或EPA,研究膽固醇對藍藻類食品品質的影響。Jenski等[30]采用薄膜分散結合超聲法制備脂質體包埋ω-3脂肪酸(DHA),顯著提高脂肪酸穩定性。
2.2脂質體包埋抗氧化劑
利用脂質體等運載技術包埋抗氧化劑是脂質體在食品行業研究最深入、應用最廣泛的一個方向。由于抗氧化劑對光、熱、氧氣、pH值和酶等極為敏感,采用脂質體包埋技術一方面可以改善其穩定性、延長貨架期,另一方面可提高抗氧化劑的生物利用率。目前,該方向的研究主要分為以下三類:1)提高抗氧化劑的穩定性。Zou Liqiang等[12]利用動態高壓微射流-乙醇注入法制備茶多酚納米脂質體(tea polyphenol nanoliposome,TPN),結果表明TPN與茶多酚具有相同的抗氧化性,但TPN在堿性環境中的穩定性明顯高于茶多酚。Gibis等[31]采用大豆卵磷脂制備的脂質體包埋多酚,所得脂質體粒徑小于100 nm,物理穩定性較好,并且該脂質體貯藏150 d后產生的己醛含量(<15 μmol/L)相比未用脂質體包埋的多酚含量(>717 μmol/L)顯著減少。2)氧化應激效應。Vanaja等[32]采用薄膜水化法制備白藜蘆醇脂質體,研究表明白藜蘆醇脂質體的抗氧化性比白藜蘆醇單獨存在時更強,并且VC和白藜蘆醇脂質體清除細胞內活性氧沒有表現出協同作用。Locatelli等[33]通過高壓均質法制備丁香酰胺脂質體,結果表明從可可豆提取的丁香酰胺和多酚類物質能顯著地抑制脂質過氧化,清除脂質產生的自由基。3)抗氧化劑與脂質體的相互作用機制。Gibis等[34]通過高壓均質法制備葡萄籽提取物脂質體,并用殼聚糖作為第一層表面修飾劑,果膠作為第二修飾劑,結果發現殼聚糖修飾的脂質體能在帶有不同電荷的蛋白質間產生靜電相互作用,進而降低乳清蛋白和酪蛋白的沉淀,因而作者認為殼聚糖脂質體能用來開發葡萄籽提取物的功能性食品。Kim等[35]則采用薄膜分散法制備類黃酮槲皮素-花旗松素脂質體,通過差示掃描量熱技術觀察到類黃酮槲皮素-花旗松素能使脂質體膜的親脂性增強,并且改變了脂質體雙分子層的相變溫度,使其從雙層結構變成六角形結構。除以上研究外,還有部分關于脂質體運載抗氧化劑的報道,見表1。
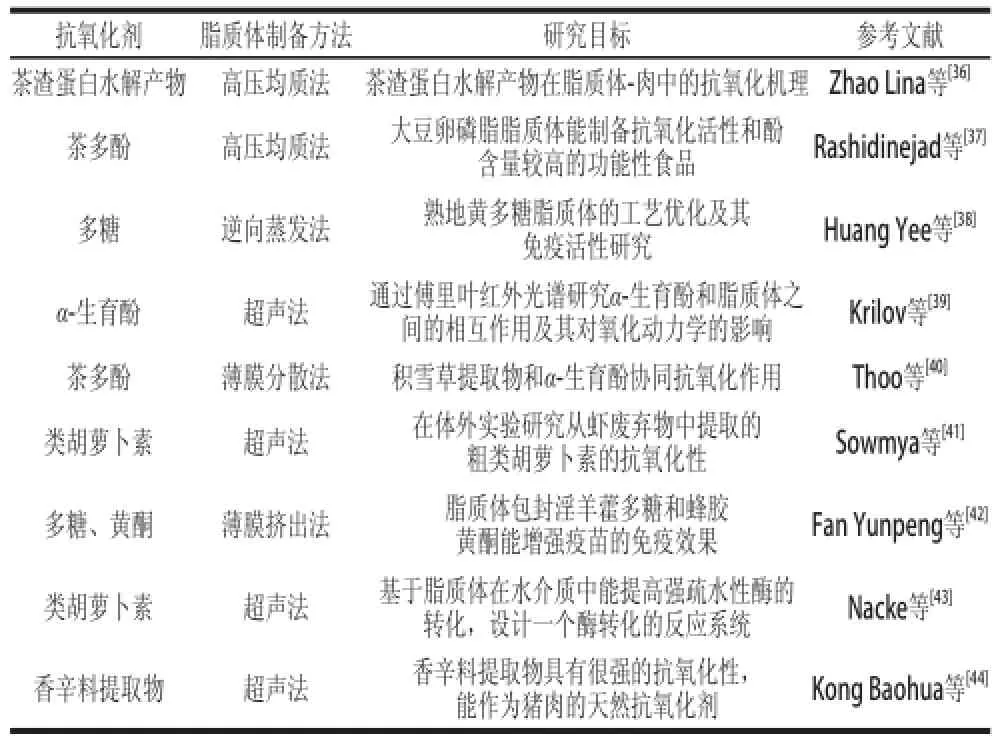
表1 脂質體在食品抗氧化劑中的研究Table 1 Application of liposomes in food antioxidants
2.3脂質體包埋蛋白質和酶
脂質體包裹蛋白質和多肽等是食品級脂質體的另一個重要研究方向。Liu Weilin等[45]采用薄膜分散法制備乳鐵蛋白脂質體,研究表明在脂質體的包封作用下而達到保護乳鐵蛋白,避免其在胃液消化時受胃蛋白酶的影響,而使其在小腸部位進行消化吸收,進而達到控制釋放的特性及提高乳鐵蛋白的利用率。Maherani等[46]發現通過納米脂質體包封天然二肽抗氧化劑(L-肌肽)可以解決食品保鮮的相關問題,例如減少活性物質在食品體系復雜反應中的氧化、降低發生在食品表面微生物引起的變質以及氧化酸敗等。Sant'Anna等[47]研究脂質體包封保護性細菌素P34對美拉德反應產物的抑制作用,結果表明脂質體能針對食品中的化合物提供保護作用,并且在食品熱處理過程中可提高此抗生物肽的穩定性。
脂質體包埋酶的技術主要是應用在干酪成熟中,如早期的Kheadr等[48]通過脂質體包埋酶(脂肪酶、細菌蛋白酶、霉菌蛋白酶、風味蛋白酶),可加速蛋白質水解和奶酪的成熟時間,從而改善奶酪的感官特性;隨后,Nongonierma等[49]采用微射流法制備乳酸菌無細胞提取物脂質體,研究表明脂質體不影響干酪的水分活度和微生物,反而能降低無細胞提取物生物的乳清損失,最大限度地加速干酪的成熟。此外,人們還采用脂質體技術包裹其他食品級的酶制劑,如徐冉等[50]采用逆向蒸發法制備溶菌酶脂質體并研究其對生物膜的剝離作用,結果表明溶菌酶脂質體能夠有效控制細菌污染。Jahadi等[51]采用加熱法制備風味蛋白酶脂質體,結果表明45 ℃、pH 6制備的風味蛋白酶脂質體最穩定,蛋白酶包埋率及其活力分別為26.5%、9.96 LAPU/mL。
2.4脂質體包埋維生素和礦物質
維生素因易受光照、熱或氧氣等外界環境影響導致氧化變性,應用受限。當前用以提高維生素功效的手段諸多,包埋技術的貢獻尤為突出,如乳液[47]、納米脂質體[9]、納米粒[52]等均被開發用以包裹維生素。其中,脂質體在生物可降解、能同時包裹親水、親油類維生素等方面表現出了獨特優勢。Laouini等[53]采用膜技術結合乙醇注入法制備包裹了VE的類脂E80脂質體,通過透射電鏡觀察呈現多層結構囊泡狀,并且該制備方法的重復性較高,包埋率可達到99.87%。Yang Shuibing等[54]采用動態高壓微射流結合膜蒸發技術制備VC納米脂質體,結果表明VC納米脂質體和VC的生物活性相當,在37 ℃條件下能貯藏1 d或者在4 ℃條件下能貯藏60 d,前者穩定性更好,并且相比于其他方法制備的VC脂質體,該法制備的脂質體表現出更高的皮膚滲透率。Marsanasco等[55]采用大豆-磷脂酰膽堿制備同時包埋了VE和VC的脂質體用于橙汁品質改良,結果表明脂質體的加入可改善橙汁的感官特性,而且經巴氏殺菌和在4 ℃條件下貯藏37 d后橙汁的微生物指示仍舊合格。Liu Nan等[9]采用超聲法制備殼聚糖修飾的VE納米脂質體,包埋率為99%,該脂質體可有效降低芯材的降解,并且在4 ℃條件下貯藏8 周后包埋率仍可維持在近90%。
脂質體包埋礦物質可用于食品基質的強化。Ding Baomiao等[56]采用逆向蒸發法制備甘氨酸亞鐵納米脂質體,在電透鏡下觀察其結構為球形,模擬體外胃腸環境中具有較高的穩定性,該脂質體可克服亞鐵口服制劑不穩定性的缺點,是種潛在的食品營養強化劑。Xia Shuqin等[57]采用逆向蒸發法制備硫酸亞鐵脂質體,包埋率為67%,在牛奶中添加該脂質體后鐵質量濃度可強化到15 mg/L,100 ℃加熱30 min滅菌后在4 ℃條件下貯藏一周后仍保持穩定。
3 脂質體的體外消化研究現狀
從最初的醫藥行業發展到近十幾年的食品營養領域,脂質體作為運載體系的研究重心一直是如何采用更好的技術手段,能更有效地包裹各種類型的功能物質,進而通過物理化學性質的表征評價脂質體的生物學效能。近幾年,人們發現除了芯材的選取和制備工藝的優化等對食品級脂質體的性能有較大影響之外,脂質體攝入人體后在胃腸道消化的結構穩定性及與其他膳食成分或胃腸道黏膜細胞的相互作用機制,亦是脂質體能否到達靶向器官、將活性成分有效傳遞利用的關鍵。
目前,該方向的研究正處于起步階段,一方面是研究具有不同的壁材或包裹各種芯材的脂質體在消化過程中的結構與性質變化,如Liu Weilin等[58]采用薄膜分散法和動態高壓微射流技術分別制備粗脂質體和納米脂質體,結果表明脂質體在模擬胃液消化時物理和化學性質受胃蛋白酶的影響較小,而在模擬小腸的消化中脂質體磷脂壁受到較大破壞,并且研究還表明從牛奶中提取磷脂制備脂質體比從大豆中提取磷脂制備脂質體穩定。Rashidinejad等[37]采用高壓均質法制備茶多酚脂質體和兒茶素脂質體,結果表明大豆卵磷脂脂質體能成功包裹不同類型的抗氧化劑,并可添加到食品中,用以控制抗氧化劑在體內和體外胃腸道消化過程中的有效釋放。另一方面是關注修飾脂質體的消化特性,如Peng Hailong等[59]基于殼聚糖聚電解質修飾脂質體制備聚合物脂質體,比傳統的未修飾脂質體具有更高的包埋率(82.46%)和更強的緩釋功能,而且在體外模擬胃腸道中的釋放依賴于釋放介質的pH值,他們認為聚合物脂質體是一種很有潛力的載體,能用于生產含有紅景天苷或其他生物活性成分的功能性食品。Liu Weilin等[60]基于層層自組裝技術制備海藻酸-殼聚糖雙層聚電解質修飾的納米脂質體,研究其物化穩定性和體外消化穩定性后發現,脂質體表面的聚電解質通過空間位阻作用可提高脂質體的離子和熱穩定性,并且該脂質體在胃腸道消化中可更有效地防止芯材的泄漏。
然而,目前食品級脂質體的消化研究非常匱乏,正如Hermida等[61]指出極少的研究關注脂質體在胃腸消化后結構是否保持完整,也沒有詳實的理論解釋脂質體在胃腸道環境中的行為;Hur[62]和Benshitrit[63]等也認為,當前基于可食性脂質壁材制備的運載體系(包括脂質體)在不同人群消化的研究較少,特別是對于脂質體在特殊人群消化的結構變化和包埋物的釋放調控缺乏科學認識,這些問題在很大程度上都制約著脂質體作為食品營養物運載體系的研究和應用。
4 結 語
隨著各種表征技術如電子顯微鏡、色譜光譜儀等的進一步發展以及人們對脂質體在在食品領域研究的逐漸深入,基于目前的研究進展,未來脂質體在食品領域可能在以下兩個方向有所突破:1)通過與物理化學、微生物學、藥代動力學等學科領域的交叉,建立食品級脂質體與其他成分、脂質體結構與功能特性之間的關系,為發展更多、更新的食品運載體系帶來新契機;2)研究食品級脂質體在不同人群的胃腸道消化過程中的結構完整性和釋放動力學,克服脂質體的技術瓶頸,為脂質體的靶向釋放和控制釋放提供技術指導。
[1]BANGHAM A D, STANDISH M M, WATKINS J C. Diffusion of univalent inos across the lamella of swollen phospholipids[J]. Journal of Molecular Biology, 1965, 13(1): 238-252.
[2]LASIC D D, PAPAHADJOPOULOS D. Liposomes revisited[J]. Science, 1995, 267: 1275-1276.
[3]GOYAL P, GOUAL K, VIJAYA KUMAR S G, et al. Liposomal drug delivery systems-clinical applications[J]. Acta Pharmaceutica, 2005,55(1): 1-25.
[4]JESORKA A, ORWAR O. Liposomes: technologies and analytical applications[J]. Annual Review of Analytical Chemistry, 2008, 1: 801-832.
[5]PUPO E, PADRON A, SANTANA E, et al. Preparation of plasmid DNA-containing liposomes using a high-pressure homogenizationextrusion technique[J]. Journal of Controlled Release, 2005, 104(2):379-396.
[6]ZHENG Xiaoli, LU Jianping, DENG Li, et al. Preparation and characterization of magnetic cationic liposome in gene delivery[J]. International Journal of Pharmaceutics, 2009, 366(1): 211-217.
[7]樂文慧, 黃早成, 肖蘇堯, 等. 白藜蘆醇固體脂質體制備工藝研究[J].食品科學, 2010, 31(18): 59-62.
[8]YANG Li, YANG Wenzhan, BI Dianzhou, et al. A novel method to prepare highly encapsulated interferon-α-2b containing liposomes for intramuscular sustained release[J]. European Journal of Pharmaceutics and Biopharmaceutics, 2006, 64(1): 9-15.
[9]LIU Nan, PARK Hyunjin. Chitosan-coated nanoliposome as vitamin E carrier[J]. Journal of Microencapsulation, 2009, 26(3): 235-242.
[10] 鄭會娟, 劉成梅, 劉偉, 等. 中鏈脂肪酸脂質體的制備及其性質測定[J].食品科學, 2010, 31(22): 170-175.
[11] LIU Weilin, LIU Wei, LIU Chengmei, et al. Preparation and evaluation of easy energy supply property of medium-chain fatty acids liposomes[J]. Journal of Microencapsulation, 2011, 28(8): 783-790.
[12] ZOU Liqiang, LIU Wei, LIU Weilin, et al. Characterization and bioavailability of tea polyphenol nanoliposome prepared by combining an ethanol injection method with dynamic high-pressure microfluidization[J]. Journal of Agricultural and Food Chemistry,2014, 62(4): 934-941.
[13] MORTAZAVI S M, MOHAMMADABADI M R, KHOSRAVIDARANI K, et al. Preparation of liposomal gene therapy vectors by a scalable method without using volatile solvents or detergents[J]. Journal of Biotechnology, 2007, 129(4): 604-613.
[14] MIN B, CORDRAY J C, AHN D U. Antioxidant effect of fractions from chicken breast and beef loin homogenates in phospholipid liposome systems[J]. Food Chemistry, 2011, 128(2): 299-307.
[15] AILI D, MAGER M, ROCHE D, et al. Hybrid nanoparticle-liposome detection of phospholipase activity[J]. Nano Letters, 2010, 11(4):1401-1405.
[16] da SILVA MALHEIROS P, DAROIT D J, BRANDELLI A. Food applications of liposome-encapsulated antimicrobial peptides[J]. Trends in Food Science & Technology, 2010, 21(6): 284-292.
[17] CHIOU C J, TSENG L P, DENG Mingchung, et al. Mucoadhesive liposomes for intranasal immunization with an avian influenza virus vaccine in chickens[J]. Biomaterials, 2009, 30(29): 5862-5868.
[18] LASIC D D. Liposomes within liposomes[J]. Nature, 1997, 387:26-27.
[19] ANDERSON L J, HANSEN E, LUKIANOVA-HLEB E Y, et al. Optically guided controlled release from liposomes with tunable plasmonic nanobubbles[J]. Journal of Controlled Release, 2010,144(2): 151-158.
[20] MANCONI M, NACHER A, MERINO V, et al. Improving oral bioavailability and pharmacokinetics of liposomal metformin by glycerolphosphate-chitosan microcomplexation[J]. AAPS PharmSciTech, 2013, 14(2): 485-496.
[21] LIU Wei, LIU Weilin, LIU Chengmei, et al. Medium-chain fatty acid nanoliposomes for easy energy supply[J]. Nutrition, 2011, 27(6): 700-706.
[22] BAI Chunqing, PENG Hailong, XIONG Hua, et al. Carboxymethylchitosan-coated proliposomes containing coix seed oil: characterisation, stability and in vitro release evaluation[J]. Food Chemistry, 2011, 129(4): 1695-1702.
[23] ECKERT G P, CHANG S, ECKMANN J, et al. Liposomeincorporated DHA increases neuronal survival by enhancing nonamyloidogenic APP processing[J]. Biochimica et Biophysica Acta(BBA)-Biomembranes, 2011, 1808(1): 236-243.
[24] LIU Weilin, LIU Wei, LIU Chengmei, et al. Medium-chain fatty acid nanoliposomes suppress body fat accumulation in mice[J]. British Journal of Nutrition, 2011, 106(9): 1330-1336.
[25] NIETO G, HUVAERE K, SKIBSTED L H. Antioxidant activity of rosemary and thyme by-products and synergism with added antioxidant in a liposome system[J]. European Food Research and Technology, 2011, 233(1): 11-18.
[26] YANG Shuibing, LIU Chengmei, LIU Wei, et al. Preparation and characterization of nanoliposomes entrapping medium-chain fatty acids and vitamin C by lyophilization[J]. International Journal of Molecular Sciences, 2013, 14(10): 19763-19773.
[27] LIU Chengmei, YANG Shuibing, LIU Wei, et al. Preparation and characterization of medium-chain fatty acid liposomes by lyophilization[J]. Journal of Liposome Research, 2010, 20(3): 183-190.
[28] LIOLIOS C C, GORTZI O, LALAS S, et al. Liposomal incorporation of carvacrol and thymol isolated from the essential oil of Origanum dictamnus L. and in vitro antimicrobial activity[J]. Food Chemistry,2009, 112(1): 77-83.
[29] MARTIN-CREUZBURG D, von ELERT E, HOFFMANN K H. Nutritional constraints at the cyanobacteria-Daphnia magna interface:the role of sterols[J]. Limnology and Oceanography, 2008, 53(2):456-468.
[30] JENSKI L J, ZEROUGA M, STILLWELL W. Omega-3 fatty acidcontaining liposomes in cancer therapy[J]. Experimental Biology and Medicine, 1995, 210(3): 227-233.
[31] GIBIS M, VOGT E, WEISS J. Encapsulation of polyphenolic grape seed extract in polymer-coated liposomes[J]. Food & Function, 2012,3(3): 246-254.
[32] VANAJA K, WAHL M A, BUKARICA L, et al. Liposomes as carriers of the lipid soluble antioxidant resveratrol: evaluation of amelioration of oxidative stress by additional antioxidant vitamin[J]. Life Sciences,2013, 93(24): 917-923.
[33] LOCATELLI M, TRAVAGLIA F, GIOVANNELLIi L, et al. Clovamide and phenolics from cocoa beans (Theobroma cacao L.)inhibit lipid peroxidation in liposomal systems[J]. Food Research International, 2013, 50(1): 129-134.
[34] GIBIS M, THELLMANN K, THONGKAEW C, et al. Interaction of polyphenols and multilayered liposomal-encapsulated grape seed extract with native and heat-treated proteins[J]. Food Hydrocolloids,2014, 41: 119-131.
[35] KIM Y A, TARAHOVSKY Y S, YAGOLNIK EA, et al. Lipophilicity of flavonoid complexes with iron (II) and their interaction with liposomes[J]. Biochemical and Biophysical Research Communications,2013, 431(4): 680-685.
[36] ZHAO Lina, WANG Shaoyun, HUANG Yifan. Antioxidant function of tea dregs protein hydrolysates in liposome-meat system and its possible action mechanism[J]. International Journal of Food Science and Technology, 2014, 49(10). doi: 10.1111/ijfs.12546.
[37] RASHIDINEJAD A, BIRCH E J, SUN-WATERHOUSE D, et al. Delivery of green tea catechin and epigallocatechin gallate in liposomes incorporated into low-fat hard cheese[J]. Food Chemistry,2014, 156(1): 176-183.
[38] HUANG Yee, WU Caihong, LIU Zhenguang, et al. Optimization on preparation conditions of Rehmannia glutinosa polysaccharide liposome and its immunological activity[J]. Carbohydrate Polymers,2014, 104: 118-126.
[39] KRILOVD, KOSOVIC M, SEREC K. Spectroscopic studies of alpha tocopherol interaction with a model liposome and its influence on oxidation dynamics[J]. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 2014, 129: 588-593.
[40] THOO Y Y, ABAS F, LAI O M, et al. Antioxidant synergism between ethanolic Centella asiatica extracts and α-tocopherol in model systems[J]. Food Chemistry, 2013, 138(2/3): 1215-1219.
[41] SOWMYAR R, SACHINDRA N M. Evaluation of antioxidant activity of carotenoid extract from shrimp processing byproducts by in vitro assays and in membrane model system[J]. Food Chemistry, 2012,134(1): 308-314.
[42] FAN Yunpeng, WANG Deyun, HU Yuanliang, et al. Liposome and epimedium polysaccharide-propolis flavone can synergistically enhance immune effect of vaccine[J]. International Journal of Biological Macromolecules, 2012, 50(1): 125-130.
[43] NACKE C, SCHRADER J. Liposome based solubilisation of carotenoid substrates for enzymatic conversion in aqueous media[J]. Journal of Molecular Catalysis B: Enzymatic, 2011, 71(3): 133-138.
[44] KONG Baohua, ZHANG Huiyun, XIONG Youling. Antioxidant activity of spice extracts in a liposome system and in cooked pork patties and the possible mode of action[J]. Meat Science, 2010, 85(4):772-778.
[45] LIU Weilin, YE Aiqian, LIU Wei, et al. Stability during in vitro digestion of lactoferrin-loaded liposomes prepared from milk fat globule membrane-derived phospholipids[J]. Journal of Dairy Science,2013, 96(4): 2061-2070.
[46] MAHERANI B, ARAB-TEHRANY E, KHEIROLOMOOM A, et al. Influence of lipid composition on physicochemical properties of nanoliposomes encapsulating natural dipeptide antioxidant L-carnosine[J]. Food Chemistry, 2012, 134(2): 632-640.
[47] SANT'ANNA V, MALHEIROS P S, BRANDELLI A. Liposome encapsulation protectsbacteriocin-like substance P34 against inhibition by Maillard reaction products[J]. Food Research International, 2011,44(1): 326-330.
[48] KHEADR E E, VUILLEMARD J C, EL-DEEB S A. Impact of liposome-encapsulated enzyme cocktails on cheddar cheese ripening[J]. Food Research International, 2003, 36(3): 241-252.
[49] NONGONIERMA A B, ABRLOVA M, KILCAWLEY K N. Encapsulation of a lactic acid bacteria cell-free extract in liposomes and use in cheddar cheese ripening[J]. Foods, 2013, 2(1): 100-119.
[50] 徐冉, 王海峰, 李風亭. 溶菌酶脂質體的制備及其對生物膜的剝離作用[J]. 同濟大學學報: 自然科學版, 2011, 39(1): 90-93.
[51] JAHADI M, KHOSRAVI-DARANI K, EHSANI M R, et al. The encapsulation of flavourzyme in nanoliposome by heating method[J]. Journal of Food Science and Technology, 2015, 52(4): 2063-2072.
[52] ALISHAHI A, MIRVAGHEFI A, TEHRANI M R, et al. Chitosan nanoparticle to carry vitamin C through the gastrointestinal tract and induce the non-specific immunity system of rainbow trout (Oncorhynchus mykiss)[J]. Carbohydrate Polymers, 2011, 86(1): 142-146.
[53] LAOUINI A, CHARCOSSET C, FESSI H, et al. Preparation of liposomes: a novel application of microengineered membranesinvestigation of the process parameters and application to the encapsulation of vitamin E[J]. RSC Advances, 2013, 3(15): 4985-4994.
[54] YANG Shuibing, LIU Wei, LIU Chengmei, et al. Characterization and bioavailability of vitamin C nanoliposomes prepared by film evaporation-dynamic high pressure microfluidization[J]. Journal of Dispersion Science and Technology, 2012, 33(11): 1608-1614.
[55] MARSANASCO M, MARQUEZ A L, WAGNER J R, et al. Liposomes as vehicles for vitamins E and C: An alternative to fortify orange juice and offer vitamin C protection after heat treatment[J]. Food Research International, 2011, 44(9): 3039-3046.
[56] DING Baomiao, ZHANG Xiaoming, HAYAT K, et al. Preparation,characterization and the stability of ferrous glycinate nanoliposomes[J]. Journal of Food Engineering, 2011, 102(2): 202-208.
[57] XIA Shuqin, XU Shiying. Ferrous sulfate liposomes: preparation,stability and application in fluid milk[J]. Food Research International,2005, 38(3): 289-296.
[58] LIU Weilin, YE Aiqian, LIU Chengmei, et al. Structure and integrity of liposomes prepared from milk- or soybean-derived phospholipids during in vitro digestion[J]. Food Research International, 2012, 17(4):499-506.
[59] PENG Hailong, LI Wenjian, NING Fangjian, et al. Amphiphilic chitosan derivatives-based liposomes: synthesis, development, and properties as a carrier for sustained release of salidroside[J]. Journal of Agricultural and Food Chemistry, 2014, 62(3): 626-633.
[60] LIU Weilin, LIU Jianhua, LIU Wei, et al. Improved physical and in vitro digestion stability of a polyelectrolyte delivery system based on layer-by-layer self-assembly alginate-chitosan-coated nanoliposomes[J]. Journal of Agricultural and Food Chemistry, 2013,61(17): 4133-4144.
[61] HERMIDA L G, SABES-XAMANI M, BARNADAS-RODRIGUEZ R. Combined strategies for liposome characterization during in vitro digestion[J]. Journal of Liposome Research, 2009, 19(3): 207-219.
[62] HUR S J, LIM B O, DECKER E A, et al. in vitro human digestion models for food applications[J]. Food Chemistry, 2011, 125(1): 1-12.
[63] BENSHITRIT R C, LEVI C S, TAL S L, et al. Development of oral food-grade delivery systems: current knowledge and future challenges[J]. Food & Function, 2012, 3(1): 10-21.
Progress in Liposome Application in Foods and Its Digestion in Vitro
LIU Weilin, WEI Fuqiang, HAN Jianzhong*
(Food Safety Key Laboratory of Zhejiang Province, School of Food Science and Biotechnology, Zhejiang Gongshang University,Hangzhou310035, China)
Liposomes, in which amphiphilic lipids such as phospholipid bilayer encapsulate the aqueous phase, are cell membrane-like closed delivery system. Because of their unique properties such as protection, delivery, targeting and controlled release, liposomes have shown great application potential in food, medicine, cosmetics and agriculture. This article gives a brief introduction to the characteristics of liposomes with special focus on the recent progress in the application of liposomes in the fields of lipids, food antioxidants, enzymes, proteins, vitamins and minerals. In addition, an overview of in vitro gastrointestinal digestion of liposomes in the fields of food science and nutrition is also proposed.
liposomes; food; in vitro digestion
TS20
A
1002-6630(2015)23-0295-06
10.7506/spkx1002-6630-201523054
2015-01-30
國家自然科學基金青年科學基金項目(31401482);2014年浙江省教育廳科研資助項目(Y201432148);2014年度食品科學與技術國家重點實驗室開放基金課題(SKLF-KF-201406);浙江省食品科學與工程重中之重一級學科開放基金項目(JYTSP20142011);浙江工商大學引進人才科研啟動項目(引13-33)
劉瑋琳(1984—),女,講師,博士,研究方向為食品營養與安全。E-mail:lwl512@zjgsu.edu.cn
韓劍眾(1963—),男,教授,博士,研究方向為食品營養生物學。E-mail:hanjz99@zjgsu.edu.cn

