蛋白酶基因的克隆與表達研究進展
王繼蓮,李明源,陳 蕓
(1.喀什大學 葉爾羌綠洲生態與生物資源研究重點實驗室,新疆 喀什 844006;2.新疆生產建設兵團,塔里木盆地生物資源保護利用重點實驗室,新疆 阿拉爾 843300)
蛋白酶基因的克隆與表達研究進展
王繼蓮1,2,李明源1,2,陳蕓1
(1.喀什大學 葉爾羌綠洲生態與生物資源研究重點實驗室,新疆 喀什844006;2.新疆生產建設兵團,塔里木盆地生物資源保護利用重點實驗室,新疆 阿拉爾843300)
蛋白酶在各領域的應用愈加廣泛,但其大規模工業生產受到諸多因素制約。利用基因工程技術對蛋白酶基因進行改良和克隆表達,開發高產量、高純度、高活力的蛋白酶資源成為研究的熱點。本文對蛋白酶的分類、結構與功能、菌種選育等進行了概述,同時分析了蛋白酶基因在原核和真核生物中的克隆與表達研究進展,并對未來蛋白酶基因工程的發展趨勢進行了展望。
蛋白酶;基因工程技術;克隆表達
蛋白酶是催化水解蛋白質中肽鍵的一類酶,是酶學研究開展的較早,也是最為成熟的一種[1-2]。目前,蛋白酶的應用已遍及食品、醫藥化工、洗滌、飼料等領域,生產總值達到酶制劑市場的65%[3]。與動、植物源蛋白酶相比,微生物蛋白酶來源廣、菌體營養要求低、易于培養,更易實現規模化生產。早期對微生物源蛋白酶的研究較多集中于天然高產菌種的選育、發酵條件優化和下游處理技術等,總體研究水平不高,沒有真正考慮到大規模生產技術的各方面因素。直至20世紀70年代重組DNA技術建立后,對蛋白酶分子生物學領域的研究才隨之展開,實現了蛋白酶基因的序列分析、克隆與表達,使規模化生產成為可能。本文主要對蛋白酶的分類、結構與產酶菌株的選育進行概述,同時對蛋白酶基因工程的研究進展進行了綜述,對其發展前景進行了展望。
1 蛋白酶簡介
1.1蛋白酶分類體系與應用
蛋白酶是由多種水解酶組成的復雜酶系,根據其活性部位起催化作用的基團屬性,可分為4 類:1)絲氨酸蛋白酶,以絲氨酸為活性中心,其活性部位都含Ser、His、Asp,如胰蛋白酶,廣泛應用于心血管疾病醫治、真菌基礎性研究等領域[4-5];2)巰基蛋白酶,其活性中心含巰基(—SH),如菠蘿蛋白酶、木瓜蛋白酶,多用于生物化工(干酪、明膠及生物蛋白的生產)、食品及醫藥工業[6];3)天冬氨酸蛋白酶(又稱酸性蛋白酶),酶學史上最早被記載的蛋白酶,其活性中心由兩個天冬氨酸殘基所組成,如胃蛋白酶,主要用于食品添加劑、心血管疾病等方面;4)金屬蛋白酶類,其活性區域多含Zn2+、Ca2+、Mg2+等二價金屬離子,如枯草桿菌中性蛋白酶,其酶活性易受苯甲基磺酰氟(phenylmethanesulfonyl fluoride,PMSF)及金屬螯合劑乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)抑制,廣泛用于食品、日用化工及抗腫瘤等藥物和疾病的機理研究方面[7]。
1.2蛋白酶的結構
雖然蛋白酶在長期的進化過程中,其分子結構、大小、功能等差別很大,但各家族蛋白酶仍然保持了一個高度保守的結構域,擁有較高的序列相似性。絲氨酸蛋白酶在結構上為全β蛋白,其核心結構由C端和N端結構域組成,其中C結構域執行催化功能,而N結構域主要負責與C結構域相配合,共同維持催化中心三聯體的構象穩定性和催化活性[8](圖1)。巰基蛋白酶家族以木瓜蛋白酶研究的最為詳盡,其酶前體中已形成大小相當的2 個結構域,這2 個結構域構成的裂隙底部是催化位點[9](圖2)。天冬氨酸蛋白酶多擁有以C2為對稱軸的兩個雙葉型三級結構[10](圖3)。金屬蛋白酶成員均含有一個穩定的基本結構域:N端疏水信號肽、前肽區、催化活性區。尤其在催化活性區含1 個或2 個金屬離子,以Zn2+最多,這是金屬蛋白酶與上述三類蛋白酶最大的不同(圖4),多數動物的基質金屬蛋白酶中還含有C端的血紅素結合蛋白樣結構域[11]。前肽區與催化活性區中的鋅原子相互協調,共同維持酶分子的功能穩定性,而血紅素結合蛋白樣結構域主要起調節酶活性和底物專一性的作用[12]。
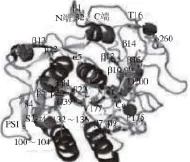
圖1 蛋白酶K三維結構Fig.1 Three-dimensional structure of protease K
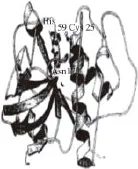
圖2 木瓜凝乳蛋白酶三維結構Fig.2 Three-dimensional structure of chymopapain

圖3 胃蛋白酶原三維結構Fig.3 Three-dimensional structure of pepsinogen

圖4 金屬蛋白酶三維結構Fig.4 Three-dimensional structure of metalloprotease
1.3高產蛋白酶優良菌株的選育
目前,蛋白酶的生產由于酶活性低、生產成本較高等因素限制,尚不能實現規模化生產。因此,直接從天然環境中選育有高產酶能力的野生菌種,或借助誘變育種、原生質體融合等方法對出發菌株進行改造、篩選,進一步提高酶活,成為研究的一大熱點。
研究者們對天然高產酶菌株的篩選已從單純的常溫菌擴展到篩選某些特殊性質的菌株,如高、低溫蛋白酶、堿性蛋白酶等。Bach等[13]從巴西土壤中篩選到一株高產蛋白酶的耐熱、耐堿細菌菌株,經鑒定為嗜水氣單胞菌(Aeromonas hydrophila)。Kim等[14]自北極陸地分離到一株產低溫蛋白酶的嗜冷菌,經鑒定為節桿菌屬(Arthrobacter sp.)中的一個種。
誘變育種主要通過輻射誘變或一些化學試劑誘發菌體的遺傳物質突變,獲得性狀優良的突變株。例如,蔡婉玲等[15]在富含蛋白質的場所采樣,對篩選到的產酶菌株進行紫外誘變后,其酶活力由1 594 U/mL增加到1 845 U/mL,比原始菌株升高16%。
原生質體融合技術是指通過人為的方法,將雙親株的細胞去壁進行原生質體融合,使其基因組間交換重組獲得穩定重組子的過程。例如,武金霞等[16]將產蛋白酶的米曲霉菌株HL和L5進行細胞融合,得到的融合株蛋白酶活力分別比兩親株提高25.6%和19.9%。
2 蛋白酶基因的篩選
隨著分子生物學手段的進步,利用基因操作技術構建蛋白質高效分解基因工程菌,從根本上提高酶的產量和質量成為功能酶選育的重點工程。早期的基因工程方法多是利用“鳥槍法”,即以供體菌株的總DNA為研究對象,進行隨機酶切,構建一個基因文庫,連接到表達載體上,導入適合的受體細胞篩選陽性克隆,得到蛋白酶基因。隨著基因合成技術的成熟,目前常用的基因篩選策略主要包括以下幾種:人工合成法,即根據已克隆到的蛋白酶序列人工合成目的基因;特異性引物擴增法,即根據已克隆到的蛋白酶序列設計簡并引物,在相似物種上擴增目的基因。李丹等[17]通過簡并引物和染色體步移技術克隆芽孢桿菌(Bacillus sp.)L010的中溫堿性蛋白酶基因,并導入大腸桿菌(Escherichia coli)BL21(DE3)中進行了重組表達,發酵液表現出較高的酶活力。
此外,隨著宏基因組(metagenome)概念的提出,蛋白酶基因也可以通過特異性引物從某一區域的總基因組DNA中克隆獲得,有效彌補了傳統微生物純培養技術的弊端,為開發未培養微生物的蛋白酶基因資源提供新思路[18]。例如對殺線蟲蛋白酶基因的篩選,便可通過直接從環境中取樣構建宏基因組Fosmid文庫,設計特異性引物克隆蛋白酶基因[19]。
3 蛋白酶基因的克隆表達
自1985年Jacobs等[20]首次成功克隆出芽孢桿菌Bacillus licheniformis的堿性蛋白酶基因以來,利用基因工程技術對蛋白酶基因進行克隆與表達,構建高產蛋白酶工程菌成為研究熱點,為菌種選育提供了新途徑。目前已有數千種蛋白酶基因被克隆表達,相應的DNA及氨基酸序列被共享在美國DNA數據庫GenBank、日本DNA序列數據庫(DNA Data Bank of Japan,DDBJ)等數據平臺上。
3.1蛋白酶基因在原核生物中的克隆與表達
3.1.1蛋白酶基因在大腸桿菌中的克隆與表達
作為第一個用于重組蛋白生產的宿主菌,大腸桿菌以其分子遺傳學背景清楚、繁殖速率快、操作簡單等優點被發展成為基因工程研究中應用最廣泛和最深入的模式菌株,幾乎所有已克隆的蛋白酶基因都在大腸桿菌中得到表達[21-22]。尤其進入后基因組時代后,有關蛋白組學、基因功能、蛋白質網絡等新課題的開展,大腸桿菌更成為基因表達的最首要工具。目前通用的質粒表達載體主要有pET系列、pUC系列、pGEM系列等,常用受體菌有BL21、JM109、DH5α、JM103等[23]。如李麗華等[24]從海洋球石藻(Emiliania huxley)病毒中通過聚合酶鏈式反應(polymerase chain reaction,PCR)擴增絲氨酸蛋白酶SP基因,將其克隆到表達載體pET32a上,導入大腸桿菌BL21中進行低溫誘導表達,Western blotting檢測到重組表達蛋白分子質量約60 kD,能在脫脂牛奶平板上形成水解圈,證實其具有生物活性。李潔瓊等[25]從單胞菌Collimonas sp. ZL261克隆得到蛋白酶基因capro,并構建于表達載體pUC118上,轉化至大腸桿菌DH5α菌株,檢測到目的蛋白具有蛋白酶活性,最適反應溫度30 ℃,最佳作用pH值為7。
盡管大腸桿菌是基因表達的首選,但也存在一些缺憾。在大腸桿菌中表達的異源蛋白易形成包涵體,不利于純化,且不能進行翻譯后蛋白質的加工修飾[26-27],最重要的是經過變性復性過程重組蛋白往往失去活性,對此研究者采取了諸多措施。對于胞質內蛋白,可將分子伴侶和目的基因共表達,介導重組蛋白的折疊裝配;或用中等強度的啟動子替代強啟動子,減緩易聚集的折疊中間產物的合成速率,進而減少包涵體的形成。還可構建分泌系統使異源蛋白分泌性表達,如大腸桿菌素釋放蛋白系統可增加大腸桿菌的通透性,促進周質蛋白的分泌;構建缺乏細胞壁的L型細菌蛋白表達系統,直接將外源蛋白分泌到胞外。
3.1.2蛋白酶基因在其他受體菌中的克隆表達
為優化重組蛋白的表達質量,人們不斷嘗試構建新的表達系統,目前已有一些蛋白酶基因在枯草芽孢桿菌、短小芽孢桿菌和變鉛青鏈霉菌中得到有效表達。楊春暉等[28]通過交錯式熱不對稱PCR(thermal asymmetric interlaced PCR,TAIL-PCR)技術克隆了一株短小芽孢桿菌的蛋白酶基因啟動子序列,分析其與該基因表達有關的序列全長390 bp,構建的重組大腸桿菌-芽孢桿菌表達質粒pSUBpWApQ3在枯草芽孢桿菌和短小芽孢桿菌中均得到表達,最高酶活力分別達到466.5 U/mL和3 060 U/mL。馬騰博等[29]從灰色鏈霉菌中克隆胰蛋白酶編碼基因sprT,以pIJ86為載體,成功實現了其在重組變鉛青鏈霉菌工程菌TK24/pIJ86-sprT的高活性表達,該重組酶同牛胰蛋白酶(bovine trypsin,BT)相比,耐酸性更強,對酰胺鍵的特異性更高。
枯草芽孢桿菌是一種食品級安全菌株,安全系數更高,可將重組蛋白以可溶形式分泌到胞外,發酵工藝技術也較為成熟。不足之處在于自身會分泌一些具有較強水解活性的蛋白酶,質粒本身的不穩定造成克隆效率低[30]。應對策略有構建誘導型表達分泌載體,目前研究比較清楚的有葡萄糖和蔗糖誘導表達系統,不僅可以誘導外源基因表達,而且可以促進外源蛋白的分泌。還可使用枯草芽孢桿菌整合載體,相對提高質粒的穩定性等。鏈霉菌作為受體菌,致病性較小,但操作復雜,轉化頻率不高,與之對應的用于基因表達的啟動子和載體也較少。因此,鏈霉菌作為一種有效的表達工具仍需不斷豐富和完善。
3.2蛋白酶基因在真核生物中的克隆與表達
真核表達系統是近年來用于表達重組蛋白的一種新興表達體系。與原核表達系統相比,真核表達系統可以實現對外源蛋白的正確折疊、組裝等,是生產具有生物活性蛋白的又一理想選擇。目前常用的真核生物表達系統主要有酵母、昆蟲及哺乳類動物細胞等。
3.2.1蛋白酶基因在酵母中的克隆與表達
作為一種單細胞真菌,酵母營養要求低,在釀酒和食品行業的應用歷史悠久,是被應用最早的微生物,安全性相比原核生物表達系統更可靠。此外,酵母表達系統的表達重組蛋白的水平也較高,又能對其進行正確地折疊、組裝,已發展成為應用最普遍的真核表達系統[31]。如柯野等[32]采用PCR技術擴增米曲霉中的堿性蛋白酶基因,將其克隆到表達載體pPIC9K,電擊轉化到畢赤酵母KM71,在10 L發酵罐中經甲醇誘導后酶活力為4 100 U/mL,其最適溫度和pH值分別為50 ℃和8.5~9.5。Porres等[33]將枯草桿菌Bacillus licheniformis PWD-1的kerA基因克隆到表達載體pPICZαA和pGAPZαA上,轉化至畢赤酵母X-33實現外源表達,最高酶活力為285 U/mL。
通過對外源基因、分泌信號及培養條件的控制等,已有很多異源蛋白成功在酵母表達系統中表達。缺陷在于缺乏高效的啟動子,對外源蛋白的表達過度糖基化,增殖過程中代謝產物的富集會限制菌群自身的高密度培養。此外,細胞所分泌的蛋白酶對自身蛋白的降解,也在很大程度上限制了外源基因的表達[34]。應對策略包括選擇有高分泌效率的信號肽,如酸性磷酸脂酶、α因子信號肽的宿主菌,促進外源蛋白的分泌;使用重復序列作為整合質粒的重組位點,增加目的基因的拷貝數,進而提高外源基因的表達水平;改變培養基的發酵條件(pH值、溫度等)或使用蛋白酶抑制劑降低蛋白酶活性,增加重組產物的積累。
3.2.2蛋白酶基因在霉菌及動物細胞中的克隆與表達
霉菌以其較強的外泌蛋白能力及其翻譯后加工,較酵母更類似于真核細胞生物等特點成為表達外源蛋白的又一理想選擇[35]。如潘力等[36]以米曲霉淀粉酶的強啟動子(amyB)和糖苷酶的強終止子(agdA)為基本元件,將泡盛曲霉Aspergillus awamori的酸性蛋白酶基因pepA克隆至農桿菌雙元載體phGW中,導入泡盛曲霉宿主菌中實現轉化與表達,傳代培養驗證了轉化子的抗藥穩定性,培養液酶活力較野生型提高15%。于寒穎等[37]通過構建表達載體pGT21M-HIS,使捕食線蟲真菌Dactylellina cionopapa中與侵染機制相關的蛋白酶基因PrD I成功在黑曲霉201中轉錄,表達的外源蛋白分子質量約45 kD,在酸性條件下有活性。
此外,動物細胞具有易被轉染、分泌物易被純化,且遺傳性能穩定等特點,成為表達外源蛋白的另一重要途徑,其表達的蛋白產物已有部分應用于生物制品行業。例如,曾錚等[38]采用PCR擴增獲得銅綠假單胞菌SP-6的彈性蛋白酶基因,構建轉移載體pBacPAK8-His-Ela,和親本病毒BacPAK6共轉染昆蟲細胞株Sf21,細胞在感毒120 h后產酶量達到最高峰,為20.9 U/mL。楊曉嬌等[39]利用PCR技術擴增微小隱孢子蟲類的鈣調蛋白蛋白基因CML,插入到載體pMD18-T中構建重組質粒,連接到真核表達載體pVAX1上轉染Hela細胞,Western blotting和間接免疫熒光法檢測表明表達質粒在Hela細胞中成功表達,表達產物分子質量約為25 ku,具有反應原性。
4 結 語
雖然近年來蛋白酶基因的克隆與表達研究已取得重要進展,但由于多數異源表達的重組蛋白分泌較弱、酶活性較低及安全性有待進一步驗證等問題使其工業化進程緩慢。國內已經投入工業生產的菌株(地衣芽孢桿菌2709和C1213及短小芽孢桿菌289、209等)酶活力在18 000 U/mL左右,與國外的25 000~30 000 U/mL相比仍存在不少差距。因此,繼續對原始產酶菌株進行定向或非定向性改造,提高菌種的產酶活力,改變產酶性質,使其符合工業生產的要求仍是未來酶工程的發展趨勢。在今后的研究工作中,產蛋白酶優良菌株的選育仍顯得十分必要;另一方面,除了在常見的宿主中表達蛋白酶外,需努力嘗試構建新的表達系統或多個蛋白酶基因共表達系統,為蛋白酶構建更多的表達載體,進而實現其不同組分的有效表達并進一步提高表達量、酶活性和酶穩定性。相信隨著現代生物基因工程的不斷發展,將會有更多的蛋白酶基因被克隆表達,蛋白酶在工農業生產上的應用前景也會越來越廣闊。
[1]李飛雄, 李江紅, 梁勤, 等. 蜜蜂球囊菌幾種胞外蛋白酶的特性[J].中國農業科學, 2011, 44(6): 1247-1254.
[2]朱薇玲, 石豪, 李金華, 等. 芽孢桿菌B15胞外蛋白酶和淀粉酶的酶學性質研究[J]. 中國釀造, 2012, 31(9): 118-121.
[3]ALAGARSAMY S, LARROCHE C, PANDEY A. Microbiology and industrial biotechnology of food-grade proteases: a perspective[J]. Food Technology and Biotechnology, 2006, 44(2): 211-220.
[4]吳志俊, 金瑋, 張鳳如, 等. 利鈉肽家族基因與心血管疾病研究新進展[J]. 遺傳, 2012, 34(2): 127-133.
[5]金凱, 牛東紅, 王劦, 等. 縊蟶絲氨酸蛋白酶基因的序列特征及其表達分析[J]. 上海海洋大學學報, 2013, 22(4): 481-487.
[6]BRAKEBUSCH M, WINTERGERST U, PETROPOULOU T, et al. Bromelain is an accelerator of phagocytosis, respiratory burst and killing of Candida albicans by human granulocytes and monocytes[J]. European Journal of Medical Research, 2001, 6(5): 193-200.
[7]FRANTZ C, STEWART K M, WEAVER V M. The extracellular matrix at a glance[J]. Journal of Cell Science, 2010, 123(24):4195-4200.
[8]吳彤, 王瑞明, 黃磊, 等. 蛋白酶K的研究進展[J]. 食品工業科技,2013, 34(14): 380-384.
[9]WIEDERANDERS B. Structure-function relationship in class CA1 cysteine peptidase propeptides[J]. Acta Biochemical Polonica, 2003,50(3): 691-713.
[10]DAVIES D R. The structure and function of the aspartic proteinases[J]. Annual Review of Biophysics and Biophysical Chemistry, 1990, 19(1):189-215.
[11] NAGASE H, VISSE R, MURPHY G. Structure and function of matrix metalloproteinases and TIMPs[J]. Cardiovascular Research, 2006,69(3): 562-573.
[12] PICCARD H, van den STEEN P E, OPDENAKKER G. Hemopexin domains as multifunctional liganding modules in matrix metalloproteinases and other proteins[J]. Journal of Leukocyte Biology, 2007, 81(4): 870-892.
[13] BACH E, DAROIT D J, CORRêA A P F, et al. Production and properties of keratinolytic proteases from three novel Gramnegative feather-degrading bacteria isolated from Brazilian soils[J]. Biodegradation, 2011, 22(6): 1191-1201.
[14] KIM E H, CHO K H, LEE Y M, et al. Diversity of cold-active protease-producing bacteria from arctic terrestrial and marine environments revealed by enrichment culture[J]. The Journal of Microbiology, 2010, 48(4): 426-432.
[15] 蔡婉玲, 田寶玉, 郭菁, 等. 蛋白酶產生菌的篩選和紫外誘變育種[J].生物技術, 2011, 21(1): 73-76.
[16] 武金霞, 趙睿, 張賀迎. 米曲霉種內原生質體融合選育優良菌株[J].中國釀造, 2012, 31(2): 132-136.
[17] 李丹, 黃非, 夏夢蕓, 等. 一新中溫堿性蛋白酶基因的克隆及原核表達[J]. 微生物學報, 2013, 53(11): 1240-1250.
[18] MATH R K, ASRAFUL ISLAM S M, CHO K M, et al. Isolation of a novel gene encoding a 3,5,6-trich-loro-2-pyridinol degrading enzyme from a cow rumen metagenomic library[J]. Biodegradation, 2010,21(4): 565-573.
[19] 趙志祥, 蘆小飛, 陳國華, 等. 溫室黃瓜根結線蟲發生地土壤微生物宏基因組文庫的構建及其一個殺線蟲蛋白酶基因的篩選[J]. 微生物學報, 2010, 50(8): 1072-1079.
[20] JACOBS M, ELIASSON M, UHLEN M. Cloning-sequence and expression of subtilisin from Bacillus licheniformis[J]. Nucleic Acids Research, 1985, 13(24): 8913-8923.
[21] SUZUKI S M, STEVENS R C. Engineering human PON1 in an E. coli expression system[J]. Advances in Experimental Medicine and Biology, 2010, 660: 37-45.
[22] DONG Xiangbai, TANG Bo, LI Jie, et al. Expression and purifi cation of intact and functional soybean (Glycine max) seed ferritin complex in Escherichia coli[J]. Journal of Microbiology and Biotechnology,2008, 18(2): 299-307.
[23] 蔣鈺瑤, 何嘉榮, 王未未, 等. 新型大腸桿菌高效表達載體pHsh的構建與應用[J]. 微生物學通報, 2012, 39(4): 394-400.
[24] 李麗華, 邱健健, 蔡藝欽, 等. 一種新的海洋微藻病毒絲氨酸蛋白酶基因的克隆表達及其活性分析[J]. 海洋學報, 2014, 36(8): 101-110.
[25]李潔瓊, 張殿朋, 盧彩鴿, 等. Collimonas sp.ZL261蛋白酶基因的克隆、表達及其酶學特性[J]. 核農學報, 2014, 28(8): 1370-1378.
[26] 王中山, 向泉桔, 王海燕, 等. 大腸桿菌細胞周質底物結合蛋白gsiB基因的克隆及其表達條件的優化[J]. 遺傳, 2010, 32(5): 505-511.
[27] LE Yilin, PENG Jingjing, WU Huawei, et al. An approach to the production of soluble protein from a fungal gene encoding an aggregation-prone xylanase in Escherichia coli[J]. PLoS ONE, 2011,6(4): e18489. doi: 10.1371/journal.pone.0018489.
[28] 楊春暉, 王海燕. 短小芽孢桿菌堿性蛋白酶基因啟動子的克隆, 鑒定及其應用[J]. 遺傳, 2007, 29(7): 874-880.
[29] 馬騰博, 令楨民, 康振, 等. 灰色鏈霉菌胰蛋白酶在變鉛青鏈霉菌中的異源表達及酶學性質分析[J]. 生物工程學報, 2013, 29(4): 466-479.
[30] CHEN Dongli, TONG Xing, CHEN Shangwei, et al. Heterologous expression, biochemical characterization, and overproduction of alkaline α-amylase from Bacillus alcalophilus in Bacillus subtilis[J]. Microbial Cell Factories, 2011, 10: 77-86.
[31] LI Anna, LI Duochuan. Cloning, expression and characterization of the serine protease gene from Chaetomium thermophilum[J]. Journal of Applied Microbiology, 2009, 106(2): 369-380.
[32] 柯野, 陳丹, 李家洲, 等. 米曲霉堿性蛋白酶基因的克隆表達及水解特性[J]. 華南理工大學學報: 自然科學版, 2012, 40(8): 88-94.
[33] PORRES J M, BENITO M J, LEI X G. Functional expression of keratinase (kerA) gene from Bacillus licheniformis in Pichia pastoris[J]. Biotechnology Letters, 2002, 24(8): 631-636.
[34] 馬銀鵬, 王玉文, 黨阿麗, 等. 畢赤酵母表達系統研究進展[J]. 黑龍江科學, 2013, 4(9): 27-31.
[35] HELENA NEVALAINEN K M, TE'O V S J, BERGQUIST P L. Heterologous protein expression in filamentous fungi[J]. Trends in Biotechnology, 2005, 23(9): 468-474.
[36] 潘力, 李俊星, 苗小. 根癌農桿菌介導酸性蛋白酶在泡盛曲霉中表達的研究[J]. 食品工業科技, 2011, 32(5): 178-182.
[37] 于寒穎, 薛偉, 段俊欣. 黑曲霉外源表達系統對Dactylellina cionopapa基因PrDI的表達[J]. 生物技術, 2012, 22(3): 38-43.
[38] 曾錚, 吳大洋, 李春峰. 銅綠假單胞菌彈性蛋白酶基因的克隆及在昆蟲細胞中的表達[J]. 蠶業科學, 2006, 32(3): 345-349.
[39] 楊曉嬌, 周鵬, 米榮升, 等. 微小隱孢子蟲類鈣調蛋白基因真核表達質粒的構建及在Hela細胞中的表達[J]. 中國獸醫科學, 2014, 44(15):485-491.
Progress in Cloning and Expression of Protease Genes
WANG Jilian1,2, LI Mingyuan1,2, CHEN Yun1
(1. Key Laboratory of Ecology and Biological Resources in Yarkand Oasis of Education of Xinjiang Uygur Autonomous Region,Kashgar University, Kashgar844006, China; 2. Xinjiang Production & Construction Crops, Key Laboratory of Protection and Utilization of Biological Resources in Tarim Basin, Alaer843300,China)
Although proteases are widely applied in various fi elds, large-scale industrial application of proteases has been restricted by many factors. Genetic engineering technology has been used for the cloning and expression of protease genes to obtain the protease resources with high quality, high purity and high activity. The classifi cation, structures and functions of proteases, and strain screening for protease production are reviewed in this article. Meanwhile, the cloning, and prokaryotic and eukaryotic expression of protease genes are discussed. Moreover, the future development in protease gene engineering technology is also prospected.
protease; genetic engineering technology; cloning and expression
Q786
A
1002-6630(2015)23-0377-05
10.7506/spkx1002-6630-201523067
2015-01-08
新疆生產建設兵團塔里木盆地資源保護利用重點實驗室開放課題(BRYB1302);喀什大學校內青年專項課題((14)2526)
王繼蓮(1986—),女,講師,碩士,主要從事基礎酶工程研究。E-mail:wjilian0710@sina.com

