乙酸對重組大腸桿菌BL21產酶的影響及作用機理研究
戴琨 王騰飛 郝昭程 湯丹丹 劉紅娟 王瑞明
(齊魯工業大學生物工程學院,濟南 250353)
乙酸對重組大腸桿菌BL21產酶的影響及作用機理研究
戴琨 王騰飛 郝昭程 湯丹丹 劉紅娟 王瑞明
(齊魯工業大學生物工程學院,濟南250353)
旨在研究發酵過程中產生的乙酸對重組大腸桿菌BL21(DE3)/pET15b-TreS的生長以及重組海藻糖合酶基因表達的影響,并對其作用機理進行探討。通過外源添加乙酸(鈉)的方法,研究了乙酸鈉對重組菌BL21(DE3)/pET15b-TreS生長曲線的影響;利用環境掃描電子顯微鏡,觀察了重組菌形態的變化情況;通過測定菌液的電導率值變化、菌液上清中OD260的變化,研究了乙酸(鈉)對菌體細胞膜滲透性、完整性的影響;通過測定菌液上清中β-半乳糖苷酶的活性檢測了乙酸鈉對菌體細胞內膜的影響;利用熒光分析法檢測了乙酸對菌體膜蛋白構象的影響;采用SDS-PAGE電泳研究了乙酸鈉對菌體重組海藻糖合酶表達量的影響。結果表明,乙酸(鈉)會對重組菌的生長產生一定的抑制作用,可以導致菌體細胞的表面出現凹陷、皺縮;并會影響細胞膜的滲透性、完整性,使得一些細胞內容物發生泄漏;影響細胞膜上的膜蛋白構象,對膜的結構造成一定程度的破壞;對重組海藻糖合酶的表達產生影響。乙酸(鈉)對重組菌菌體的生長及重組海藻糖合酶基因的表達有影響,并且菌體細胞膜是其作用的一個靶點。
乙酸;重組大腸桿菌;抑菌機理;細胞膜;海藻糖合酶
目前,隨著重組DNA技術與發酵培養技術的迅速發展,利用基因工程菌獲得所需產品的技術日趨成熟。由于大腸桿菌具有遺傳特性較清楚、易培養、發酵周期短并能實現目的基因的高效表達等特性,因而被廣泛應用于基因工程菌的構建[1]。而重組菌的高細胞密度發酵是獲得高外源蛋白產量的一種重要手段,能夠提高單位時間單位體積的外源蛋白產率,重組大腸桿菌的高密度培養一般指培養液中菌體干細胞重量(dry cell weight,DCW)達50 g/L以上[2]。利用重組大腸桿菌進行高密度發酵可以有效地提高外源基因表達產物的產量,但是,大腸桿菌在進行高密度發酵時會產生代謝副產物乙酸,Han[3]認為細菌在低比生長速率條件下通過氧化代謝作用產生的能量足以滿足合成和異化作用的需求,不會產生乙酸,而在高比生長速率時,大腸桿菌僅靠氧化代謝不能提供足夠的能量,必須通過乙酸生成途徑儲備ATP和NADH2。乙酸的生成需要兩個關鍵性的酶,磷酸轉乙酰酶(Pta)和乙酰激酶(Ack),它們催化葡萄糖代謝中從乙酰輔酶A生成乙酸的兩步酶促反應[4]。然而,乙酸的產生和積累不僅會影響菌體生長,還會對菌體生長和重組基因的表達產生抑制[5]。
EL-Mansi[6]和Luli[7]假設的乙酸抑制機理為:乙酸在中性pH環境中以離子化(CH3COO-)和質子化(CH3COOH)兩種形式存在,質子化的乙酸具有弱的親脂性可以穿過細胞質膜進入胞內,在胞內(pH7.5)解離成CH3COO-和H+,這樣就降低了膜內的pH值,使膜內外的pH差(ΔpH)減小,減弱了質子推動力,產生的能量就被大大減少了,擾亂了細胞的正常代謝和生理活性。而陰離子增加了細胞內部滲透壓,并干擾甲硫氨酸的合成[8]。有試驗證明,培養時pH越低,乙酸未解離形式含量越高,乙酸抑制作用就越強[9-10]。
此外,研究表明,乙酸會影響數種蛋白和基因,特別是那些涉及大腸桿菌轉錄及翻譯機制、一般應激反應和調節的蛋白和基因[11]。而且,乙酸對產重組蛋白的細胞抑制作用比對野生型的細胞抑制作用更強[12],同時細胞誘導表達蛋白后產生乙酸的臨界比生長速率更低[13]。
在利用重組大腸桿菌BL21(DE3)/pET15b-TreS進行高密度發酵生產海藻糖合酶的過程中,發酵液中會有大量代謝副產物乙酸的積累,而且會影響海藻糖合酶的酶活。根據這些檢測結果,本研究采取外源添加的方法,研究乙酸對重組大腸桿菌的生長及外源海藻糖合酶基因表達的影響,并分析其對細胞的抑制機理,包括對細胞膜、目的蛋白表達量的抑制作用,旨在為了解發酵過程中乙酸對菌體作用的機理,以控制培養條件,降低對菌體生長及產物產量的影響。
1 材料與方法
1.1 材料
1.1.1 試驗菌株 大腸桿菌BL21(DE3)/pET15b-Tres(本實驗室構建菌種)。
1.1.2 培養基 LB液體培養基(%):酵母浸粉0.5,蛋白胨1.0,NaCl 1.0。
M9乳糖誘導培養基(%):Na2HPO4·12H2O 1.72,KH2PO40.3,NaCl 0.05,NH4Cl 0.1,MgSO40.05,CaCl20.001,乳糖0.5。
β-半乳糖苷酶反應緩沖液(%):NaCl 0.8,KCl 0.02,Na2HPO4·12H2O 0.29,KH2PO40.024,MgSO4·7H2O 0.025,β-巰基乙醇 0.39。
氨芐青霉素(Amp):50 mL無菌水中加入0.5 g氨芐西林鈉(0.5 g/瓶)。
其他試劑均為分析純。
1.1.3 儀器 振蕩培養箱(哈爾濱市東聯電子技術開發有限公司);立式自動電熱壓力蒸汽滅菌鍋(上海申安醫療器械廠);標準型凈化工作臺(蘇州安泰技術有限公司);電子天平(上海天平儀器廠);隔水式恒溫培養箱(上海亞榮生化儀器廠);往復式水浴恒溫振蕩器(江蘇正基儀器有限公司);DDS-11A電導率儀(上海第二分析儀器廠);紫外可見分光光度計(北京普析通用儀器有限公司);ChampGel5 500生物電泳凝膠成像分析系統(SAGECREATION);F-4500熒光分光光度計(日立);5804R高速冷凍離心機(德國Eppendorf公司)。
1.2 方法
1.2.1 菌種的活化培養 配制LB液體培養基經121℃滅菌20 min后,冷卻,于培養基中加入Amp(終濃度為100 mg/L)后接菌,37℃、180 r/min的條件下培養24 h。取菌液在加有Amp的固體培養基上進行劃線培養,挑取生長狀況較好的單個菌落進行液體培養基擴增。
1.2.2 對生長曲線的影響 取活化后的大腸桿菌BL21(DE3)/pET15b-TreS按1%的接種量分別接種于9個100 mL 加有Amp的LB培養基中,加入滅菌的乙酸鈉溶液,使其終濃度分別為0、0.5、1、2、4、5、10、20和30 g/L,于37℃、180 r/min的條件下培養,并在不同的時間點取樣測OD值,繪制生長曲線。
1.2.3 對細胞顯微特征的影響 將培養至對數生長期的重組菌于5 000 r/min,4℃條件下離心10 min,棄上清,收集菌體,用無菌生理鹽水洗滌3次,并稀釋至菌體濃度約為107CFU/mL。
取制備的重組菌菌懸液20 mL,分別加入乙酸(使其終濃度分別為6.25 g/L和25 g/L)、乙酸鈉溶液(使其終濃度分別為6.72 g/L和26.88 g/L),同時設置無菌生理鹽水對照組,37℃孵育2 h。將對照組和試驗組的重組菌菌液離心收集菌體,洗滌后用2.5%的戊二醛于4℃條件下固定2 h后涂片,使樣品自然風干。制備的樣品用環境掃描電子顯微鏡觀察重組菌形態的變化情況。
1.2.4 對菌體細胞膜通透性的影響 將培養至對數期的重組菌菌體,用無菌水稀釋至菌液濃度為107CFU/mL,取稀釋后的菌液27 mL,加入3 mL抑菌成分,分別為乙酸(終濃度分別為:3.125、6.25、12.5和25 g/L)、乙酸鈉(終濃度分別為:3.36、6.72、13.44和26.88 g/L),同時設置無菌水對照組,置于37℃恒溫水浴振蕩器中,然后分別在0、10、20、30、40、50和180 min時測定其電導率值。
1.2.5 對菌體細胞膜完整性的影響 將培養至對數期的重組菌菌體,用生理鹽水稀釋至菌體濃度為107CFU/mL左右,取稀釋后的菌液45 mL,加入5 mL不同濃度的抑菌成分,分別為乙酸(終濃度分別為:3.125、6.25、12.5和25 g/L)、乙酸鈉(終濃度分別為:3.36、6.72、13.44 和26.88 g/L),并設置空白對照組,然后置于37℃恒溫水浴振蕩器中,分別在不同時間點取樣,并在6 000 r/min的條件下,離心5 min,取上清用紫外分光光度計測其在260 nm處的吸光值。
1.2.6 對細胞內膜的滲透性影響 培養重組菌至對數生長期,取菌液10 mL進行離心,菌體用無菌生理鹽水洗滌兩次,轉移至100 mL的M9乳糖誘導培養基中,于37℃恒溫振蕩培養10 h,然后離心,收集菌體,用β-半乳糖苷酶反應緩沖液重懸至OD600為0.2左右。
取9 mL反應緩沖液重懸的菌液,分別加入1 mL不同濃度的乙酸鈉(終濃度分別為:3.36、6.72、13.44和26.88 g/L)混勻,37℃孵育2 h后離心菌體,取上清4.5 mL,再加入500 μL 1 mg/mL的鄰硝基苯-β-D-吡喃半乳糖苷(ONPG),置于37℃恒溫水浴中,孵育2 h后,于420 nm的波長下測其吸光值[14]。
1.2.7 熒光分析法測乙酸對菌體膜蛋白構象的影響 將重組菌培養至對數生長期,離心、洗滌菌體,用生理鹽水重懸,濃度約為107CFU/mL,分別在5 mL滅菌的EP管中加入1 mL的菌懸液,然后加入1 mL不同濃度的冰乙酸(乙酸的終濃度依次為0、3.125、6.25、12.5和25 g/L),于37℃恒溫水浴鍋中保溫1h后,置于日立F-4500熒光分光光度計上進行檢測。
1.2.8 對蛋白質合成的影響 將重組菌培養至對數生長期,按1%接種量分別接種于100 mL加Amp的 LB液體培養基中,同時分別加入0.1 g/L滅菌的乙酸鈉溶液,使得乙酸鈉的終濃度分別為0.5、1、2、3、4 和5 g/L,并設置對照組,培養8 h后,加入乳糖誘導,誘導12 h后,收集菌體,并進行洗滌,將洗滌后的菌體用pH7.4的磷酸緩沖液懸浮至吸光值相同,經超聲破碎后離心取上清,進行SDS-PAGE。配制濃度為5%的濃縮膠和濃度為12%的分離膠進行蛋白電泳,取上清液樣品20 μL與20 μL上樣緩沖液混合,于沸水中煮沸10 min后,進行點樣。
2 結果
2.1 對生長曲線的影響
在一定范圍內,菌液的細胞濃度與吸光度值(OD值)成正比,試驗中采用OD600來衡量重組大腸桿菌的細胞密度。因此,通過測定OD值的變化來間接地表示乙酸鈉對重組菌生長的抑制情況。
乙酸根對重組大腸桿菌生長曲線的影響結果(圖1)顯示,在培養基中加入乙酸鈉對BL21(DE3)/pET15b-Tres的生長會產生影響,菌體的生長明顯受到抑制,使得菌體生長的延滯期延長,且抑制作用隨濃度的增大而增強,而乙酸鈉濃度為0.5 g/L時,對菌體生長的抑制較弱,其他濃度下,0-6 h內,生長較緩慢。在6 h之后,較低濃度(乙酸鈉濃度低于5 g/L)下,菌體生長受到的抑制減弱,而在較高濃度(乙酸鈉濃度為10、20和30 g/L)下,菌體生長被嚴重抑制,生長依然緩慢。
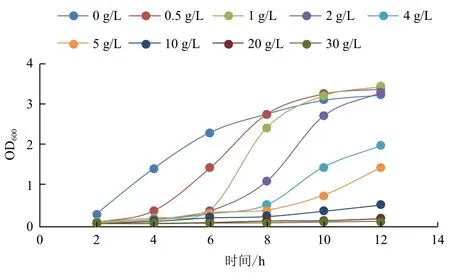
圖1 不同濃度乙酸鈉對重組菌生長曲線的影響
2.2 對細胞顯微特征的影響
經電子顯微鏡觀察對照組的重組大腸桿菌的形態,如圖2中A-1、A-2所示,其細胞形態比較完整、飽滿。而試驗組中用不同濃度的乙酸、乙酸鈉處理過的重組菌,形態發生了不同的變化。其中,用濃度為6.25 g/L和25 g/L的乙酸處理過的菌體形態如圖2-B、2-C所示,用濃度分別為6.72 g/L和26.88 g/L的乙酸鈉溶液處理過的菌體形態如圖2-D、2-E所示。圖2-B顯示,菌體基本形態沒有較大變化,只出現較小的褶皺,而圖2-C中顯示菌體出現皺縮,菌體的形態受到較大影響。乙酸鈉處理后的細胞(圖2-D、2-E)顯示,細胞會發生凹陷,隨著乙酸鈉濃度的增大,細胞受損情況加重。

圖2 環境掃描電子顯微鏡觀察乙酸(鈉)對重組菌形態結構的影響
2.3 對菌體細胞膜通透性的影響
通過測定菌液電導率的變化可以反映細菌細胞膜通透性的變化情況。重組菌經不同濃度的乙酸、乙酸鈉處理后其菌液電導率的變化情況(圖3-A)表明,菌體加入無菌水的空白對照組電導率很低,而且變化不大,而實驗組加入不同濃度的乙酸鈉后,菌液的電導率發生了不同的變化。乙酸鈉是一種強電解質,強電解質溶液的電導率隨著濃度的增加而升高,當濃度增加到一定程度后,解離度下降,離子運動速率降低,電導率也降低。相同濃度的菌液加入不同濃度的乙酸鈉后,電導率也變得不同,濃度為13.44 g/L時,電導率最大。濃度繼續升高電導率先降低后升高,可能是由于電解質解離程度高使得乙酸根由于外界壓力進入細胞內部,導致其先下降,而其他濃度的乙酸鈉加入后,會使得電導率有所升高,這說明乙酸根導致了細胞膜的通透性發生變化,內容物電解質泄露到胞外,其電導率的變化程度相差不大。而圖3-B顯示,加入乙酸后,菌液的電導率均升高,初始電導率隨濃度的增大而增大,升高程度也隨濃度增大而略有增大,說明細胞膜的破壞程度略有增加。
2.4 對菌體細胞膜完整性的影響
通過測定經不同處理后的菌液上清在260 nm處的吸光度值變化推測菌體細胞膜的完整性變化情況。重組菌經不同濃度的乙酸(鈉)處理后菌液上清的OD260變化情況(圖4-A)表明,空白對照組的菌液上清OD260沒有升高,且變化較小,而實驗組的OD260變化比較大,且高于對照組,說明實驗組的菌體細胞膜完整性受到影響,有DNA等物質的泄露;由于乙酸鈉是強電解質,濃度太高會抑制其電解率,而濃度為26.88 g/L和6.72 g/L時,趨勢相似,變化程度接近,推測其電解率相近。而濃度為13.44 g/L和3.36 g/L時,OD260值變化不大;濃度為13.44 g/L時,可能是由于乙酸鈉的電離及乙酸根的水解程度較大,會有大量的質子化的乙酸根進入細胞,對膜的完整性影響較小,而濃度為3.36 g/L時,濃度較低則對膜完整性的影響較小。乙酸添加情況(圖4-B)表明,前200 min,變化情況較復雜,無明顯的趨勢,之后可以看到試驗組的OD260高于對照組,且隨濃度增大而升高,說明乙酸會影響菌體細胞膜的完整性,導致DNA等大分子物質的泄露,且隨濃度升高作用增強。

圖3 不同濃度乙酸鈉(A)及乙酸(B)對菌體細胞膜通透性的影響
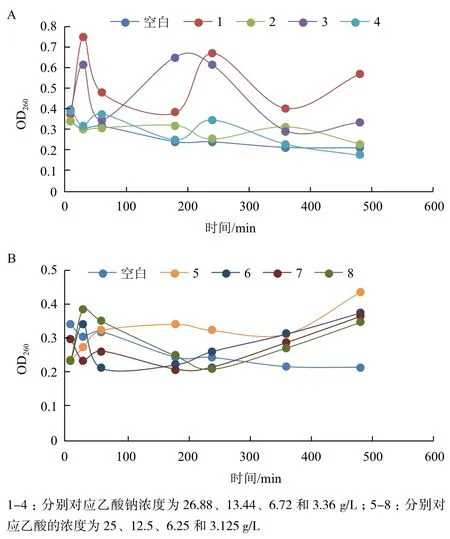
圖4 不同濃度乙酸鈉(A)及乙酸(B)對重組菌細胞膜完整性的影響
2.5 對細胞內膜的滲透性影響
通過測定菌液上清中的β-半乳糖苷酶的活性,來檢測胞內大分子滲透至胞外的情況,進而說明細胞內膜的受損情況。菌液添加乙酸鈉作用后,離心菌體,取上清測定β-半乳糖苷酶的酶活性,結果(圖5)顯示,加入乙酸鈉作用于菌體后,上清中β-半乳糖苷酶的酶活高于對照組,說明乙酸根對于細胞內膜有一定的破壞作用,導致β-半乳糖苷酶滲漏到胞外,而不同濃度的乙酸鈉對其作用效果相差不大。
2.6 熒光分析法測乙酸對菌體膜蛋白構象的影響
通過熒光分析法檢測乙酸對菌體上的膜蛋白及細胞膜結構的影響,結果(圖6)表明,KI作用后,熒光強度降低,說明能與細胞膜表面的蛋白質色氨酸Trp殘基結合,同時熒光強度逐漸降低,由此可以推斷,色氨酸Trp殘基位于細胞膜的表面和內部,當細胞膜結構發生變化時,膜內部的Trp殘基就會暴露出來與KI結合。圖7結果顯示,隨著乙酸濃度的增大,Trp殘基的熒光強度相應的依次減少,表明乙酸對Trp的熒光特性具有淬滅作用。而激發峰的位置和圖形基本上沒有變化,這表明乙酸能夠改變細胞膜的結構,使位于細胞膜內的Trp殘基暴露于細胞膜外。
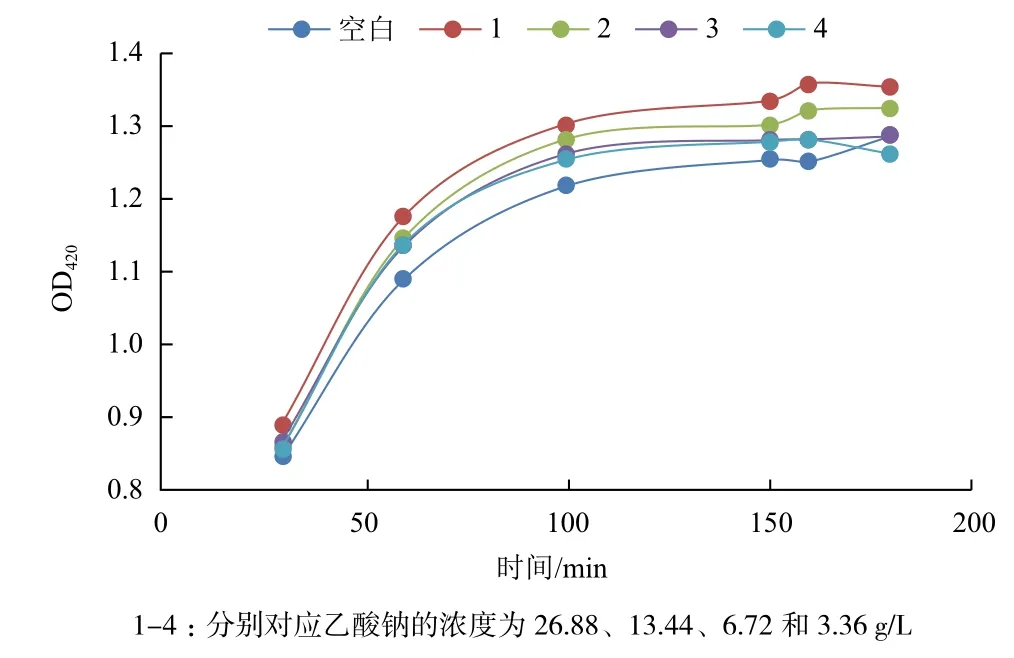
圖5 乙酸鈉對細胞內膜通透性的影響
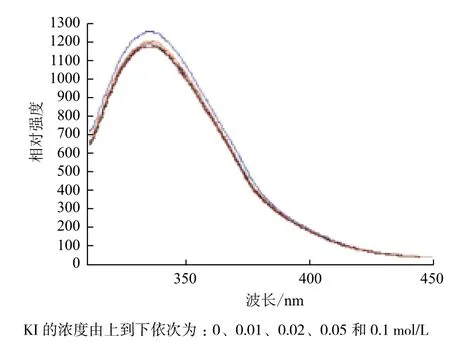
圖6 KI對重組菌膜蛋白熒光特性的影響
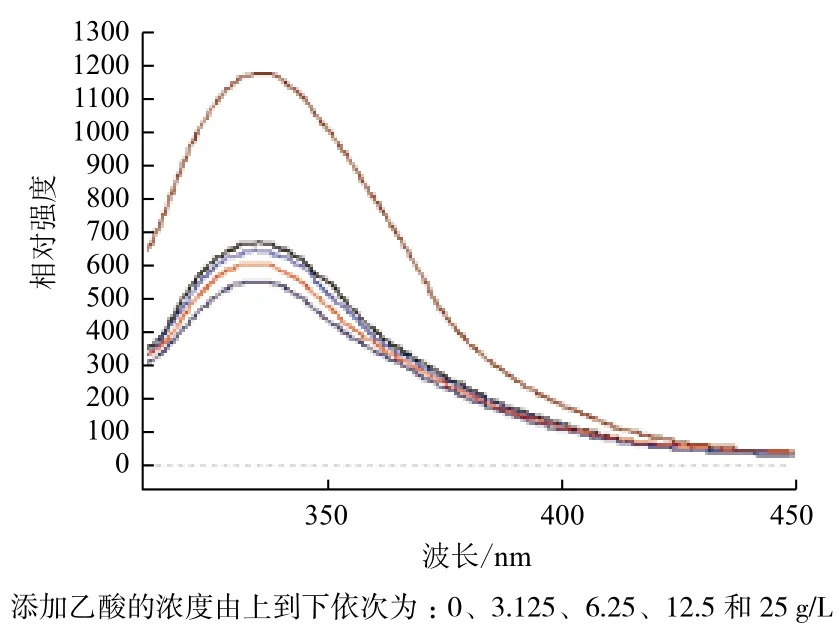
圖7 乙酸對重組菌膜蛋白熒光發射強度的影響
2.7 對蛋白質合成的影響
圖8顯示,加入低濃度的乙酸鈉,海藻糖合酶的表達量會增大,推測是由于乙酸根進入胞內,會作為碳源參與到菌體的代謝中,因而其表達量增大,但隨著濃度的繼續增大,乙酸的抑制作用也會表現出來,海藻糖合酶的表達量則隨著乙酸鈉濃度的增大而減小,說明乙酸鈉會對海藻糖合酶的表達產生抑制。
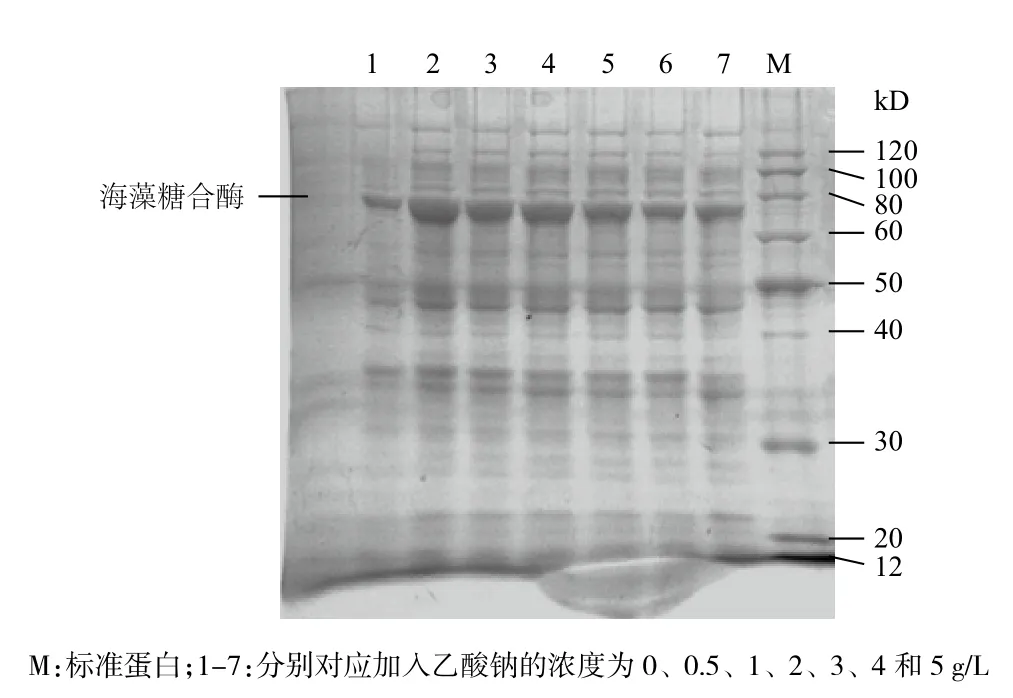
圖8 乙酸鈉作用后的重組菌蛋白SDS-PAGE電泳圖譜
3 討論
在利用重組大腸桿菌進行高密度發酵的過程中,發酵液中會有代謝副產物乙酸的積累,乙酸的存在抑制工程菌的生長及外源基因的表達[15]。乙酸對重組大腸桿菌的抑制作用已有報道,本研究根據實驗中出現的這一現象,進行了更加深入的理論基礎研究,對乙酸的抑制作用機理進行了探討。
研究中發現,在加入乙酸鈉的環境中,菌體會出現一定的適應期,較低濃度(0.5、1和2 g/L)的乙酸鈉對菌體影響較小,并且可能是由于質子化的乙酸根進入細胞后,可以作為碳源參與到細胞內的代謝中,供菌體生長所用,所以會對菌體生長稍有促進;而在較高乙酸鈉濃度下,菌體細胞或其代謝過程可能會被破壞,因而菌體生長受到嚴重抑制。本研究首先研究了乙酸、乙酸鈉對重組大腸桿菌細胞形態及顯微特征的影響,發現菌體會發生皺縮或者凹陷,有些菌體周圍可以看出類似發生了內容物的外泄,這可能是由于乙酸、乙酸鈉引起了菌體細胞膜的破壞,進而導致了菌體形態的變化甚至內容物的外泄。
根據上述現象,通過實驗進一步研究了乙酸、乙酸鈉對于菌體細胞膜的影響,細菌的細胞膜具有一定的流動性,當細菌細胞膜遭到破壞,使得其半透性及流動性降低時,細胞的內環境穩定性會被破壞,從而導致內部的電解質(如K+)外滲,培養液的電導率上升[16]。細菌細胞膜是細菌的結構組分,不僅是細胞的保護屏障,也是在細胞的生命活動中有著復雜功能的重要結構。當細胞膜遭到破壞時,首先細胞內的小分子物質外滲出來,然后是DNA和RNA等一些大分子的外滲,而DNA和RNA在260 nm處有強吸收,因此,對260 nm吸收物質的檢測被廣泛應用于測定細胞膜的完整性[17]。測定處理后菌液電導率的變化反映了細菌細胞膜通透性的變化,通過測定處理后菌液上清在260 nm處的吸光度值變化推測菌體細胞膜的完整性變化,而這兩個實驗結果比較復雜,分析可能涉及到乙酸、乙酸鈉的解離和水解問題,但結果說明菌體細胞膜的通透性與完整性都會受到一定的影響。
細菌在受到乳糖誘導后均可產生β-半乳糖苷酶,β-半乳糖苷酶是位于細胞內的水解酶,能使乳糖水解成半乳糖和葡萄糖。鄰硝基苯 β-D-半乳吡喃糖苷(ONPG)是乳糖的類似物,β-半乳糖苷酶可以將ONPG 水解成半乳糖和黃色的鄰-硝基苯酚,因此可以通過顏色的變化測知β-半乳糖苷酶的活性[18]。實驗通過測定菌液上清中的β-半乳糖苷酶的活性,來檢測胞內大分子滲透至胞外的情況,進而說明細胞內膜的受損情況,不同濃度的乙酸鈉對其作用后會有影響,但差別較小。
蛋白質分子中因含有色氨酸(Trp)、酪氨酸(Tyr)和苯丙氨酸(Phe)等氨基酸殘基而產生內源性熒光。在大多數情況下,可以認為蛋白質所顯示的熒光主要來自色氨酸殘基,其變化直接反映了蛋白質中色氨酸殘基本身及其周圍環境的變化。當某些小分子如藥物等物質與蛋白質結合時,導致其熒光強度下降,稱為熒光淬滅作用[19]。根據Trp的激發波長Ex,固定Ex,通過日立F-4500熒光分光光度計在310-450 nm范圍內掃描即可確定Trp在重組大腸桿菌膜蛋白中的發射波長Em。
為了確定Trp在重組大腸桿菌膜中的位置,需要將猝滅劑KI(1 mol/L)稀釋成不同濃度(0、0.01、0.02、0.05 和0.1 mol/L)加入,檢測對Trp發射波長Em的峰位和峰高的影響。如果Em迅速降低,則表明該氨基酸殘基位于表面,如果Em變化不大,則表明該氨基酸殘基位于膜內,如果Em逐漸降低,就表明該氨基酸殘基的位置有兩種可能,可能是在膜內也有可能是在膜外[20]。結果表明乙酸能夠改變細胞膜的結構,使位于細胞膜內的Trp殘基暴露于細胞膜外。這個結論比較明確地說明了乙酸會對細胞膜產生影響,進而影響其功能。
在研究乙酸鈉對蛋白合成的影響時,可以看到明顯的趨勢,低濃度下乙酸鈉的添加會促進海藻糖合酶的表達量,而高濃度的乙酸鈉又會起到抑制作用。其原因可能是乙酸根會影響DNA的復制或表達,也可能是乙酸鈉使菌體細胞膜受到損壞,導致一部分酶發生了外泄造成的。
在研究過程中,采用的是菌液中外源添加乙酸、乙酸鈉的方法,由于乙酸在溶液中的存在形式有乙酸分子形式及乙酸根形式,則試驗中分別對兩種形式進行了研究,添加乙酸、乙酸鈉至所需的濃度后,菌液的pH變化與對照組相差較小,因此主要考慮了乙酸、乙酸根的影響。
據已有的研究表明,某些抑菌劑可與細菌染色體DNA發生相互作用,導致DNA的復制、轉錄以及表達受到抑制[21,22]。本試驗中乙酸會影響海藻糖合酶的表達量,這可能是由于乙酸對胞內DNA、RNA等產生抑制作用直接影響其表達量,也可能是由于隨著乙酸濃度的增大,重組菌細胞的通透性、結構等發生變化,導致部分蛋白發生泄露,因而影響了目的蛋白的含量。具體的機制還需要今后做進一步研究,進行驗證。
4 結論
根據發酵過程中的檢測初步研究了乙酸(鈉)對重組大腸桿菌的抑制作用及部分作用機理。通過外源添加乙酸(鈉)的方法,對重組菌的生長曲線、細胞膜通透性、細胞膜結構、細胞超微結構、蛋白表達等方面進行了研究,結果表明,乙酸(鈉)作用于重組菌后,可使其生長受到抑制,且隨濃度的不同而發生變化;細胞膜的通透性會有所增加,細胞膜的完整性及膜的結構受到破壞,導致部分細胞內容物發生泄露;菌體正常形態發生變化;重組海藻糖合酶的表達受到影響。
[1]Hodgson J. Expression systems:a user’s guide, emphasis has shifted from the vector construct to the host organism[J]. Biotechnology, 1993, 11(8):887-893.
[2]張建新, 張噸, 胡文波, 等. 重組大腸桿菌高細胞密度發酵研究進展[J]. 中國釀造, 2011(2):5-8.
[3]Han K, Lim HC, Hong J. Acetic acid formation in Escherichia coli fermentation[J]. Biotechnol Bioeng, 1992, 39:663-671.
[4]李民, 陳常慶. 重組大腸桿菌高密度發酵研究進展[J]. 生物工程進展, 2000, 20(2):26-31.
[5]Lee SY. High cell-density culture of Escherichia coli[J]. Trends Biotechnol, 1996, 14(3):98-105.
[6] EL-Mansi EMT, Holms WH. Control of carbon flux to acetate excretion during growth of Escherichia coli in batch and continuous cultures[J]. J Gen Microbio, 1989, 135:2875-2883.
[7] Luli GW, Strohl WR. Comparison of growth, acetate production,and acetate inhibition of Escherichia coli strains in batch and fedbatch fermentations[J]. Appl and Envir Microbio, 1990, 56(4):1004-1011.
[8] Wolfe AJ. The Acetate Switch[J]. Microbiol Mol Biol Rev, 2005,69:12-50.
[9]吳軍, 于公義, 馮爾玲. 乙酸積累對基因工程菌培養的影響及與培養基pH的關系[J]. 微生物學報, 1996, 36(6):433-437.
[10]周漣, 羅進賢, 張添元, 等. 培養條件對含血管生成抑制素工程菌生長和表達的影響及乙酸的控制作用[J]. 中山大學學報:自然科學版, 2003, 42(1):55-57.
[11]Eiteman MA, Aitman E. Overcoming acetate in Escherichia coli recombinant protein fermentations[J]. Trends Biotechnol, 2006,24:530-536.
[12] Koh BT, Nakashimada U, Pfeiffer M, et al. Comparison of acetate inhibition on growth of host and recombinant E. coli K12 strains[J]. Biotechnol Lett, 1992, 14(12):1115-1118.
[13]Kesson M, Karlsson EN, Hagander P, et al. Online detection of acetate formation in Escherichia coli cultures using dissolved oxygen responses to feed transients[J]. Bioeng, 1999, 64:590-598.
[14]Tsuji Y, Aoyama T, Takeuchi K, et al. Identification and characterization of an antibacterial peptide of the 26-KDa protease of Sarcophaga peregrina with antibacterial activity[J]. Biochem,2001, 130:313-318.
[15]沈林南, 魏東芝, 周宇荀, 等. 乙酸對重組大腸桿菌生長及外源基因表達的影響[J]. 微生物學通報, 2000, 27(4):254-256.
[16]楊俊杰, 陳利軍, 楊海霞, 石慶鋒. 水杉種子揮發物質的鑒定及其抗菌活性測定[J]. 中國生態農業學報, 2010, 18(5):1018-1021.
[17]Xing K, Chen XG, Liu CS, et al. Oleoyl-chitosan nanoparticles inhibits Escherichia coli and Staphylococcus aureus by damaging the cell membrane and putative binding to extracellular or intracellular targets[J]. International Journal of Food Microbiology, 2009,132:127-133.
[18] Zasloff M. Antibiotic peptides as indicators of innate immuneity[J]. Curr Opin Immunol, 1992, 4:3-7.
[19]劉喚明, 孫力軍, 王雅玲, 等. 納豆菌脂肽對金黃色葡萄球菌抑菌機理的研究[J]. 食品工業科技, 2012, 33(11):109-112.
[20]許理. 魚腥草素同系物對枯草芽孢桿菌抗菌機理研究[D].重慶:西南大學, 2010.
[21]Hattori N, Nomoto H, Fukumitsu H. Royal jelly and its unique fatty acid, 10-hydroxy-trans-2-decenoic acid, promote Neurogenesis by Neural Stem/progenitor cells in vitro[J]. Biomedical Research,2007, 28(5):261-266.
[22]黃現青. Bacillus subtilis產生的脂肽抗微生物效果及安全性評價[D]. 南京:南京農業大學, 2006:30-43.
(責任編輯 馬鑫)
Study on Effects of Acetic Acid on Enzyme Production of the Recombinant Escherichia coli BL21 and Its Action Mechanism
Dai Kun Wang Tengfei Hao Zhaocheng Tang Dandan Liu Hongjuan Wang Ruiming
(Department of Biology Engineering,QILU University of Technology,Ji’nan250353)
Our objective is to study the effects of acetic acid from fermentation on the growth of the recombinant Escherichia coli BL21(DE3)/pET15b-TreS as well as the expression of the recombinant trehalose synthase gene, and the action mechanism was also discussed. Firstly, we studied the effect of acetic acid on the growth of recombinant Escherichia coli by experiments with adding acetic acid(sodium acetate), and observed the morphological changes of recombinant bacteria by using environmental scanning electron microscope. Then, the effects of acetic acid(sodium acetate)on the permeability and the integrity of cell membrane were studied through the determination of electrical conductivity of the broth and the changes of OD260of the supernatant. The activity of β-galactosidase in the supernatant was measured to determine the effect of sodium acetate on intracellular membrane, and then the influence of acetic acid on the conformation of membrane protein by using fluorescence analysis were detected. Finally, the effect of sodium acetate on the expression of the recombinant trehalose synthase gene by SDS-PAGE was studied. Results showed that the acetic acid(sodium acetate)could have certain inhibition effects on the recombinant bacteria growth, and caused cell surface to be depressed and shrinkage. The permeability and integrity of cell membranes were affected by the acetic acid(sodium acetate), leading some substances in cells to leak out. And experiments also revealed that the acetic acid could make effects on the conformation of the membrane protein in the cell membrane, which caused a certain degree of damages to the membrane structure. SDS-PAGE analysis suggested that the sodium acetate had impacts on the expression of the recombinant trehalose synthase gene. The acetic acid(sodium acetate)was confirmed to affect the cell growth and the expression of the recombinant trehalose synthase gene, and the cell membrane was a target of its function.
acetic acid;Recombinant Escherichia coli;antimicrobial mechanism;cell membrane;trehalose synthase
10.13560/j.cnki.biotech.bull.1985.2015.05.032
2014-08-14
山東省科技發展計劃(2011GGB01160)
戴琨,女,碩士研究生,研究方向:微生物酶技術;E-mail:daikun1989@126.com
王瑞明,博士,教授,研究方向:微生物酶技術;E-mail:ruiming3k@163.com

