丙肝病毒RNA提取方法優化研究
劉學敏 陳麗茹 馬冬雪等
[摘 要] 目的:比較微柱離心法與微柱負壓泵兩種核酸提取方法提取丙型肝炎病毒核糖核酸(HCV RNA)優劣。方法:對160例HCV抗體陽性的患者血清,分別采用兩種核酸提取方法提取HCV RNA,對所提RNA同時采用熒光定量技術檢測RNA含量,比較兩種方法提取純度、對檢測靈敏度、重復性影響;結果:離心法提取RNA濃度純度明顯高于負壓泵法,兩種方法靈敏度無統計學差異,離心法結果穩定,高于負壓泵法近20 %,預計重復性達99 %,差異有統計學意義(P < 0.05);結論:離心法有效提高了RNA提取效率,提高了檢測重復性。
[關鍵詞] 丙肝病毒,HCV;核酸提取;熒光定量聚合酶鏈反應
中圖分類號:R331 文獻標識碼: B 文章編號:2095-5200(2015)05-050-03
丙型肝炎病毒(簡稱丙肝病毒,Hepatitis C Virus, HCV)是慢性肝炎、肝硬化和肝細胞癌(hepatocellular carcinoma, HCC) 誘因之一[1-2]。HCV診斷需提取患者血清中HCV RNA 進行檢測[3-4]。RNA提取質量直接決定了診斷準確性[5-6]。熒光定量法能準確反映HCV患者體內病毒載量,且檢測靈敏度和特異度高,能有效縮短檢測窗口期[7-8]。目前市場上多數試劑盒對HCV RNA提取采用酚-氯仿提取法,該提取法工作量大、操作復雜,提取純度和分離效率一般,日常科研工作中難度較大。本文擬通過純化柱方法提取HCV RNA,比較離心法與負壓泵法抽取方法提取HCV RNA優劣,將提取RNA通過實時熒光定量PCR進行檢測。
1 實驗部分
1.1 材料
160例HCV陽性血清標本來自本院2014年5 ~ 12月門診及住院丙肝患者,陰性血清來自無肝病史且HCV RNA陰性健康體檢者。
1.2 儀器與試劑
Roche公司Light-cycle熒光定量PCR分析儀;兩種微柱核酸提取法所用試劑及PCR擴增試劑均購自凱杰生物工程深圳有限公司,試劑盒最低檢測限為5.0×102 U/mL。
1.3 標本采集
病人血清樣本分別加入2 mL以乙二胺四乙酸二鈉(EDTA-2Na)抗凝,并在3 h內分離血漿,-80 ℃ 冰箱保存。
1.4 微柱負壓泵提取法
(1)將血清樣本標記,分別取待測血漿和對照品及標準品各100 μL,向各管中加入100 μL裂解液(已加有助沉劑),用移液槍反復吹打5~8次,加入20 μL 去抑制劑,離心數秒,70 ℃反應10 min;(2)離心數秒,分別向各樣品中加入110 μL無水乙醇,振蕩混勻,離心數秒;(3) 核酸提取柱插入連接管后,固定在負壓裝置上,并做上標記,然后將上一步中所有液體小心轉入相應核酸提取柱中,開啟負壓,抽干核酸提取柱中全部液體;(4)加入500 μL洗滌液A到提取柱內,開啟負壓,抽干柱中所有液體;(5)加入500 μL洗滌液B,開啟負壓,抽干柱內所有洗滌液;(6)取出核酸提取柱,放入無RNA酶2 mL離心管中,14000 r/min離心1 min,棄掉廢液及離心管;(7)將提取柱放入另一新無RNA酶2 mL離心管中,小心將50 μL洗脫液加在柱內中央,靜置1 min; 10000 r/min離心1 min;(8)離心管中收集液即為HCV RNA溶液,存于-80℃備用。
1.5 微柱離心法
(1)將待測血漿和對照品及標準品100 μL分別加入等體積已混有助沉劑裂解液充分裂解,再分別加入20 μL 去抑制劑,離心數秒,置70 ℃反應10 min;(2)然后將上清轉移入加入吸附柱RA中(吸附柱套在收集管中);(3)在10000 r/min條件下離心45 s,去除收集管中廢液,并將吸附柱重新放入收集管中;(4)加500 μL去蛋白液RE,12000 r/min離心45 s,棄掉廢液;(5)加700 μL漂洗液RW,12000 r/min離心30 s,棄掉廢液;(6)加500 μL漂洗液RW,120000 r/min離心30 s,棄掉廢液。(7)將吸附柱放入收集管中,12000 r/min離心1 min,盡量去除漂洗液,減少殘留乙醇對下游反應影響;(8)取出吸附柱,將其放入一個新無RNA 酶離心管中,加入50 μLDEPC水(事先在65℃-70℃水浴中加熱效果更好),室溫放置2 min。12000 r/min離心30 s,收集得到RNA存于-80℃備用。
1.6 HCV RNA定量檢測
兩種提取方法均采用相同試劑進行檢測,操作嚴格按試劑說明書進行,逆轉錄和擴增均在儀器上一次完成。最低檢測下限均為500 U/mL。
1.7 靈敏度比較
HCV強陽性血清及用陰性血清10倍倍比稀釋系列稀釋血清標本,將所有病例分成6組,分別用上述兩種方法提取HCV RNA,將提取RNA進行熒光定量檢測,定量結果計算對數值,比較兩種方法提取靈敏度。
1.8 重復性比較
取上述中等含量HCV RNA標本1份,分別用上述兩種方法各提取核酸10次進行熒光定量檢測,定量結果計算對數值,比較兩種方法提取重復性。
1.9 統計分析
應用SPSS17.0 分析軟件進行統計學分析組間比較采用t檢驗,以P < 0.05為具有顯著差異,即有統計學意義。
2 結果
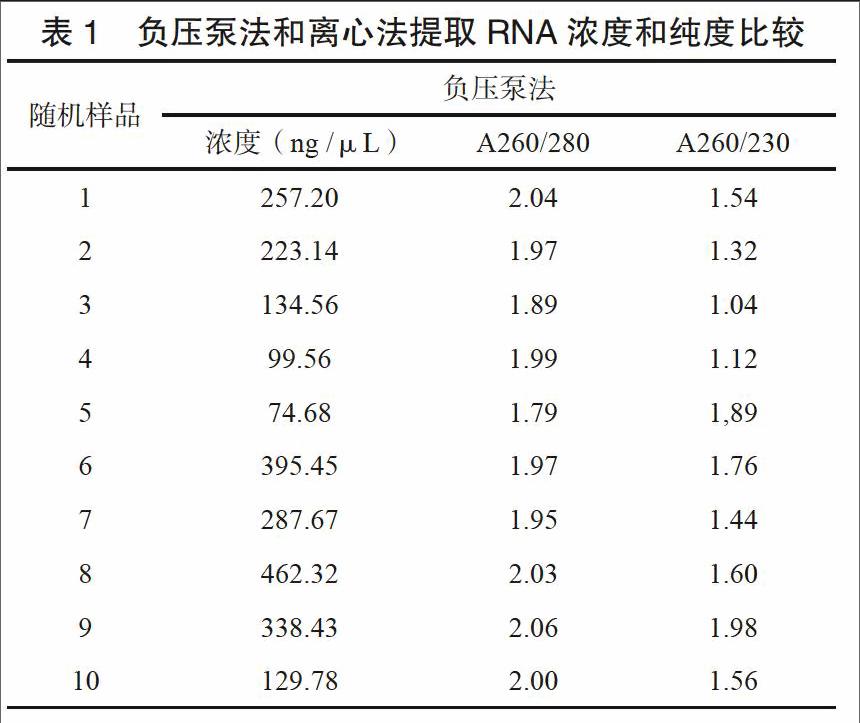
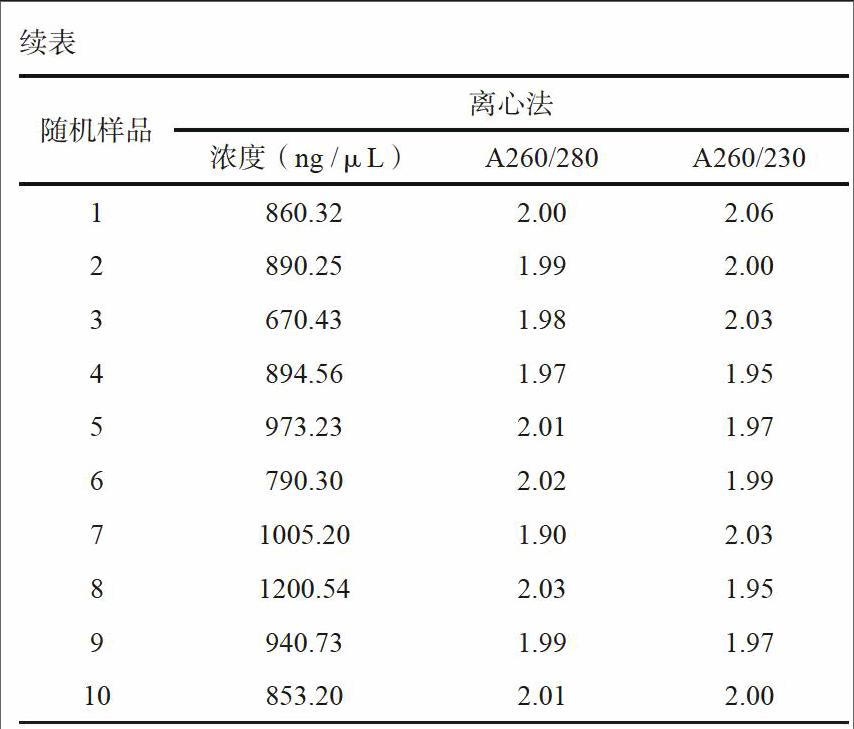
2.1 HCV RNA濃度和純度比較
將負壓泵法和離心法提取RNA隨機取出少量,用Nano drop 2000 分別檢測兩種方法提取RNA濃度和純度,進行比較。結果如下表,用離心法提取RNA濃度明顯高于負壓泵法,而且從A260/280和A260/230比值來看,離心法提取RNA純度也明顯好于負壓泵法。
2.2 HCV陽性率分析
以負壓泵法及微柱離心法提取HCV RNA,進行定量檢測,陽性率分別為60.6 %(97/160)、79.4 %(127/160)。微柱離心法所提RNA陽性率高于負壓泵提取法。
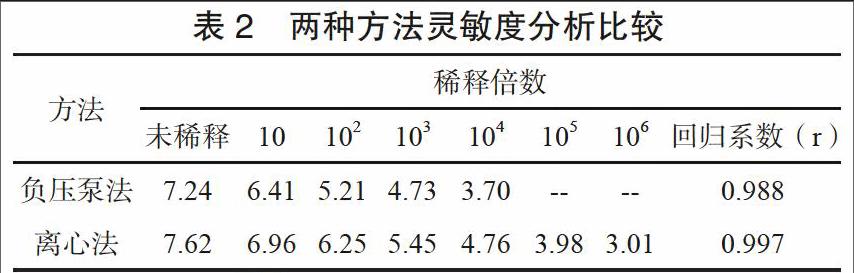
2.3 靈敏度分析
兩種核酸提取方法靈敏度無顯著性差別,基本都可以滿足臨床應用。但微柱離心法檢測限相較于負壓泵發更低,對臨界值附近低濃度樣本提取效果更好。以微柱負壓泵提取法提取RNA,其濃度水平檢測下限為9.34×106 U/mL,中位數為4.16×104 copy/ mL;以微柱離心法提取RNA檢測其濃度水平,檢測下限為9.83×107 U/mL,中位數為8.82×104 copy/mL。將兩法結果換算成對數值經t檢驗,兩者差異無統計學意義(P> 0.05)。見表2。
2.4 重復性比較
取中等含量標本1份,分別兩種方法各提取核酸10次,然后對所提RNA進行定量PCR檢測,定量結果對數值分別為:負壓泵法為4.26,變異系數(CV)為13.12%,微柱離心法為4.68,變異系數(CV)為0.86 %。即通過微柱離心法提取HCV RNA重復性好,可達99%以上。
3 討論
臨床上目前較多應用熒光定量PCR對HCV RNA進行定量檢測[9-10]。這種方法采用閉管操作不易造成產物污染,具有敏感、特異、快速優點[11-12]。熒光定量PCR實驗要求較高,其中提取核酸作為擴增反應模板是整個檢測中最重要前期步驟,提取核酸處理方法不同可直接影響PCR效果與實驗檢測結果[13-14]。
本研究采用了負壓泵法和微柱離心法兩種方法分別提取HCV RNA,對兩種方法靈敏度、重復性以及所提RNA質量進行檢測分析。實驗結果表明,這兩種核酸提取方法靈敏度無顯著性差別,但微柱離心法重復性明顯優于負壓泵法,可達99 %以上。從提取RNA濃度和純度來看,微柱離心法提去濃度均在800~1000 ng /μL左右,而負壓泵法提取RNA濃度則在200~400 ng/μL左右,明顯低于微柱離心法提取RNA濃度。另一方面從提取純度(A260/280和A260/230比值)來看,微柱離心法提取RNA純度明顯比負壓泵法高。本研究結果顯示離心法提取,有效提高了RNA提取效率,提高了檢測重復性。
參 考 文 獻
[1] 譚躍, 黃淑媛, 劉勇. 丙型肝炎病人在治療過程中 HCV-RNA 含量, 血清抗 HCV 抗體及其生化指標變化[J]. 國際醫藥衛生導報, 2009, 15(17): 8-11.
[2] 喬斌, 汪明, 袁樂永, 等. 丙型肝炎病毒基因型與慢性丙型肝炎患者病情嚴重程度之間關系研究[J]. 醫學檢驗, 2012,15(1): 4.
[3] 趙輝, 謝堯, 李明慧, 等. 慢性丙型肝炎患者血清 HCV 基因型和 RNA 含量與 ALT 和 AST 水平不相關[J]. 中華檢驗醫學雜志, 2007, 30(6): 631-634.
[4] 王露楠, 吳健民, 李金明, 等. 丙型肝炎病毒核酸檢測國家標準物質研制[J]. 中華檢驗醫學雜志, 2006, 29(4): 354-357.
[5] Keys J R, Leone P A, Eron J J, et al. Large scale screening of human sera for HCV RNA and GBV‐C RNA[J]. Journal of medical virology, 2014, 86(3): 473-477.
[6] Maasoumy B, Cobb B, Bremer B, et al. Detection of low HCV viraemia by repeated HCV RNA testing predicts treatment failure to triple therapy with telaprevir[J]. Alimentary pharmacology & therapeutics, 2014, 39(1): 85-92.
[7] Greco M, Sáez C A, Brown M T, et al. A simple and effective method for high quality co-extraction of genomic DNA and total RNA from low biomass Ectocarpus siliculosus, the Model Brown Alga[J]. PloS one, 2014, 9(5): 96470.
[8] 張言超,陳明,李強. 熒光定量PCR檢測HCV RNA兩種核酸提取法比較[J]. 放射免疫學雜志,2010, 23(5), 582-583.
[9] Sarrazin C, Wedemeyer H, Cloherty G, et al. Importance of very early HCV RNA kinetics for prediction of treatment outcome of highly effective all oral direct acting antiviral combination therapy[J]. Journal of virological methods, 2015, 214: 29-32.
[10] Santos C, Reis A, dos Santos C V, et al. The use of real-time PCR to detect hepatitis C virus RNA in dried blood spots from Brazilian patients infected chronically[J]. Journal of virological methods, 2012, 179(1): 17-20.
[11] Das A, Spackman E, Pantin-Jackwood M J, et al. Removal of real-time reverse transcription polymerase chain reaction (RT-PCR) inhibitors associated with cloacal swab samples and tissues for improved diagnosis of avian influenza virus by RT-PCR[J]. Journal of Veterinary Diagnostic Investigation, 2009, 21(6): 771-778.
[12] 李曉豐, 劉顯智, 楊麗艷, 等. 實時熒光定量 PCR 篩查獻血者 HCV RNA 初步研究[J]. 中國輸血雜志, 2006, 19(1): 39-40.
[13] Mikel P, Vasickova P, Kralik P. Methods for Preparation of MS2 Phage-Like Particles and Their Utilization as Process Control Viruses in RT-PCR and qRT-PCR Detection of RNA Viruses From Food Matrices and Clinical Specimens[J]. Food and environmental virology, 2015: 1-16.
[14] Liu S, Hou G, Zhuang Q, et al. A SYBR Green I real-time RT-PCR assay for detection and differentiation of influenza A (H1N1) virus in swine populations[J]. Journal of virological methods, 2009, 162(1): 184-187.

