川芎嗪激活Wnt信號通路改善阿爾茨海默病大鼠腦組織炎性研究
霍江濤 張小喬 嚴 潔 潘慶敏 陳 敏
川芎嗪激活Wnt信號通路改善阿爾茨海默病大鼠腦組織炎性研究
霍江濤張小喬嚴潔潘慶敏陳敏
目的 探討川芎嗪是否能通過激活Wnt信號通路改善阿爾茨海默病(AD)大鼠腦組織炎性,并探討其作用機制。方法 采用β淀粉樣肽25-35(Aβ25-35)雙側海馬注射造阿爾茨海默病大鼠模型,觀察川芎嗪對AD大鼠海馬tau蛋白上部分磷酸化位點及β淀粉樣蛋白(Aβ)前體APP水平的影響,Wnt途徑中β-聯蛋白(β-catenin)和糖原合成激酶3β(GSK-3β)水平,同時采用免疫組化技術測定4組AD大鼠海馬Aβ沉積程度。結果 模型組大鼠單側大腦皮質區Aβ沉積明顯,鏡下可見細胞間隙呈褐色改變。而經川芎嗪干預后,褐色成分逐漸減少,川芎嗪可顯著抑制Aβ沉積,顯著抑制tau磷酸化,抑制GSK-3活性,減少β-catenin降解。結論 TMP通過對AD大鼠海馬組織GSK-3β陽性表達的抑制、導致β-catenin降解下降,從而抑制tau蛋白過度磷酸化,并可激活Wnt信號通路抑制Aβ蛋白引起神經毒性,從而發揮神經細胞保護作用。
阿爾茨海默病 川芎嗪 Wnt信號通路 tau蛋白 β-聯蛋白
阿爾茨海默病(Alzheimer' s disease,AD)又稱老年性癡呆。報道顯示[1],炎癥及氧化應激是導致AD的發病的主要因素。川芎嗪( tetramethylpyrazine,TMP)為中藥川芎的有效成分,現代藥理學研究表明,其具有神經保護作用,對多種疾病造成的神經元損傷顯示出良好的效果[2]。以往研究證實了TMP通過抑制RAGE-ERK1/2-p38-NFKB信號通路可改善AD組織炎性[3]。然而近年來,Wnt信號通路與AD發病的關系被重視,認為激活Wnt信號通路從而抑制β-catenin的神經毒性成為治療AD的新觀點。故本項目對TMP是否能通過激活Wnt信號通路改善AD大鼠腦組織炎性進行了研究,現報道如下。
1 臨床資料
1.1一般資料 (1)試驗動物:10個月月齡SD大鼠60只,200~250g(SPF級,北京大學醫學部實驗動物科學部)。(2)藥物及試劑:鹽酸川芎嗪注射液(上海第一生化藥業有限公司)。腦源性Tau蛋白激酶(Rabbit,TTBin/BDTK)抗體;GSK-3β體(Rabbit,GSK-3β)抗體。DAB顯色試劑盒(北京索萊寶科技有限公司),β淀粉樣蛋白(β-AP)試刻盒(上海科敏生物科技有限公司)。(3)儀器:Multiskan MK3型酶標儀(芬蘭雷勃集團),7160型全自動生化分析儀(Hitachi Limited),GC-911型放射免疫計數儀(中國科技大學實業總公司),二通道微量注射泵(德國TUV公司),雙臂數顯式腦立體定位儀(STOELING公司),DPXVIEW PRO型顯微-彩色圖像處理系統(北京薩爾笛科技有限公司)。
1.2方法 (1)動物模型制備、分組及干預:按照隨機原則將大鼠分為4組,每組各12只,分別為模型組、川芎嗪高劑量組(60mg/kg)、川芎嗪低劑量組(20mg/ kg)和對照組。大鼠麻醉采用腹腔注射10%水合氯醛380mg/kg,麻醉成功后固定于腦立體定位儀上,以前囟為原點,向后4.4mm,左右各旁開2.2mm為穿刺點,鉆孔穿顱,自腦表面進針3.0mm至雙側海馬,采用微量注射器將β淀粉樣肽25-35(Aβ25~35)10μl(10μg)5min內均勻緩慢注入,待其充分浸潤后拔針。對照組注射等量0.9%氯化鈉液[4]。拔針后縫合傷口,常規飼養于標準環境溫度(22±2)℃,濕度(55±5)%的環境中自由攝食飲水,造模3d后給藥,TMP高低劑量組每天尾靜脈注射給藥(0.5ml/只),模型組與對照組注射等體積的0.9%氯化鈉液,連續給藥21d。(2)大鼠Wnt表達腦組織炎癥因子檢測:4組大鼠連續給藥21d后,腹腔注射10%水合氯醛380mg/kg麻醉,斷頭將大鼠殺死,迅速在0.9%氯化鈉液冰面上取腦,沖凈血液,右側大腦分離海馬組織,置于4%多聚甲醛中固定,常規經包埋、切片、脫水、脫蠟處理。0.01mol/檸檬酸鈉緩沖溶液(pH=6)微波熱修復抗原,滴加一抗,37℃孵育40min,滴加HRP標記的IgG抗體,37℃孵育20min,DAB顯色。每張切片均隨機取4個高倍視野在顯微鏡下觀察大鼠的海馬區域[5]。另剪出0.3g皮層,分別將海馬及0.3g皮層以2ml生理鹽水冰浴勻漿,4℃,2000r/min,離心10min,取上清液放入-80℃冰箱待測。以放射免疫法檢測海馬組織的β淀粉樣蛋白(Aβ)及tau蛋白等含量。
1.3統計學方法 采用SPSS17.0統計軟件。計量資料以(±s)表示,多組間比較采用單因素方差分析,組間兩兩比較采用LSD法,以P<0.05為差異有統計學意義。
2 結果
2.1川芎嗪對AD大鼠海馬tau蛋白磷酸化及Aβ前體APP水平影響 與對照組比較,模型組細胞中tau蛋白在位點Ser199/202及Ser422上磷酸化水平及Aβ前體APP水平明顯升高(P<0.05),與模型組比較,TMP高劑量組、低劑量組tau-1蛋白在位點Ser199/202及Ser422上磷酸化水平及Aβ前體APP水平顯著下降(P<0.05),tau-1蛋白在位點Ser199/202及Ser422上磷酸化水平顯著升高(P<0.05),見表1。

表1 川芎嗪對AD大鼠海馬tau蛋白磷酸化及Aβ前體APP水平影響(x±s)
2.2川芎嗪對AD大鼠海馬內Aβ沉積狀態分析 模型組大鼠單側大腦皮質區出現陽性表達。顯微鏡下可見細胞間隙呈現褐色改變。經川芎嗪給藥后,褐色成分逐漸變淡,說明Aβ沉積狀態明顯較給藥前改善。見圖1。
2.3川芎嗪對AD大鼠海馬內GSK-3活性的影響 與對照組比較,模型組大鼠海馬組織中GSK-3陽性表達IOD值明顯升高(P<0.05);與模型組比較,TMP高劑量組、TMP低劑量組GSK-3陽性表達IOD值明顯降低(P<0.05),見表2。
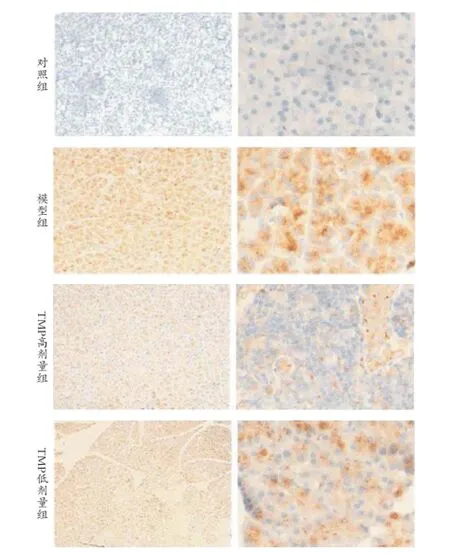
圖1 4組AD大鼠Aβ前體APP沉積
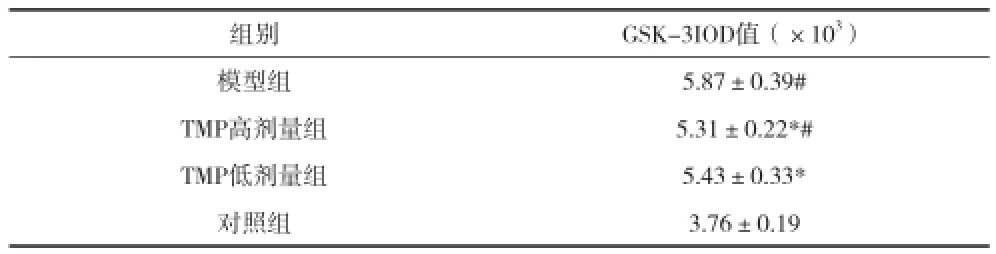
表2 川芎嗪對AD大鼠海馬內GSK-3活性的影響(x±s)
2.44組大鼠大腦Wnt信號通路中β-聯蛋白(β-catenin)水平變化 與對照組比較,AD模型組大鼠大腦β-catenin水平顯著下降。采用川芎嗪高劑量、低劑量干預后,β-catenin水平均呈顯著上升。結果顯示,在患AD時,Wnt信號通路是下調的,但通過給予川芎嗪后,Wnt信號通路活性上調。見表3。

表3 4組大鼠大腦Wnt信號通路中β-catenin水平變化(x±s)
3 討論
近年來,AD的發病率逐年上升,已成為影響人類健康的主要疾病之一。AD的病因尚不明確,目前大部分學者認為,Wnt信號通過與AD的發病及發展密切相關[6]。Wnt蛋白通過自分泌或旁分泌與位于細胞膜上的受體結合,從而使細胞內信號途徑被激活,發揮調節靶基因的表達的作用,在細胞的生長、自我更新、分化、遷移和凋亡等方面發揮著重要作用。Aβ聚集而成的老年斑通過與過度磷酸化的微血管相關蛋白tau相結合,構成的神經纖維纏結是AD的病理學標志[7]。Aβ的聚集和tau蛋白的過度磷酸化可產生神經毒性,致使海馬神經元的大量缺失。而在這一過程中Wnt信號通路參與了大部分過程[8]。
對于AD的致病機制最主要的因素是Aβ異常沉積。Aβ可誘導神經毒性作用,其聚集沉淀后可導致局部炎癥反應,從而導致神經元退行性改變,最終導致AD的發生。Aβ是由存在于細胞膜上的淀粉樣前體蛋白通過β蛋白酶與γ蛋白酶的2步酶切而形成,單體Aβ會逐漸聚合成寡聚狀態,最終誘導神經毒性。Querfurth等[9]研究表明,Aβ淀粉樣前體蛋白、早老素Ⅰ等基因的突變會導致Aβ的產生和清除動態失衡,造成Aβ特別是Aβ42過度積累,從而導致AD的發生。Shruster等[10]研究表明,Aβ對Wnt途徑的阻斷除直接引起海馬神經元的破壞外,還會導致神經干細胞的分化減低。本資料結果表明,模型組大鼠單側大腦皮質區Aβ沉積明顯,顯微鏡下可見細胞間隙呈褐色改變。而通過給予川芎嗪后,褐色成分逐漸減少,說明川芎嗪Aβ沉積較前改善,表明Aβ可以通過抑制Wnt信號通路的功能產生神經毒性,最終導致大量神經元的缺失。而TMP可通過激活Wnt信號通路抑制Aβ蛋白引起神經毒性。
Tau蛋白是一種含磷的微管相關細胞骨架蛋白,位于神經元的突觸上。Roberson等[11]研究顯示,正常成年人腦內的Tau蛋白呈磷酸化與去磷酸化平衡狀態,這樣可保持神經元細胞骨架的穩定性和軸突的形態。然而AD患者神經元內tau蛋白呈過度磷酸化狀態,過度磷酸化的tau蛋白相互聚集形成神經纖維纏結,從而失去與微管相關細胞蛋白相結合的能力,致使微管的集聚和細胞骨架的穩定性受到破壞,最終引起神經元的死亡。本資料結果表明,模型組細胞中tau蛋白在位點Ser199/202及Ser422上磷酸化水平及Aβ前體APP水平顯著升高(P<0.05),而TMP高劑量組、低劑量組tau-1蛋白在位點Ser199、Ser202及Ser422上磷酸化水平及Aβ前體APP水平顯著下降(P<0.05),tau-1蛋白在位點Ser199、Ser202及Ser422上磷酸化水平顯著升高(P<0.05)。而GSK-3β是Wnt途徑的一個重要的負調控因子,它通過對β連環蛋白和APC 2個蛋白磷酸化而發揮作用。糖原合成酶激酶3β與tau蛋白的過度磷酸化及AD患者的記憶損害有關。本資料中模型組大鼠海馬組織中GSK-3β陽性表達IOD值顯著升高(P<0.05);與模型組比較,TMP高劑量組、TMP低劑量組GSK-3β陽性表達IOD值顯著降低(P<0.05)。AD模型組大鼠大腦β-catenin水平顯著下降,采用川芎嗪高劑量、低劑量干預后,β-catenin水平均呈顯著上升。結果說明,在患AD時,Wnt信號通路下調,經川芎嗪干預后,Wnt途徑活性會升高。表明tau蛋白過度磷酸化及β-catenin水平上升是導致AD發生的主要機制,而TMP可抑制GSK-3β陽性表達,導致β-catenin降解減少,從而抑制tau蛋白過度磷酸化,發揮神經細胞保護作用。
綜上所述,TMP通過對AD大鼠海馬組織GSK-3β陽性表達的抑制導致β-catenin降解減少,從而抑制tau蛋白過度磷酸化,并可激活Wnt信號通路抑制Aβ蛋白引起神經毒性,從而發揮神經細胞保護作用。
1 劉曉杰,楊威,祁金順.氧化應激與阿爾茨海默病.生理學報,2012,64(1): 87~95.
2 王勇,馬武華,鄭俊奕,等.川芎嗪預先給藥對缺氧損傷胎鼠海馬神經元凋亡的影響.新中醫,2012,44(2):108~111.
3 劉長安,朱潔.川芎嗪通過抑制RAGE-ERK1/2-p38-NFKB信號通路及活性氧生成改善阿爾茨海默病大鼠腦組織炎性.中國藥學雜志,2014,49(13):1126~1132.
4 楊雁,張曉潔,王玉萍,等.噻唑烷二酮通過Wnt路改善2型糖尿病大鼠海馬阿爾茨海默病樣病變.中國病理生理雜志,2010,26(12):2421~2427.
5 肖若芝,陳琰,王立琳,等.索拉非尼通過抑制WNT信號通路誘導白血病細胞株U937凋亡.中國實驗血液學雜志,2011,19(2):353~357.
6 王薇,張海廷,王淑輝,等.阿爾茨海默病與Wnt信號通路及神經干細胞的關系.中國組織工程研究,2013,17(19): 3567~3571.
7 Alves DSM, Smidt MP. En1 and Wnt signaling in midbrain dopaminergic neuronal development. Neural Dev, 2011,6:23.
8 Shruster A, Eldar-Finkelman H, Melamed E, et al. Wnt signaling pathway overcomes the disruption of neuronal differentiation of neural progenitor cells induced by oligomeric amyloid beta-peptide. J Neurochem,2011,116(4):522~529.
9 Querfurth HW, Laferla FM. Alzheimer's disease. N Engl J Med,2010,362(4):329~344.
10 Shruster A, Eldar-Finkelman H, Melamed E, et al. Wnt signaling pathway overcomes the disruption of neuronal differentiation of neural progenitor cells induced by oligomeric amyloid beta-peptide. J Neurochem, 2011,116(4):522~529.
11 Roberson ED, Scearce-Levie K, Palop JJ, et al. Reducing endogenous tau ameliorates amyloid beta-induced deficits in an Alzheimer's disease mouse model. Science,2007,316(5825): 750~754.
Objective To investigate the effect of Ligustrazine on whether the activation of Wnt signal pathway of Alzheimer's disease(AD)rat brain infl ammatory tissue,and to explore its action mechanism. Methods Using the beta amyloid peptide 25-35(A 25-35)of model rats with Alzheimer disease made bilateral hippocampal injection,observe the effects of Ligustrazine on tau protein in hippocampus of AD rats on the part of the phosphorylation site and amyloid beta(A beta)effects of APP precursor levels in the Wnt pathway,beta catenin(Beta -catenin)and glycogen synthase kinase 3 beta(GSK-3 beta)level,at the same time,use immune group to determination of 4 groups of AD rats hippocampal A deposition of the degree of technology. Results This study showed that the model of unilateral cerebral cortex in rats of A group were obviously visible beta,intercellular space mirror under brown change. And the intervention of Ligustrazine,brown component is gradually reduced,ligustrazine can inhibit A deposition,significantly inhibited the phosphorylation of tau,inhibiting the activity of GSK-3,reduce the beta -catenin degradation. Conclusion TMP reduces the beta -catenin degradation,thus preventing tau protein phosphorylation through the inhibition of hippocampus GSK-3 expressionin AD rat ,and can activate Wnt pathway to inhibit the A beta protein induced neurotoxicity,which playsa role in nerve cell protection.
Alzheimer's disease Ligustrazine Wnt signaling pa thway Tau protein Beta catenin
十堰市科學技術研究與開發項目(14K68)
442000湖北省十堰市太和醫院老年病房

