前列腺MR動態(tài)增強掃描感興趣區(qū)的選擇方法的探討
高 靳,周 瀚,歐陽宇,劉 洪,代茂良,吳筱蕓
(1.重慶醫(yī)科大學附屬成都第二臨床學院暨成都市第三人民醫(yī)院放射科,四川 成都 610031;2.四川省人民醫(yī)院放射科,四川 成都 610072)
前列腺MR動態(tài)增強掃描感興趣區(qū)的選擇方法的探討
高靳1,周瀚1,歐陽宇1,劉洪1,代茂良1,吳筱蕓2
(1.重慶醫(yī)科大學附屬成都第二臨床學院暨成都市第三人民醫(yī)院放射科,四川 成都610031;2.四川省人民醫(yī)院放射科,四川 成都610072)
目的:探討感興趣區(qū)(ROI)不同對MR動態(tài)增強掃描(DCE-MRI)時間-信號強度曲線(TIC)的影響及價值。材料與方法:99例病人均行前列腺動態(tài)增強掃描,共118個前列腺周圍帶病灶,其中良性病變63個,前列腺癌55個。在動態(tài)增強掃描圖像上,分別獲取病灶中心層面1個大ROI(20~150 mm2)及分散在病灶內13個小ROI(6.6 mm2)的TIC,比較大、小ROI的TIC在良惡性前列腺病灶中的差異。采用兩種方案分類病灶TIC類型并分別進行DCE-MRI的PI-RADS評分:方案1:病灶曲線類型為大ROI曲線類型;方案2:病灶小ROI中有3型曲線者,病灶曲線類型歸為3型,沒有者歸為大ROI曲線類型。結果:病灶中,具有大ROI曲線類型的小ROI數的中位數,良性病變12,前列腺癌10,中位數檢驗P=0.003。兩種方案診斷前列腺癌,方案1敏感性76.36%,特異性90.48%,方案2敏感性87.27%,特異性85.71%,敏感性比較P=0.031,特異性比較P=0.250。結論:前列腺癌灶各處強化方式多不完全一致,采用小ROI尋找3型曲線區(qū)域,有助于周圍帶前列腺癌的診斷。
前列腺腫瘤;前列腺增生;磁共振成像
1 資料與方法
1.1一般資料
前瞻性研究我院2013年12月—2014年8月前列腺疾病患者,所有患者行MR檢查前均簽署知情同意書。納入所有符合以下標準者:①檢查前未進行過穿刺(間隔6周以上)和相關治療;②均行高分辨T2WI、DWI及DCE-MRI,MR圖像上述任一序列前列腺周圍帶有異常信號;③患者PSA>4 μg/L;④MRI檢查后2周內行經直腸超聲引導下前列腺穿刺活檢。先穿刺MRI圖像上周圍帶異常信號區(qū)域,再采用8點穿刺法穿刺其余前列腺,共10~13針。由操作醫(yī)師記錄活檢位置,病理醫(yī)師觀察報告。共收集99例118個周圍帶病灶,其中前列腺癌 55個病灶,前列腺增生56個病灶,前列腺增生伴前列腺炎7個病灶。年齡55~94歲,平均(72.5±8.6)歲,Gleason評分7~10分,前列腺特異性抗原水平6.63~>5 000 ng/mL。
1.2MR檢查方法
采用 GE signa EXCITE 1.5T Echospeed MR成像儀,接收線圈為腹部相控陣線圈,進行包括軸位、冠狀位、矢狀位T1WI、T2WI、DWI及增強掃描。其中包括以下序列:①軸位高分辨T2WI檢查:前列腺局部軸位FSE T2WI,TR 3 675 ms,TE 130 ms,層厚4 mm,間距1 mm,激勵次數為2次,回波鏈長度17,FOV 18 cm×18 cm,矩陣224×320。②軸位DWI:采用平面回波成像(EPI)序列,b值為0、800 s/mm2,TR 1 475.0 ms,TE 63.4 ms,層厚7 mm,間距1 mm,激勵次數16次,FOV 38 cm×38 cm,矩陣128×192,并生成ADC圖,掃描時間1 min 35 s。③DCE-MRI:采用LAVA序列,TR 3.01 ms,TE 0.88 ms,層厚3.8 mm,無間距掃描,激勵次數1次,FOV 38 cm×38 cm,矩陣256×256。掃描開始同時用高壓注射器以2mL/s的流率經靜脈團注對比劑Gd-DTPA,劑量0.2 mmol/kg,對比劑注入后注入20mL生理鹽水。掃描時間4~5min。
1.3圖像分析
通過GE ADW 4.3工作站進行數據處理。由兩名從事腹部影像15年以上的診斷醫(yī)師分別評判圖像,意見不一時經協商取得一致意見。在DCE-MRI早期強化時相選擇ROI,避開周圍帶與中央腺體交界處、前列腺與直腸相鄰處;避開尿道、射精管、精囊根部、出血、囊變及鈣化灶,每個病灶獲取1個大ROI(lROI)及13個小ROI(sROI),并得到相應的TIC,lROI(20~150 mm2)在病灶中心層面獲取,包括盡可能多的病灶組織。sROI(6.6 mm2)在下列3個層面獲取:①病灶中心層面:前、左、后、右及中央區(qū)域各一個。②約病灶上1/3及下1/3層面各獲取以下4個ROI:前、左后、右后及中央區(qū)域(圖1)。
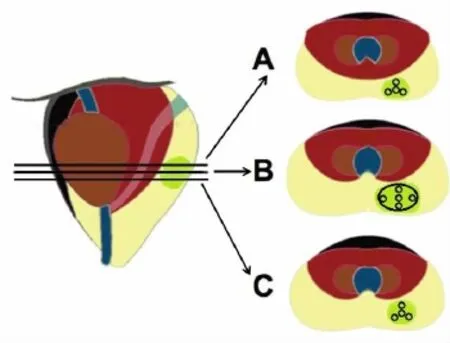
圖1 前列腺病變ROI選擇方法示意圖。在病灶(綠色區(qū)域)中心層面(圖B)、約病灶上、下1/3層面(圖A、圖C)共獲取13個sROI(黑邊小圓),在病灶中心層面(圖B)獲取1個lROI(黑邊大橢圓)。Figure 1. Schematic diagram of ROI selection in prostate lesions.13 sROIs(small circle with black border)were obtained in the central layer of the focus(green)(Figure B),1/3 of upward and downward layer(Figure A,Figure C).1 lROI(big ellipse with black border)was obtained in the central layer of the focus(Figure B).
DCE-MRI ROI的TIC曲線類型判斷標準:病灶漸進性強化為1型(流入型);快速到峰值后形成平臺為2型(平臺型);快速到峰值后呈流出表現為3型(流出型)[2-4]。
病灶曲線類型的判斷,分為兩種方案:①方案1:以lROI代表整個病灶曲線類型。②方案2:病灶13個sROI中出現3型曲線者,病灶曲線類型歸為3型,其余病灶仍以lROI曲線類型代表。
DCE-MRI的PI-RADS評分標準:1分:1型曲線;2分:2型曲線;3分:3型曲線。+1分:2、3型曲線的局限性強化灶;+1分:2、3型曲線的非對稱病變,或病變位于非好發(fā)部位[1]。
“不憤不啟,不悱不發(fā),舉一偶而不以三偶反,則不復也.”由此可見通過問題可以引導學生進行思考,啟發(fā)學生的思維,符合學生認知難度,具有趣味情境或真實情境的開放性問題是學生小組合作學習效果的關鍵.太容易的問題學生稍微思考就能得到答案,合作的意義不明顯,太難的問題學生各種嘗試都無果,打擊學生的積極性,只有具有挑戰(zhàn)性、難度適中、答案開放的問題才能更有效的集中學生的注意力,提高學生的參與度,讓學生獲得成功的體驗.
分別合計每個病灶lROI曲線類型的sROI數目。上述兩種方案分別進行DCE-MRI的PI-RADS評分。對照病理結果把病灶分為前列腺癌、良性病變兩組。
1.4統計學方法
采用SPSS 21軟件,用箱圖比較良惡性病變中l(wèi)ROI曲線類型的sROI數,進行中位數顯著性檢驗。方案1和方案2的PI-RADS評分與病理結果對照做受試者工作特征曲線(ROC)分析,檢驗方向為較大的檢驗結果表示更明確的檢驗。采用McNemar檢驗比較兩種方案診斷的敏感性、特異性。P<0.05為差異有統計學意義。
2 結果
31個病灶sROI完全相同,87個病灶sROI曲線不完全相同,lROI曲線類型的sROI數,良性病變5~13,中位數12,前列腺癌4~13,中位數10(圖2),獨立樣本中位數檢驗,二者有顯著性差異(P= 0.003)。
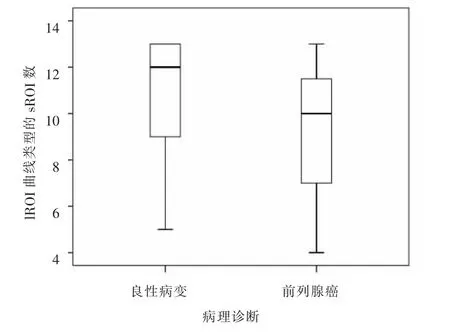
圖2 良惡性病變lROI曲線類型的sROI數箱圖。前列腺癌lROI曲線類型的sROI數明顯低于良性病變。Figure 2.sROI number boxplots with lROI curve type in benign and malignant lesions.The number of sROI with lROI curve type in prostate cancer is obviously lower than that in benign lesions.
兩種方案歸類病灶TIC曲線類型并與病理比較結果見表1。與方案1比較,方案2中26個病灶曲線類型發(fā)生改變。4個方案1呈1型曲線病灶,方案2歸為3型,其中1個為良性病變,3個為前列腺癌。22個方案1呈2型曲線的病灶,方案2歸為3型,其中5個良性病變,17個前列腺癌。
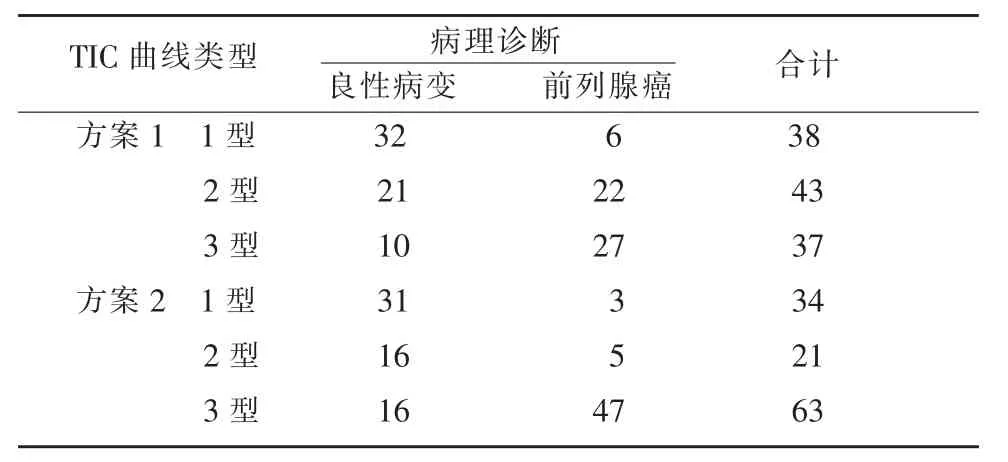
表1 2種方案分類病灶TIC曲線
兩種方案DCE-MRI的PI-RADS評分(圖3~5)診斷前列腺癌ROC曲線比較,方案1、方案2曲線下面積分別為0.894、0.941,方案2曲線下面積大于方案1(圖6)。以4分為診斷臨界值,方案1敏感性76.36%,特異性90.48%,方案2敏感性87.27%,特異性85.71%。敏感性比較兩種方案差異有統計學意義(P=0.031),特異性比較差異無統計學意義(P= 0.250)。

圖3 77歲前列腺癌患者T2WI圖像。箭示前列腺左側周圍帶低信號病灶。 圖4 同一病灶DCE-MRI圖像ROI選擇。對應T2WI低信號病灶,lROI(橢圓1)中包括兩個不同部位sROI(圓2,3)。 圖5 圖4ROI的TIC曲線。lROI曲線(曲線1)呈2型,兩個sROI曲線(曲線2,3)分別為3型、2型,病灶曲線類型:方案1歸為2型,方案2歸為3型。PI-RADS評分:方案1,2+1(局限性病變)+1(非對稱病變)=4;方案2,3+1+1=5。Figure 3. T2WI image of a prostate cancer patient who is 77 years old.The arrow shows the low signal focus in left prostate peripheral zone. Figure 4. ROI selection in DCE-MRI image of the same focus.The two different parts of sROI(circle 2 and 3)are chosen in lROI (ellipse 1)corresponding to T2WI low signal focus. Figure 5. TIC curve of Figure 4 ROI.lROI curve(curve 1)is type 2.Two sROI curves(curve 2 and 3)are type 3 and type 2 respectively.The type of focus curve:type 2 according to Protocol 1,type 3 according to Protocol 2. PI-RADS score:according to Protocol 1,2+1(focal enhancing lesion)+1(asymmetric lesion)=4;according to Protocol 2,3+1+1=5.
3 討論
良惡性前列腺病變中不同ROI的比較:DCEMRI圖像上為得到病灶TIC曲線類型而選取的ROI,文獻中采用的方法多種多樣,多采用在病灶中心層面的早期強化區(qū)域,以9~50 mm2圓形的ROI或按照病灶的形狀手動將其勾畫出,并進行一次性采集[4-8]。然而,本組結果顯示,不同的ROI得到的TIC曲線并不都完全一致。采用較大的ROI多不能代表病灶全部區(qū)域的曲線類型,采用較小的ROI在病灶的不同區(qū)域得到的曲線,多存在差異,單次測量結果有一定的隨機性。良性病變各處TIC曲線更趨于lROI類型,顯示病灶各處強化方示更均勻;而前列腺癌灶內有更多區(qū)域與lROI曲線不同,其強化方式更不均勻,反應出前列腺癌血流動力學改變的不均勻性。其原因可能在于:①腫瘤的微血管分布不均勻及結構不一致,而周圍帶的良性病變多趨向均勻一致的分布。雖然前列腺癌很多時候有2種甚至3種級別(生長方式)[9],這種強化模式不均勻是否能反應瘤灶中不同級別的腫瘤共存,還有待探討。目前,腫瘤強化模式所反應的微血管狀態(tài)是否與病理分級相關仍存爭議,有學者[3,10]認為有相關性,3型曲線反應高級別的腫瘤,低級別的腫瘤可以表現為2型曲線的強化方式;也有學者[2]認為腫瘤強化方式和Gleason評分并沒有相關性。②腫瘤可能會在正常組織中稀疏分散的生長[11],而導致病灶區(qū)域組織結構的多樣性。

圖6 兩種方案診斷前列腺癌ROC曲線。方案2曲線下面積大于方案1。Figure 6. ROC curves in diagnosing prostate cancer with two protocols.The area under the curve of protocol 2 is larger than that of Protocol 1.
兩種方案的比較:由于前列腺癌強化方式的不均勻性,病灶中少數TIC呈3型曲線的區(qū)域,推測可能是腫瘤組織的特征,卻可能被lROI平均化或被單次sROI取材遺漏而未能顯示。據此,本組采用方案2重新歸類病灶曲線,把sROI中只要出現3型曲線者病灶曲線類型即歸為3型,以此進行DCE-MRI的PI-RADS評分,得到的ROC曲線下面積增大,顯示了方案2更高的診斷價值,也證實了上述推測。普遍認為DCE-MRI敏感性低[11],采用方案2能在特異性無明顯下降的情況下,提高周圍帶前列腺癌診斷的敏感性,本組從76.36%提高到了87.27%。
本組局限性:由于本組的病理結果都是通過穿刺活檢獲得,而經直腸超聲引導下的活檢容易漏診前部/移行帶的病灶[3,12],為保證更可靠的金標準,未把中央腺體納入本組研究。其次,本組沒有Gleason≤6的腫瘤,為避免穿刺的過度使用,也未納入PI-RADS=3及PSA<4 μg/L的患者。本組結果可能會有一些偏倚。另外,為避免混雜因素的干擾,本組也未進行T2WI+DWI+CE-MRI的綜合評分。在CEMRI,不管是采用方案1還是方案2,呈流出型曲線的病灶,有少數是良性的[10,13-14]。前列腺癌的MRI診斷,結合其它指標作綜合判斷是必要的。
總之,由于腫瘤組織強化方式的不均勻性,在病灶中找出TIC呈3型曲線的區(qū)域,有助于提高DCE-MRI對周圍帶前列腺癌的診斷能力。
[1]Barentsz JO,Richenberg J,Clements R,et al.ESUR prostate MR guidelines 2012[J].Eur Radiol,2012,22(4):746-757.
[2]Rosenkrantz AB,Sabach A,Babb JS,et al.Prostate cancer:comparison of dynamic contrast-enhanced MRI techniques for localization of peripheral zone tumor[J].AJR,2013,201(3):471-478.
[3]Thompson J,Lawrentschuk N,Frydenberg M,et al.The role of magnetic resonance imaging in the diagnosis and management of prostate cancer[J].BJU Int,2013,112(2):6-20.
[4]Durmus T,Vollnberg B,Schwenke C,et al.Dynamic contrast enhanced MRI of the prostate:comparison of gadobutrol and Gd-DTPA[J].Rofo,2013,185(9):862-868.
[5]程悅,季倩,張怡,等.磁共振動態(tài)增強定量分析對前列腺疾病的診斷價值[J].中華老年醫(yī)學雜志,2014,33(1):55-58.
[6]李鵬,楊文君,陳志強,等.前列腺癌動態(tài)對比增強MRI與擴散加權成像的相關性[J].中國醫(yī)學影像技術,2013,29(2):264-268.
[7]Roy C,Foudi F,Charton J,et al.Comparative sensitivities of functional MRI sequences in detection of local recurrence of prostate carcinoma after radical prostatectomy or external-beam radiotherapy[J].AJR,2013,200(4):361-368.
[8]沈鈞康,趙文露,楊毅,等.1.5T MR功能成像序列聯合T2WI對前列腺癌篩查的臨床價值[J].中華放射學雜志,2014,48(1):38-42.
[9]曹登峰.前列腺腺癌Gleason評分及其應用[J].中華病理學雜志,2014,43(3):145-148.
[10]Verma S,Turkbey B,Muradyan N,et al.Overview of dynamic contrast-enhanced MRI in prostate cancer diagnosis and management[J].AJR,2012,198(6):1277-1288.
[11]Hoeks CM,Barentsz JO,Hambrock T,et al.Prostate cancer:multiparametric MR imaging for detection,localization,and staging[J].Radiology,2011,261(1):46-66.
[12]Shukla-Dave A,Hricak H.Role of MRI in prostate cancer detection[J].NMR Biomed,2014,27(5):16-24.
[13]Rischke HC,Nestle U,Fechter T,et al.3 Tesla multiparametric MRI for GTV-definition of Dominant Intraprostatic Lesions in patients with Prostate Cancer—an interobserver variability study[J].Radiat Oncol,2013,22(8):183.
[14]程悅,張曉東,季倩,等.黃色肉芽腫性前列腺炎的MRI特征分析[J].中華泌尿外科雜志,2014,35(5):399-400.
Discussion on method selection of region of interest during prostate dynamic contrast-enhanced MR imaging
GAO Jin1,ZHOU Han1,OUYANG Yu1,LIU Hong1,DAI Mao-liang1,WU Xiao-yun2
(1.Department of Radiology,the Second Affiliated Clinical College of Chengdu of Chongqing Medical University and the Third People's Hospital of Chengdu,Chengdu 610031,China;2.Department of Radiology,Sichuan Provincial People's Hospital,Chengdu 610072,China)
Objective:To discuss the influence of different regions of interest(ROI)on the time-intensity curve(TIC)and its value during dynamic contrast-enhanced MRI(DCE-MRI).Method:Prostate DCE-MRI was performed on all the 99 patients.There were 118 lesions in the peripheral zone,including 55 benign lesions and 63 prostate cancers.On dynamic contrast-enhanced MRI,the TIC of a large ROI(20~150 mm2)on the central layers of the foci and 13 small ROIs(6.6 mm2)scattering inside the foci were obtained.The difference between the TICs of the large and small ROIs in the benign and malignant prostate foci was compared.Two protocols were adopted to classify the TIC of the foci,and then PI-RADS score to DCE-MRI was carried out respectively.Protocol 1:The type of curve was big ROI curve.Protocol 2:The type of curve was type 3 curve if there was such a curve in any small ROI.Otherwise,it was regarded as a large ROI curve.Result:The median number of small ROIs with the type of big ROI curve in the foci was 12 for the benign lesions and 10 for the prostate cancer.The median test result was P=0.003.For diagnosis of prostate cancer,the sensibility and specificity of Protocol 1 were 76.36%and 90.48%,while the sensibility and specificity of Protocol 2 were 87.27%and 85.71%(P=0.031 and P=0.250 respectively).Conclusion:Enhancement at different ROIs of the foci of prostate cancer did not go all the same way.It is helpful for the diagnosis of prostate cancer in the peripheral zone to adopt small ROIs to seek type 3 curve.
Prostatic neoplasms;Prostatic hyperplasis;Magnetic resonance imaging
R737.25;R697.3;R445.2
A
1008-1062(2015)05-0345-04
2014-10-31;
2014-12-09
高靳(1970-),男,四川德陽人,副主任醫(yī)師。

