乳腺癌不同病灶大小、病理類型及組織學分級的超聲造影差異
冷曉玲,黃國福,馬富成
(1.新疆醫科大學附屬腫瘤醫院超聲科,新疆 烏魯木齊 830011;2.新疆醫科大學第五附屬醫院放化療科,新疆 烏魯木齊 830011)
乳腺癌是女性最常見的惡性腫瘤之一[1],早發現、早診斷、早治療是乳腺癌防治的關鍵[2]。有學者認為,乳腺癌組織的病理改變是由癌細胞基因及其生物學行為特性調控的,而這一改變可以通過超聲檢查呈現出來[3]。超聲造影是超聲醫學領域最前沿的技術之一,應用超聲造影診斷乳腺癌已成為當前研究熱點[4],其能為超聲BI-RADS分級提供更豐富的診斷信息[5]。本研究通過探討不同病灶大小、病理類型及組織學分級的乳腺癌超聲造影特點是否有差異,以提高超聲造影對乳腺癌精確診斷的臨床應用價值,為乳腺癌腫瘤生物學行為的評估提供可靠的方法,為乳腺癌的早期診斷、早期治療提供更多有價值的信息。
1 資料與方法
1.1 臨床資料
2013年7月—2014年3月在本院經知情同意行超聲造影檢查并行手術切除的乳腺癌患者113例共119個病灶,均為女性,年齡29~75歲,平均(48.7±3.5)歲,乳腺腫塊平均直徑(2.9±1.2) cm,患者術前均未接受內分泌治療或化療。腫塊最大直徑≤20 mm 的病灶共 47個,年齡(41.4±5.9)歲。腫塊最大直徑>20mm的病灶共72個,年齡平均(50.3±8.9)歲。
1.2 儀器與方法
采用Philips iU22超聲診斷儀,L9-3寬頻線陣探頭,脈沖反相諧波造影條件,機械指數為0.07。超聲造影劑為SonoVue,用5 mL生理鹽水稀釋,振蕩后備用。囑患者平臥,暴露胸部。使用高頻L9-3寬頻線陣探頭,分別對雙側乳房及腋窩進行掃查,對可疑病灶進行雙側對比,采集灰階、彩色多普勒及頻譜多普勒圖像,并選擇ROI進行超聲造影檢查,通過肘正中靜脈彈丸式注射造影劑4.8mL,接著推注5mL生理鹽水,同步存儲3 min的連續動態圖像。
1.3 結果判定標準
記錄乳腺癌原發病灶的位置、大小。分析存儲在硬盤的動態造影影像,評估病變區域的超聲造影增強特點及模式,包括增強范圍是否大于二維超聲顯示、增強強度、造影劑分布情況、造影劑進入腫瘤順序、造影模式、是否有穿支血管、是否有灌注缺損等指標。以上評估由2位經驗豐富的醫師完成。
腫瘤組織學分級(采用Bloom Richardson標準[6]進行分級):0級,原位癌。Ⅰ級,腺管量(腺管形成占整個腫瘤比例)≥75%,核小而規則,每高倍視野核分裂象(×40)≤5。 Ⅱ級,腺管量 10%~<75%,核大但也較規則,每高倍視野核分裂象(×40)>5~10。Ⅲ級:腺管量<10%,核大而不規則,核仁明顯,每高倍視野核分裂象(×40)>10。
1.4 統計學方法
采用SPSS 17.0統計分析軟件,計數資料組間比較采用卡方檢驗 (T<1或1,T<5的格子數超過格子總數的1/5時,采用Fisher確切概率法),P<0.05為差異有統計學意義。
2 結果
2.1 超聲造影表現、病理結果及組織學分級
超聲造影顯示119個腫塊,增強范圍大于二維超聲91個,等于二維超聲28個;增強強度呈無增強、低增強、等增強30個,呈高增強89個;造影劑呈均勻分布31個,不均勻增強70個,周邊增強18個;造影劑進入腫瘤順序為向心性81個,離心性4個,整體性34個;造影模式呈速升速降69個,速升緩降25個,緩升速降1個,緩升緩降23個;有灌注缺損37個,無灌注缺損82個;無穿支血管42個,有穿支血管77個。119個腫塊的病理類型為浸潤性導管癌96個,浸潤性小葉癌13個,導管內原位癌10個。119個腫塊的組織學類型為0級5個,Ⅰ級10個,Ⅱ級71個,Ⅲ級33個。
2.2 不同大小乳腺癌的超聲造影表現
本研究對乳腺癌腫塊不同大小各組間超聲造影結果分別進行了增強模式分析(表1)。結果提示,不同大小的乳腺癌的超聲造影增強范圍、造影劑分布、造影劑進入腫瘤的順序、造影模式的差異無統計學意義(P>0.05),而增強強度、是否有灌注缺損、是否有穿支血管在組間的差異有統計學意義 (P<0.05)。≤2 cm的乳腺癌更傾向于低增強或等增強,無灌注缺損及穿支血管;>2 cm的乳腺癌傾向于高增強,存在灌注缺損及穿支血管。
2.3 不同病理類型乳腺癌的超聲造影結果
本研究對乳腺癌腫塊不同病理類型各組間超聲造影結果分別進行了增強模式分析 (表2)。結果提示,不同病理類型的乳腺癌的造影劑分布、造影劑進入腫瘤的順序、造影模式、增強強度、是否有灌注缺損、是否有穿支血管的差異無統計學意義(P>0.05),而超聲造影增強范圍在組間的差異有統計學意義(P<0.05)。浸潤性導管癌出現造影后增強范圍大于二維超聲顯示的范圍的比率高于浸潤性小葉癌及導管原位癌(P<0.05)。而不同組織學分級的乳腺癌均傾向于高增強、造影劑不均勻分布、周邊增強、向心性增強、速升速降及速升緩降、無灌注缺損、有穿支血管(P>0.05)。
2.4 不同組織學分級乳腺癌的超聲造影結果
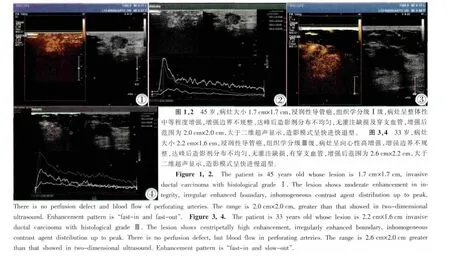
本研究對乳腺癌腫塊不同組織學分級各組間超聲造影結果分別進行了增強模式分析(表3)。結果提示,不同組織學分級的乳腺癌的超聲造影增強范圍、造影劑進入腫瘤的順序、是否有灌注缺損、是否有穿支血管的差異無統計學意義(P>0.05),而增強強度、造影劑分布、造影模式在組間的差異有統計學意義(P<0.05)。乳腺癌組織學分級Ⅲ級腫塊出現造影后高增強、周邊增強、速升緩降的比率高于組織學Ⅰ、Ⅱ級腫塊,三者之間差異有統計學意義(P<0.05)(圖1~4)。而不同組織學分級的乳腺癌均傾向于增強范圍大于二維超聲顯示、呈向心性增強、無灌注缺損、有穿支血管(P>0.05)。
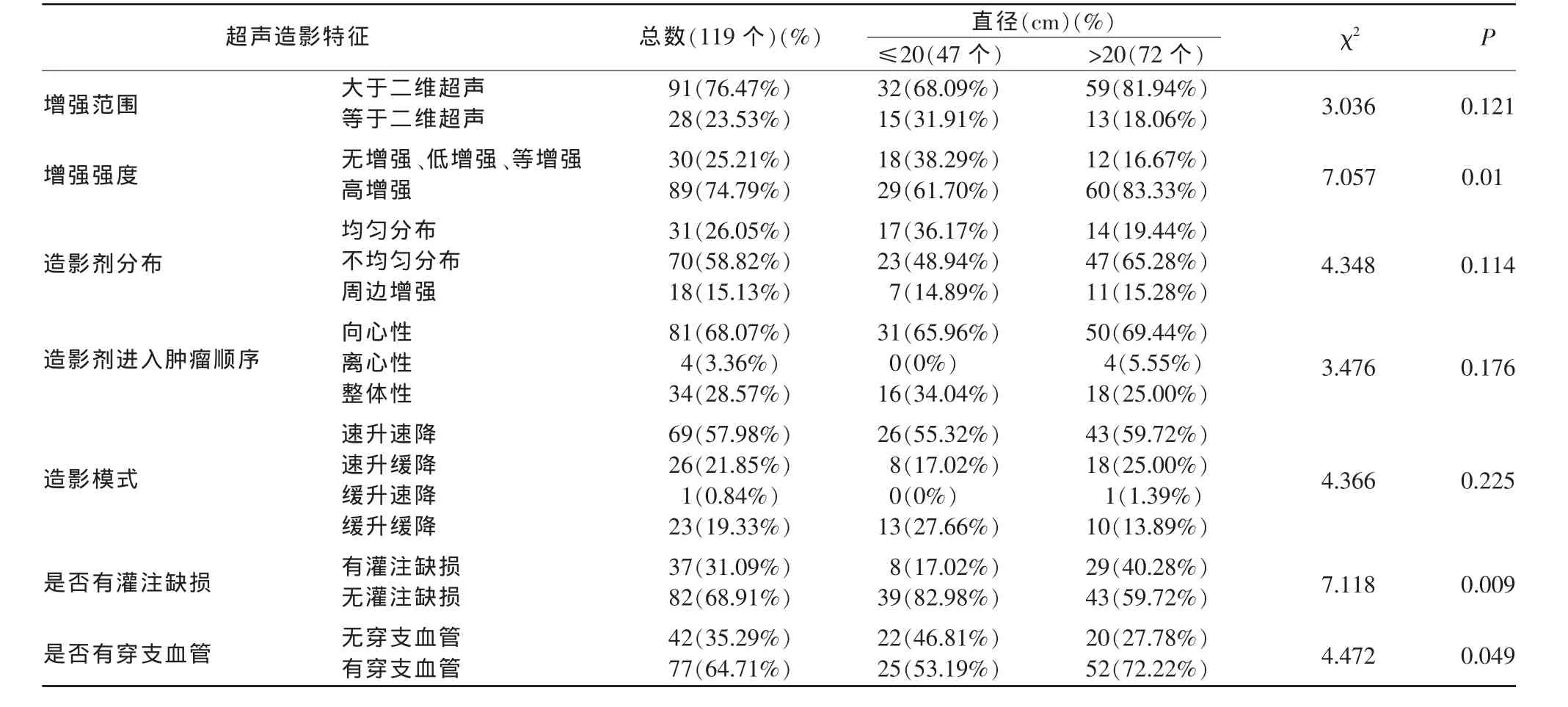
表1 不同大小的乳腺癌超聲造影特點的差異分析
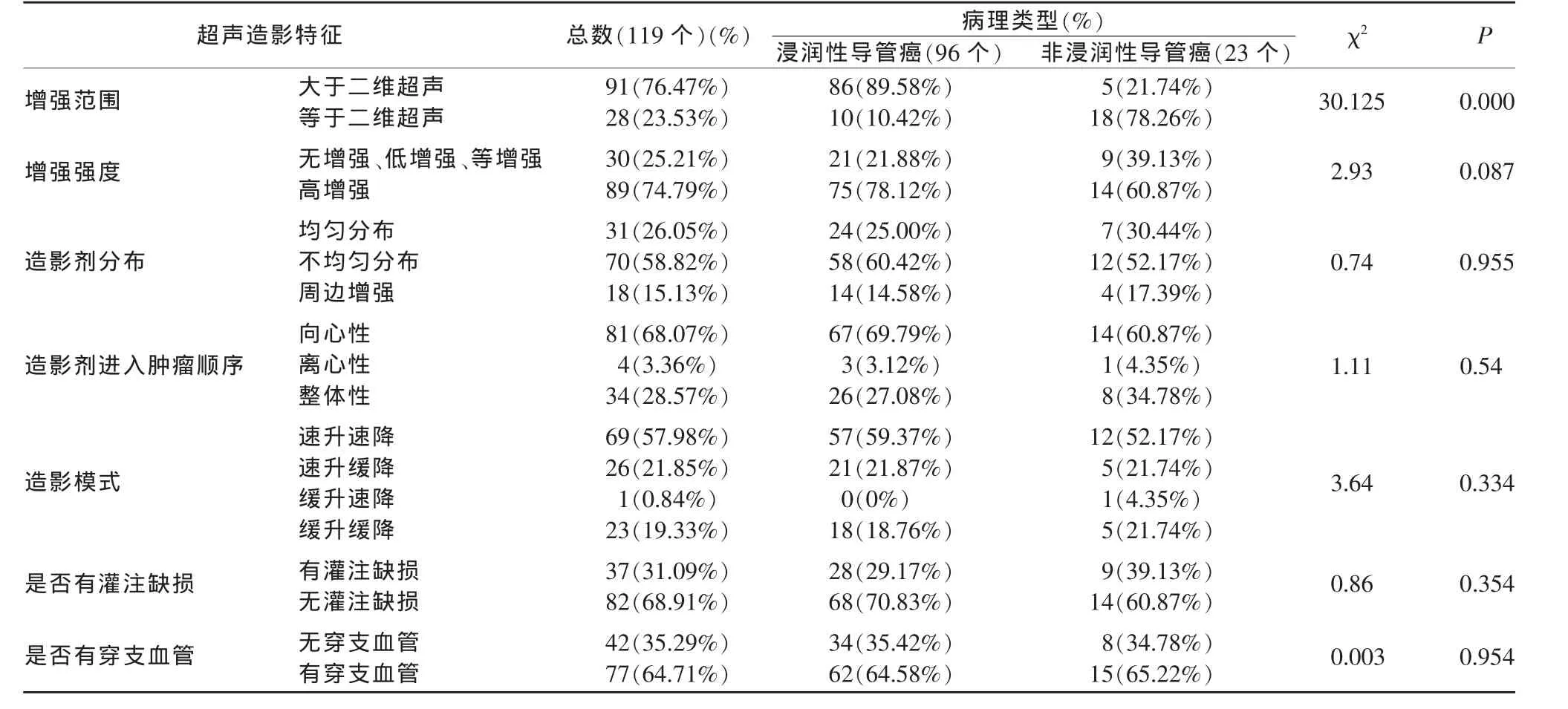
表2 不同病理類型的乳腺癌超聲造影特點的差異分析
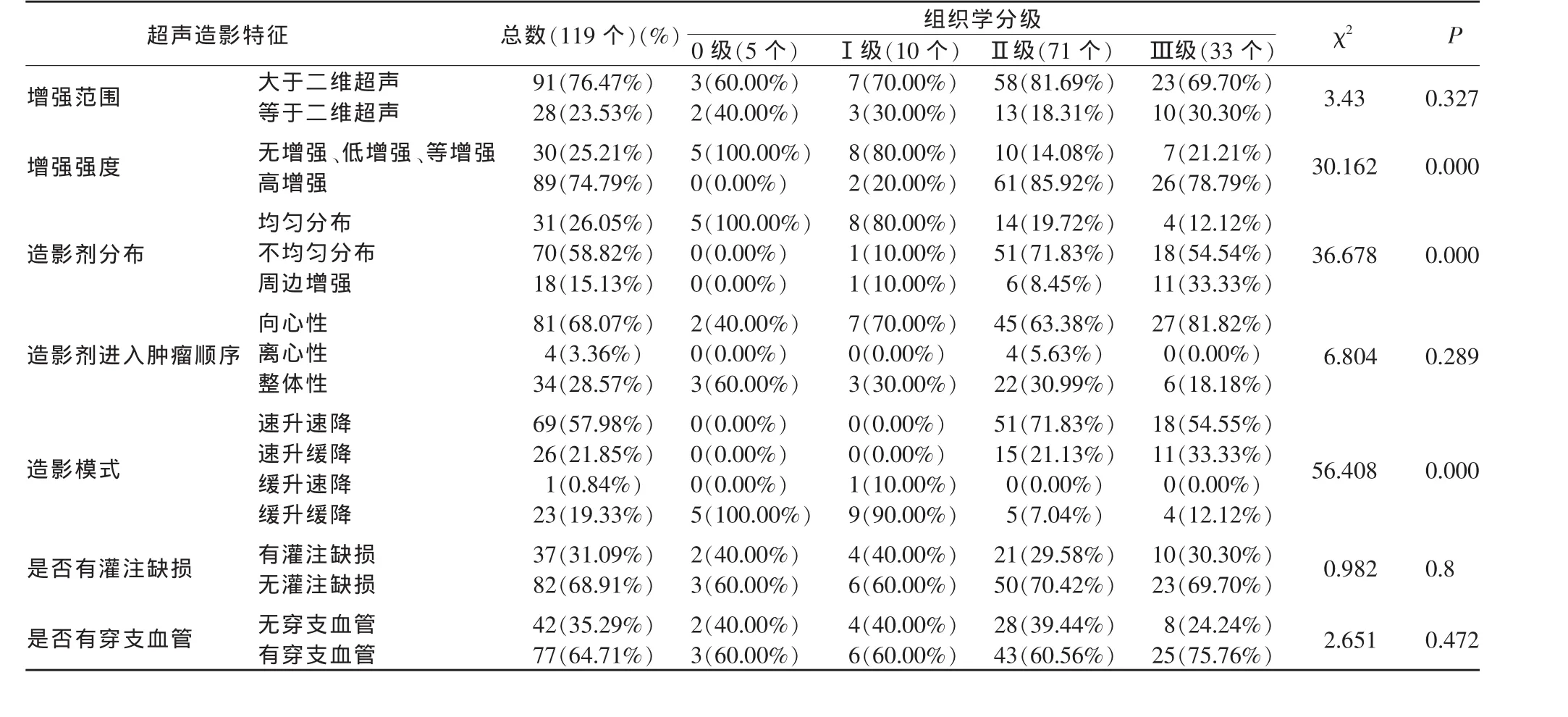
表3 不同組織學分級的乳腺癌超聲造影特點的差異分析
3 討論
3.1 超聲造影特征與病灶大小的關系
由研究得出,≤2 cm的病灶的灌注強度常表現為無增強、低增強及等增強,內部表現為無灌注缺損、無穿支血管,而>2 cm的病灶的灌注強度常表現為高增強,內部表現為有灌注缺損、有穿支血管。出現上述差異考慮主要與乳腺癌生長階段、血管特性及分布特點有關。腫瘤在生長過程中,當體積大于1 mm時,主要依靠血管生成獲得營養,即血管期,在新生血管形成后,腫瘤組織即獲得進一步生長的能力,隨著腫瘤體積增大,在血管生成因子等因素的作用下,血管生成也相應增加,以滿足其營養需要,腫瘤血管生成是無序和不可控制的,并多數形成穿入型血管[7-9]。本研究提示當乳腺癌腫瘤體積較大時,內部微血管多為不均勻分布,局部可見灌注缺損區,終末細小血管增多,分支紊亂,走行不規則,腫瘤周邊的微血管密度大于中心,非壞死、囊變區大于壞死、囊變區,這與腫瘤血管空間分布的不平衡具有一致性[10]。研究提示乳腺癌內腫瘤血管的生成是循序漸進的,隨著腫瘤體積的增大,血管異質性表現得更加顯著,也更傾向于不均勻性高灌注,同時伴有灌注缺損及穿支血管,但鑒別良惡性的主要征象——造影模式及增強范圍是否大于二維超聲顯示的范圍在乳腺癌的不同大小腫塊間具有一致性。
3.2 超聲造影特征與乳腺癌病理類型的關系
本研究中乳腺癌的病理類型大致分為浸潤性導管癌、浸潤性小葉癌及原位癌3種,浸潤性小葉癌及原位癌因數量較少在統計中歸為一類。結果發現,除增強范圍外,不同病理類型的乳腺癌超聲造影特征的差異并無統計學意義,以高增強、呈不均勻增強、向心性充填多見,灌注模式上以速升速降多見,無灌注缺損、有穿支血管多見。值得注意的是,浸潤性導管癌傾向于造影后增強范圍大于二維超聲顯示,而浸潤性小葉癌及原位癌則傾向于造影后增強范圍等于二維超聲顯示。從超聲結合病理來看,浸潤性導管癌常有邊界不清(包括毛刺、模糊、微小分葉、成角及高回聲暈等)的聲像圖表現,是由于癌細胞浸潤周圍正常腺體或纖維脂肪組織引起間質反應而致,病理上為腫塊周圍富含脂肪的組織層,伴隨有活性結締組織在瘤體周圍形成的瘤周間質反應帶[11]。而浸潤性小葉癌及原位癌間質反應不明顯,二維超聲表現為高回聲暈少見。間質反應情況是超聲造影后增強范圍是否大于二維超聲顯示范圍的關鍵,這可以解釋浸潤性小葉癌及原位癌并不傾向于造影后增強范圍增大。
3.3 超聲造影特征與乳腺癌組織學分級的關系
本研究發現超聲造影特征與腫瘤的病理類型幾乎無明顯關系,但與組織學分級有一定的關系。通過比較發現不同組織學分級的患者在增強范圍、造影劑進入腫瘤順序、是否有灌注缺損、是否有穿支血管方面的差異無統計學意義,但是在增強強度、造影模式及造影劑分布方面差異有統計學意義。組織學0級、Ⅰ級的患者中呈現“無/低/等增強、均勻增強、緩升緩降”血流灌注模式的比例要高于Ⅱ級、Ⅲ級的患者。從造影原理來看,因為超聲造影主要與腫瘤的血供有關,而腫瘤的病理分型主要與腫瘤實質細胞的類型有關[12]。組織學分級越高,血供越豐富,瘤內血管增殖越迅速,則乳腺癌的典型超聲造影表現也就更明顯[13],但是不同組織學分級之間腫瘤血管的生長模式和形態并沒有多大的差別,故在增強范圍、造影劑進入腫瘤順序、是否有灌注缺損、是否有穿支血管等方面,各組織學分級之間無明顯差異。
綜上所述,本研究結果從側面佐證了病灶大小和組織學分級對超聲造影特征的影響要強于腫瘤病理類型,乳腺癌超聲造影表現與腫瘤大小及組織學分級的變化密切相關,腫塊的超聲形態特點對組織學類型和分級有提示作用,腫塊的超聲造影特點對組織學分級有一定提示作用。
]
[1]Blask DE,Brainattl GC,Dauchy RT,et al.Decreased melatonin production linked to light exposure[J].Cancer Res,2005,65(23):11174-11184.
[2]鄭瑩,吳春曉,張敏璐.乳腺癌在中國的流行狀況和疾病特征[J].中國癌癥雜志,2013,(8):561-569.
[3]張毅,袁梅,周靜,等.三陰性乳腺癌的超聲征象與病理生物學特性的多因素分析 [J].中華臨床醫師雜志:電子版,2013,(14):6305-6312.
[4]曹秋月.乳腺癌超聲診斷的現狀和進展 [J].臨床超聲醫學雜志,2012,14(3):183-186.
[5]Zhao H,Xu R,Ouyang Q,et al.Contrast-enhanced ultrasound is helpful in the differentiation of malignant and benign breast lesions[J].Eur J Radiol,2010,73(2):288-293.
[6]Tavassoli FA,Devilee P.乳腺及女性生殖器官腫瘤病理學和遺傳學[M].程虹,譯.北京:人民衛生出版社,2006:2-3.
[7]Golbabapour S,Pang WW,George J,et al.Chemically induced breast tumors in rats are detectable in early stages by contrast enhanced magnetic resonance imaging but not by changes in the acute-phase reactants in serum[J].Int J Mol Sci,2011,12(2):1030-1040.
[8]Cichon MA,Degnim AC,Visscher DW,et al.Microenvironmental influences that drive progression from benign breast disease to invasive breast cancer[J].J Mammary Gland Biol Neoplasia,2010,15(4):389-397.
[9]王志剛.超聲分子影像學的研究進展 [J].中國醫學影像技術,2009,25(6):921-924.
[10]Barbareschi M,Gasparini G,Morelli L,et al.Novel methods for the determination of the angiogenic activity of human tumors[J].Breast Cancer Res Treat,1995,36(2):181-192.
[11]李靜,歐羅周,邵志敏.微環境中間質細胞通過趨化因子對乳腺癌生長和轉移的影響 [J].中國腫瘤生物治療雜志,2008,15(5):494-500.
[12]Brody JG,Kripke ML,Kavanaugh-Lynch MH,et al.Breast cancer and environmental research[J].Science,2014,344(6184):577.
[13]Wang X, Xu P, Wang Y, et al. Contrast-enhanced ultrasonographic findingsofdifferenthistopathologic typesof breast cancer[J].Acta Radiol,2011,52(3):248-255.

