胰島素抵抗對2型糖尿病患者周圍神經病變的影響
馬麗輝
河北邯鄲中心醫院 邯鄲 056001
流行病學文獻顯示[1],我國成年人糖尿病患病率近年來呈逐年增高趨勢,患病率高達9.6%左右。糖尿病周圍神經病變(DPN)是一種2型糖尿病(T2DM)最常見的微血管病變并發癥,胰島素抵抗作為2型糖尿病患者發病的中心環節,目前被認為與中樞性神經病變如阿爾茲海默癥等密切相關[2],但對胰島素抵抗程度與T2DM合并周圍神經病變發病關系的研究方面報道較少。本研究通過分析T2DM患者餐前及OGTT后血糖及胰島素的變化規律,探討胰島素抵抗對2型糖尿病患者周圍神經病變的影響。
1 資料與方法
1.1 研究對象 選取2012-06—2014-06我院收治的2型糖尿病患者161例為研究對象,男90例,女71例;平均年齡(54.3±6.1)歲;糖尿病病程(9.5±2.0)a。排除標準:嚴重的肝腎功能障礙,自身免疫系統疾病、腫瘤、長期吸煙史及并發下肢動脈硬化性狹窄或者閉塞患者;按照是否合并周圍神經病變將患者分為糖尿病周圍神經病變組(DPN組,n=102)和非糖尿病周圍神經病變組(NDPN組,n=59)。
1.2 診斷標準 (1)2型糖尿病診斷標準參照 WHO于1999年制定的糖尿病診斷標準,具體標準為:空腹血糖(FBG)≥7.0mmol/L,或糖耐量試驗(OGTT )2h血糖>11.1mmol/L或隨機血糖>11.1mmol/L,再依據病史、OGTT胰島素分泌曲線以及酮癥傾向判定T2DM;(2)DPN診斷依據周圍神經病變的癥狀及體征,通過肌電圖判斷周圍神經損害,同時排除非糖尿病因素造成的神經病變,如酗酒及藥物造成的神經毒性作用、頸腰椎病變、腦梗死等。
1.3 研究方法
1.3.1 一般資料收集:包括患者年齡、性別、血壓值、體質量、身高、臀圍及腰圍,計算患者體重指數(BMI)及腰臀比(WHR)。
1.3.2 實驗室檢測:所有入院的T2DM患者均接受口服糖耐量試驗(OGTT);尿酸、總膽固醇 (TC)、血甘油三酯(TG)、低密度脂蛋白膽固醇(LDL-C)、高密度脂蛋白膽固醇(HDL-C)、血糖由日本產日立7170型全自動生化分析儀測定;糖化血紅蛋白(HbAlc)應用PRIMUS公司生產的高壓液相測定儀測定;血清C肽及胰島素(IRI)由化學發光法測定。計算糖暴露指數(GEI)=(HbAlc)1/2×糖尿病病程;應用穩態模型姨島素抵抗指數(HOMA-IR)表示患者空腹時胰島素敏感性:HOMA-IR=空腹血糖×空腹胰島素/22.5。應用Matsuda指數表示糖負荷后胰島素敏感性。肌電圖檢查采用NDI-092肌電圖儀(上海海神公司),周圍神經損害判定標準為神經傳導速度下降≥20%。
1.4 統計學方法 應用SPSS 17.0統計軟件進行分析,計量資料以ˉx±s表示,采用成組t檢驗處理;計數資料以率或構成比表示,采用χ2檢驗;糖尿病周圍神經病變相關因素分析采用二分類非條件Logistic回歸模型進行分析,P<0.05為差異有統計學意義。
2 結果
2.1 2組一般資料比較 DPN組年齡、糖尿病病程、HbA1c、LDL-C水平高于NDPN組,差異有統計學意義(P<0.05)。見表1。
2.2 2組OGTT結果比較 DPN組 Matsuda指數、HOMA-IR、空腹血糖及胰島素水平[OGTT(0min)]高于 NDPN組(P<0.05),OGTT(120min)胰島素水平顯著低于 NDPN組(P<0.05)。見表2。
2.3 糖尿病周圍神經病變相關因素的Logistic回歸分析Logistic回歸分析提示:年齡、空腹血糖、胰島素水平、HOMA-IR、Matsuda指數與患者周圍神經病變的發生呈正相關(P<0.05),而OGTT(120min)胰島素水平與其呈負相關(P<0.05)。見表3。
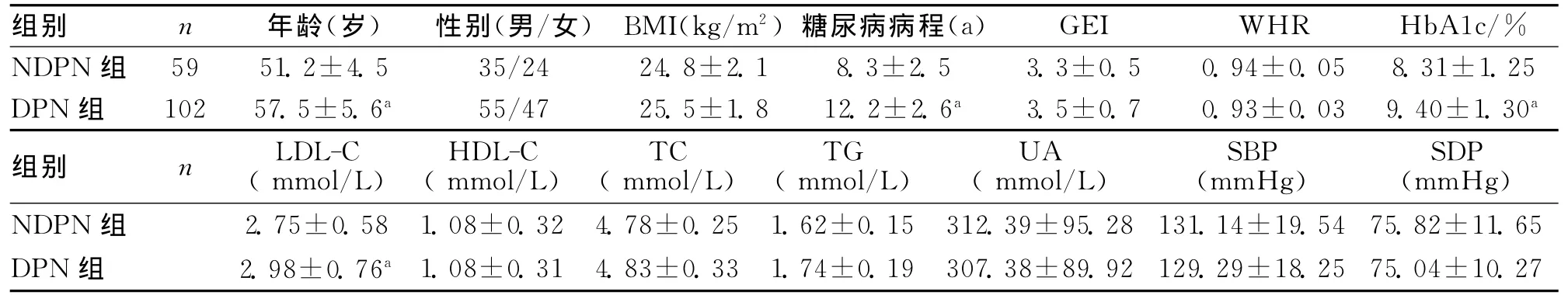
表1 2組一般資料比較 (ˉx±s)
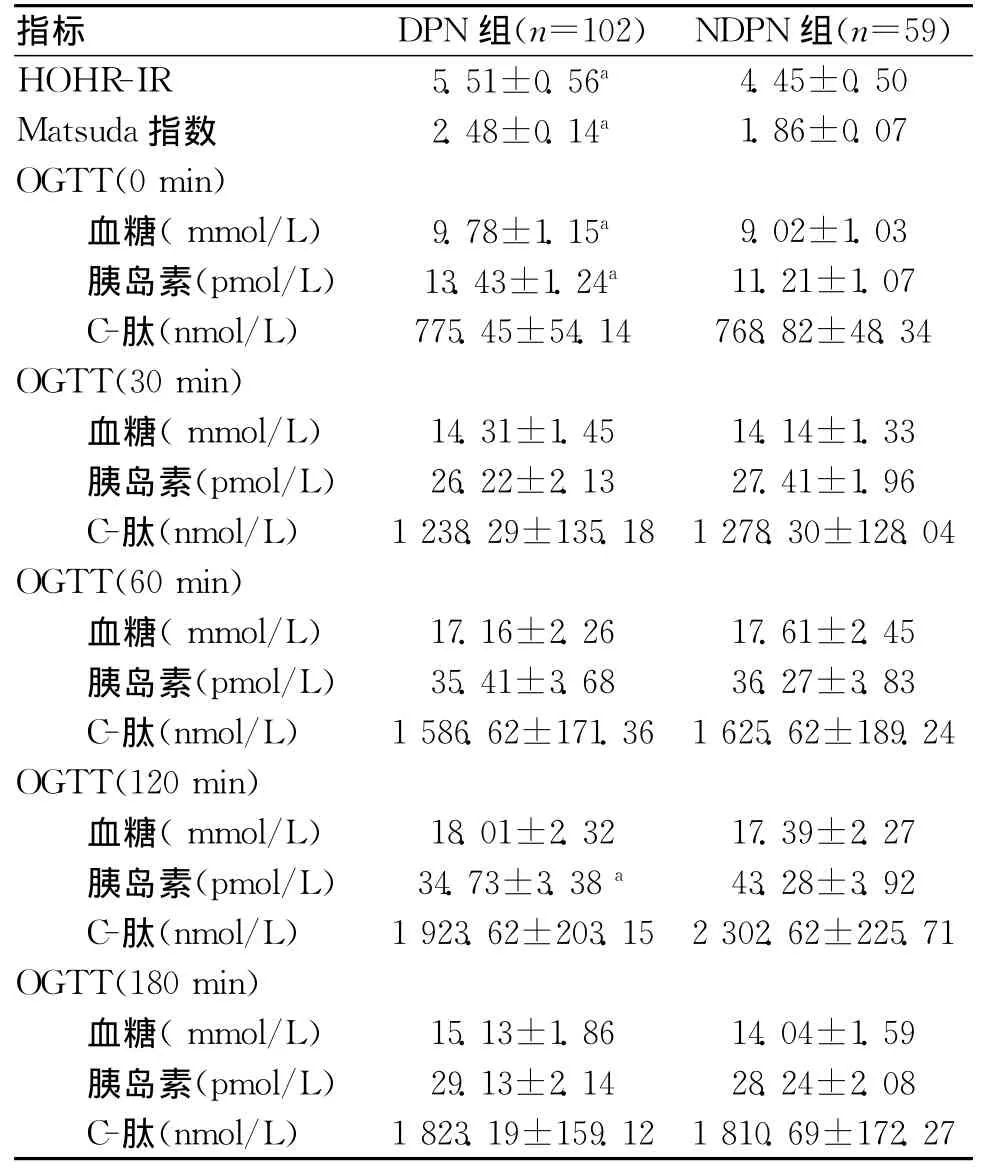
表2 2組OGTT結果比較 (ˉx±s)
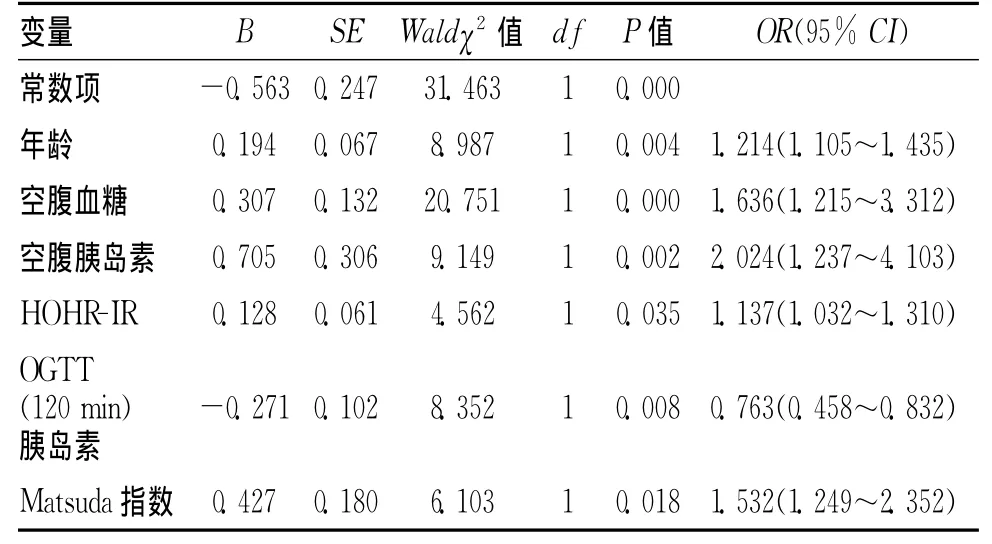
表3 糖尿病周圍神經病變相關因素的Logistic回歸分析
3 討論
DPN是T2DM患者最常見的微血管病變并發癥,目前國內外關于DPN發生率的報道有較大差異,上海華山醫院曾于1980年進行的大樣本流行病學調查顯示,T2DM患者中DPN發生率接近90%左右,而在2010年上海市的流行病學調查顯示發生率59.1%[3];周雁等[4]回顧性分析了1 069例年齡≥60歲的老年T2DM患者的臨床資料,發現高達81.7%的老年患者合并有DPN;本研究中161例T2DM患者中DPN發生率為63.4%(102/161),各調查研究中DPN發生率存在較大差異的原因可能與病例來源不同(社區、門診或住院部)以及病例年齡段、糖尿病病程、地域、診斷標準等因素造成。
本研究顯示,DPN組FBG、FIRI水平[OGTT(0min)]、HOMA-IR高于NDPN組,且Logistic回歸顯示,FBG、FIRI及HOMA-IR均為T2DM患者發生DPN的獨立預測因子,這與Lee等[5]報道基本一致。這些結果均提示T2DM患者的空腹胰島素抵抗程度能夠顯著影響周圍神經病變的發生。多年的研究已經證實,FBG與周圍神經病變存在緊密聯系,高水平FBG對周圍神經造成的損害已經不言而喻[6]。而高胰島素血癥(HIS)引起的胰島素抵抗(IR)能夠造成周圍血管舒張功能受損(由胰島素介導的內皮細胞依賴的舒張功能),導致患者周圍神經組織缺血缺氧進而形成神經損害;此外,HIS還能夠誘發周圍組織神經元細胞產生IR,可引起周圍神經組織對高血糖的敏感性增強,進而導致DPN發生[7]。因此,降低FBG及FIRI,改善HOMA-IR對于預防T2DM患者發生周圍神經病變至關重要,對于合并HIS引起的IR患者,建議臨床盡早行DPN篩查工作。
本研究顯示,DPN組OGTT(120min)胰島素水平低于NDPN組,Matsuda指數卻高于NDPN組,Logistic回歸顯示Matsuda指數與患者周圍神經病變的發生呈正相關(P<0.05),OGTT(120min)胰島素水平與其呈負相關(P<0.05),則提示患者餐后胰島素抵抗則可能對周圍神經病變的發生起到抑制作用。Matsuda指數可用來表示糖負荷后之后胰島素的敏感性,數值大小與外周組織如骨骼肌及脂肪組織的胰島素敏感性有關,該指數越低,則表示患者餐后胰島素抵抗程度越高[8],這與反映空腹胰島素抵抗程度且與肝臟胰島素敏感性有關的HOMA-IR相反。出現這種情況的主要機制不甚明確,可能的原因在于胰島素被證實能夠調節神經纖維的分化及生長,在理論上是一種神經營養因子,能夠起到對外周組織的神經元細胞起到營養支持作用[9]。Hoybergs等[10]報道顯示,在痛性糖尿病合并DPN的患者中,胰島素信號傳導或胰島素缺陷所導致的外周神經元營養障礙并非主要由高血糖引起。此外,Cusi等[11]在長期的胰島素治療中發現,雖然長期胰島素治療誘發的胰島素抵抗可能造成S6K、p70及Akt等相關基因表達減少,但卻不影響外周組織如脂肪組織及骨骼肌中的MAPK信號傳導。這些均提示外周胰島素可能主要發揮神經營養效應,因此,臨床在降低肝臟胰島素抵抗同時,可適時提升骨骼肌及脂肪組織的胰島素水平,對于防治T2DM患者DPN的發生具有重要的臨床價值。
綜上所述,2型糖尿病患者空腹胰島素抵抗與周圍神經病變的發生密切相關,而患者餐后胰島素抵抗則可能對周圍神經病變的發生起到抑制作用。
[1] Yang WY,Lu JM,Weng JP,et al.Prevalence of diabetes among men and women in China[J].N Engl J Med,2010,362(12):1 090-1 101.
[2] Kira B,Feldman EL.Insulin resistance in the nervous system[J].Trends Endocrinol Metab,2012,23(3):133-141.
[3] Lu B,Yang ZH,Wang M,et al.High prevalence of diabetic neuropathy in population-based patients diagnosed with type 2diabetes in the Shanghai downtown[J].Diabetes Res Clin Pract,2010,88(3):289-294.
[4] 周雁,郭立新,周璐 .老年2型糖尿病患者周圍神經病變的影響因素[J].山東大學學報(醫學版),2012,22(6):1-4.
[5] Lee KO,Nam JS,Ahn CW,et al.Insulin resistance is independently associated with peripheral and autonomic neuropathy in korean type 2diabetic patients[J].Acta Diabetol,2012,49(2):97-106.
[6] 姜濤,宋秀霞,張敏 .波動性高血糖對2型糖尿病患者周圍神經病變的影響[J].中國慢性病預防與控制,2010,11(1):54-56.
[7] Kim B,Mclean L'L,Philip SS,et al.Hyperinsulinemia induces insulin resistance in dorsal root ganglion neurons[J].Endocrinology,2011,152(10):3 638-3 647.
[8] Toth C,Brussee V,Martinez JA,et al.Rescue and regeneration of injured peripheral nerve axons by intrathecal insulin [J].Neuro-science,2009,139(2):429-449.
[9] Xu QG,Li XQ,Kotecha SA,et al.Insulin as an in vivo growth factor[J].Exp Neurol,2012,188(1):43-51.
[10] Hoybergs YM,Meert TF.The effect of low-dose insulin on mechanical sensitivity and allodynia in type 1diabetes neuropathy[J].Neurosci Lett,2010,417(2):149-154.
[11] Cusi K,Maezono K,Osman A,et al.Insulin resistance differentially affects the pi 3-kinase-and map kinase-mediated signaling in human muscle[J].J Clin Invest,2009,105(3):311-320.

