關(guān)于“化學(xué)反應(yīng)速率”的課堂設(shè)計(jì)與應(yīng)用反思
劉紅紅
摘 要: “化學(xué)反應(yīng)速率”是蘇教版化學(xué)2專題2第一單元的第一課時(shí),本文以學(xué)情和教材地位為依據(jù)進(jìn)行了課堂設(shè)計(jì),并針對(duì)此設(shè)計(jì)做了反思,以期對(duì)教學(xué)有所幫助。
關(guān)鍵詞: “化學(xué)反應(yīng)速率” 課堂設(shè)計(jì) 應(yīng)用反思
“化學(xué)反應(yīng)速率”包含化學(xué)反應(yīng)快慢的衡量和計(jì)算,也隱含化學(xué)反應(yīng)速率的影響因素,通過(guò)學(xué)生自己實(shí)驗(yàn)探究和教師引導(dǎo),有助于學(xué)生更透徹地理解知識(shí),提高知識(shí)應(yīng)用和遷移的能力。
在教案設(shè)計(jì)時(shí)應(yīng)注意實(shí)驗(yàn)設(shè)計(jì)的有效性和操作性,盡量簡(jiǎn)化實(shí)驗(yàn)操作,并對(duì)小組討論過(guò)程中學(xué)生認(rèn)知情況的變化有充分的預(yù)計(jì),既讓學(xué)生成為課堂的主角,又要掌握課堂的發(fā)展方向,恰當(dāng)?shù)匾龑?dǎo),將探索引向深入,培養(yǎng)學(xué)生的創(chuàng)造性思維。
提高學(xué)生分析、解決問(wèn)題能力的最好方法,就是在學(xué)生的實(shí)驗(yàn)探究過(guò)程中增強(qiáng)對(duì)實(shí)驗(yàn)結(jié)果的不確定性,將驗(yàn)證類實(shí)驗(yàn)與探究類實(shí)驗(yàn)相結(jié)合。
一、設(shè)計(jì)的基本依據(jù)
1.教材地位
學(xué)好“化學(xué)反應(yīng)速率”是學(xué)生更深入地認(rèn)識(shí)化學(xué)反應(yīng)的基礎(chǔ)。學(xué)生對(duì)化學(xué)反應(yīng)的快慢和反應(yīng)速率的影響因素的認(rèn)識(shí),是通過(guò)有限實(shí)驗(yàn)現(xiàn)象的觀察和生活體驗(yàn)感性地把握的。化學(xué)反應(yīng)速率內(nèi)容在高中必修模塊和選修模塊中均有安排,既有學(xué)習(xí)的階段性,又有必修、選修的層次性,本課時(shí)教學(xué)中要通過(guò)實(shí)驗(yàn),聯(lián)系已學(xué)知識(shí)幫助學(xué)生定性地認(rèn)識(shí)外界條件對(duì)化學(xué)反應(yīng)速率的影響,利用這一知識(shí)說(shuō)明生產(chǎn)生活中有關(guān)反應(yīng)速率的問(wèn)題,不要求從理論上說(shuō)明外界條件為什么會(huì)影響化學(xué)反應(yīng)速率,也不要求定量地分析、描述外界條件對(duì)化學(xué)反應(yīng)速率的影響[1]。
化學(xué)反應(yīng)速率的概念,影響化學(xué)反應(yīng)速率的因素是本節(jié)課的教學(xué)重點(diǎn),難點(diǎn)是化學(xué)反應(yīng)速率影響因素的探究總結(jié)。
2.學(xué)情
本節(jié)內(nèi)容是對(duì)前兩節(jié)內(nèi)容的拓展和完善,學(xué)生感性地了解影響化學(xué)反應(yīng)速率的因素相對(duì)比較容易,但要上升到理性高度則有一定的困難。通過(guò)學(xué)習(xí)可使學(xué)生對(duì)化學(xué)反應(yīng)特征的認(rèn)識(shí)更深入、更全面,在頭腦中建立一個(gè)有關(guān)化學(xué)反應(yīng)的完整而又合理的知識(shí)體系。
3.目標(biāo)
了解化學(xué)反應(yīng)速度的概念及表示方法,能進(jìn)行反應(yīng)速率簡(jiǎn)單的計(jì)算。知道反應(yīng)物本身性質(zhì)和外界因素(濃度、溫度、催化劑、壓強(qiáng)、接觸面積等)對(duì)化學(xué)反應(yīng)速度的影響,初步了解如何調(diào)控化學(xué)反應(yīng)的快慢。
通過(guò)實(shí)驗(yàn)不斷總結(jié)、發(fā)現(xiàn)、歸納知識(shí)的要點(diǎn),使自身的思維能力和創(chuàng)造能力都得到充分的鍛煉。
激發(fā)學(xué)生探究化學(xué)反應(yīng)的興趣,培養(yǎng)實(shí)驗(yàn)研究的嚴(yán)謹(jǐn)性;增強(qiáng)學(xué)生合作、創(chuàng)新與求實(shí)的精神。
二、設(shè)計(jì)過(guò)程
引入:觀看視頻(一輛行駛中的汽車)。
思考:汽車行駛速率的決定因素是什么?(汽車的性能,如發(fā)動(dòng)機(jī)功率)影響因素是什么?(天氣、路況、司機(jī)駕駛水平)
追問(wèn):那么一個(gè)化學(xué)反應(yīng)的快慢的決定因素是什么?影響因素是什么?(溫度、濃度、壓強(qiáng)、催化劑……)
討論:這么多可能影響因素,如何驗(yàn)證某一個(gè)因素是否影響化學(xué)反應(yīng)快慢呢?
引導(dǎo):控制單一變量法。在探究一個(gè)影響因素時(shí)要保證其他條件不變。
提示:一個(gè)正在進(jìn)行的化學(xué)反應(yīng),我們可以用什么來(lái)衡量它的快或慢呢?
結(jié)論:可以用氣泡產(chǎn)生的快慢、固體量減少或增加的快慢、顏色褪去或加深的快慢等現(xiàn)象判斷。
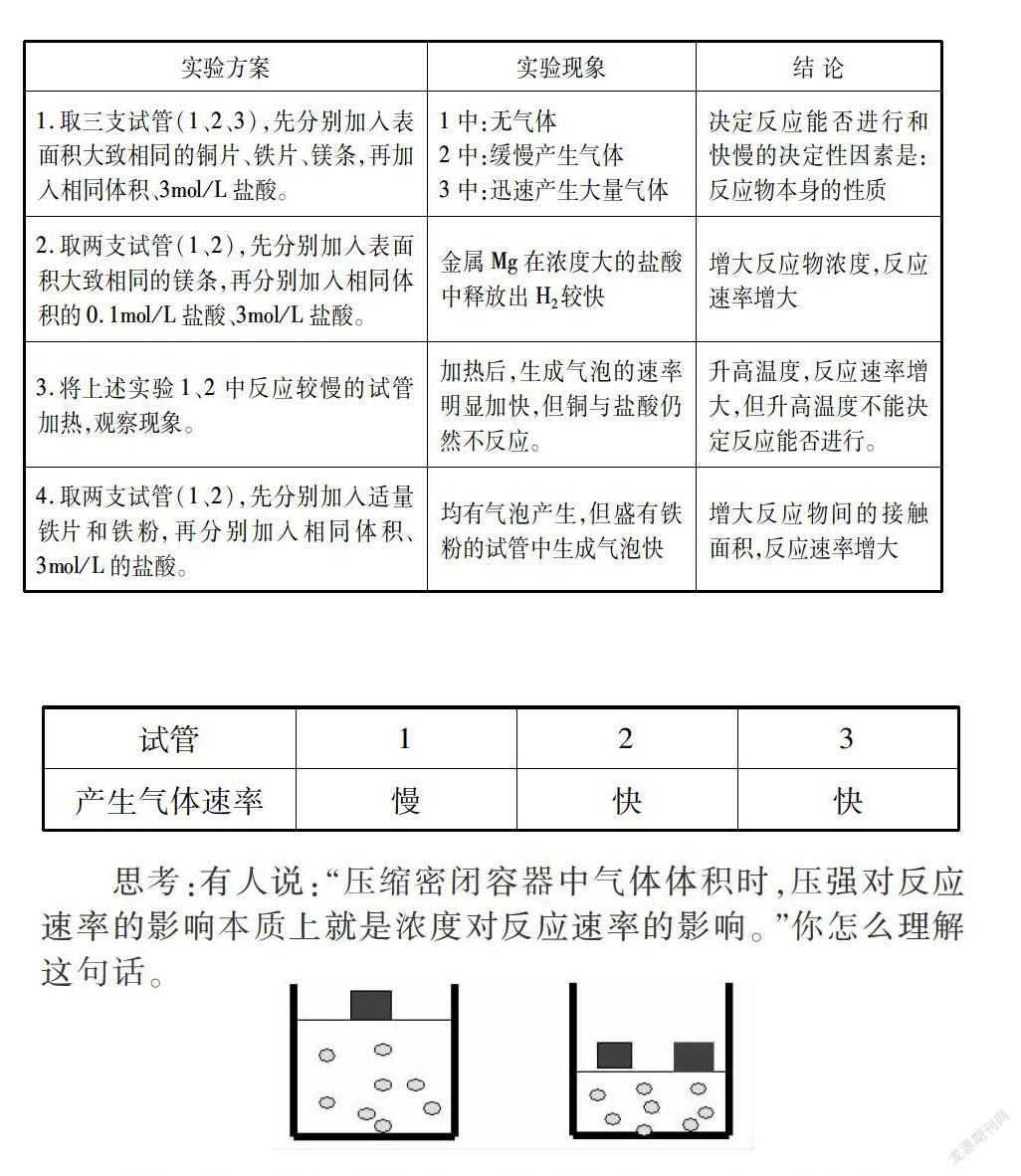
探究1:探究反應(yīng)物本身的性質(zhì)、反應(yīng)物濃度、接觸面積、溫度對(duì)反應(yīng)速率的影響。
試劑:銅片、鐵片、鎂條、鐵粉、鹽酸(0.1mol/L)、鹽酸(3mol/L)。
儀器:試管、藥匙、膠頭滴管、酒精燈、火柴、試管夾、砂紙、剪刀。
提示:①進(jìn)行實(shí)驗(yàn),仔細(xì)觀察,詳細(xì)記錄,小組討論,得出初步結(jié)論;②集體交流探究過(guò)程、結(jié)論,做出總結(jié);③活潑金屬與酸或水反應(yīng)的本質(zhì)是金屬與酸或水電離出的氫離子反應(yīng)。
探究2:探究反應(yīng)物本身的性質(zhì)、反應(yīng)物濃度對(duì)反應(yīng)速率的影響。
試劑:3%的H■O■溶液、二氧化錳粉末、FeCl■溶液。
儀器:試管、膠頭滴管。
操作:取3支試管(1、2、3),分別加入5mL 3%的H■O■溶液,試管2中再加少量的二氧化錳粉末,試管3中再加幾滴三氯化鐵溶液。
提示:二氧化錳、三氯化鐵可以做雙氧水分解的催化劑。
思考:有人說(shuō):“壓縮密閉容器中氣體體積時(shí),壓強(qiáng)對(duì)反應(yīng)速率的影響本質(zhì)上就是濃度對(duì)反應(yīng)速率的影響。”你怎么理解這句話。
概括:進(jìn)一步明確外因、內(nèi)因?qū)瘜W(xué)反應(yīng)速率的影響。
板書(shū)設(shè)計(jì):
影響化學(xué)反應(yīng)速率的因素:①內(nèi)因(決定性因素):反應(yīng)物本身的性質(zhì);②外因:(在其他條件相同的情況下):
濃度——濃度越大,反應(yīng)速率越大;
溫度——溫度越高,反應(yīng)速率越大;
接觸面積——接觸面積越大(顆粒越小),反應(yīng)速率越大;
催化劑——使用催化劑加快化學(xué)反應(yīng)速率;
壓強(qiáng)——(通過(guò)濃度影響)對(duì)有氣體參加的反應(yīng),壓強(qiáng)越大(濃度越大),反應(yīng)速率越大。
知識(shí)遷移:①夏天的食物為什么容易變質(zhì)?②高爐煉鐵時(shí)鐵礦石為什么要粉碎?③用硫酸和鋅粒(過(guò)量)制取氫氣時(shí),氣泡的產(chǎn)生為什么先較快后加快,最后再減慢?④加酶洗衣粉的去污能力為什么比普通洗衣粉強(qiáng)的多?
對(duì)于現(xiàn)象不明顯的反應(yīng),如HCl+NaOH=H■O+NaCl,我們?cè)撊绾蚊枋鏊磻?yīng)的快慢呢?
在物理上都會(huì)學(xué)到用單位時(shí)間內(nèi)物體通過(guò)的路程來(lái)表示物體運(yùn)動(dòng)的速度(V=△S/△t),化學(xué)反應(yīng)的速率也可以用單位時(shí)間內(nèi)某個(gè)量的改變表示(如△V、△n、△C、△m、△Q)。
化學(xué)上普遍采用單位時(shí)間內(nèi)生成物濃度的增加或反應(yīng)物濃度的減少表示化學(xué)反應(yīng)速率。
化學(xué)反應(yīng)速率:(1)表示方法:化學(xué)反應(yīng)速率用單位時(shí)間內(nèi)反應(yīng)物濃度的減小或生成物濃度的增加表示。同一反應(yīng)中,不同物質(zhì)的濃度改變可能不同,如物質(zhì)A的濃度的改變量,求出的就是用物質(zhì)A表示的反應(yīng)速率。(2)表達(dá)式:v(A)=△C(A)/△t。一段時(shí)間內(nèi)濃度的改變量除于一段時(shí)間,所以求出的是平均速率。(3)常用單位:mol/(L·S)、mol/(L·min)、mol/(L·h)
名題導(dǎo)思:(1)在2L密閉容器中,在一定條件下進(jìn)行合成氨的反應(yīng)3H■+N■?葑2NH■,先加入H■和N■各2mol,反應(yīng)經(jīng)2min鐘后,測(cè)得N■的物質(zhì)的量濃度0.8mol/L。求此反應(yīng)的化學(xué)反應(yīng)速率是多少?分別用H■、 N■、NH■ 的濃度變化表示。
(2)3H■+N■?葑2NH■,在4種不同條件下發(fā)生該反應(yīng),測(cè)得相同時(shí)間內(nèi)的化學(xué)反應(yīng)速率如下,則最快的是(?搖 ?搖)
A.v(H■)=0.1 mol/(L·min) B.v(N■)= 0.1 mol/(L·min)
C.v(N■)= 0.2 mol/(L·min) D.v(NH■)= 0.01 mol/(L·S)
總結(jié):在具體的運(yùn)用和理解化學(xué)反應(yīng)速率時(shí),還應(yīng)該注意下面幾個(gè)問(wèn)題:(1)化學(xué)反應(yīng)速率是標(biāo)量;(2)計(jì)算出的化學(xué)反應(yīng)速率是一段時(shí)間內(nèi)的平均反應(yīng)速率;(3)純液體和固體的“濃度”是個(gè)常數(shù),所以不用它們表示化學(xué)反應(yīng)速率;(4)同一化學(xué)反應(yīng)可用不同的的物質(zhì)表示其化學(xué)反應(yīng)速率,數(shù)值可能不相同,但意義相同。其化學(xué)反應(yīng)速率比等于化學(xué)計(jì)量數(shù)之比。
例如:N■+3H■?葑NH■中,V(N■):V(H■):V(NH■)?葑1:3:2
學(xué)好化學(xué)反應(yīng)速率的影響因素對(duì)我們的生活幫助非常大。在我們的生活中和工業(yè)上,有些反應(yīng)我們希望它進(jìn)行的盡量慢一些,而有些反應(yīng)我們則希望它快一點(diǎn),那么就可以通過(guò)調(diào)節(jié)影響速率的這幾個(gè)因素控制快慢。
三、應(yīng)用反思
1.改變教材中知識(shí)呈現(xiàn)的先后順序。先探究影響化學(xué)反應(yīng)速率的因素,再講解并展開(kāi)針對(duì)化學(xué)反應(yīng)速率的基本計(jì)算和練習(xí)。先定性再定量,有利于學(xué)生理解速率的表達(dá)方式。
2.依據(jù)“化學(xué)課程標(biāo)準(zhǔn)”活動(dòng)探究的建議,先通過(guò)學(xué)生此前所學(xué)過(guò)的知識(shí)和日常生活經(jīng)驗(yàn),設(shè)計(jì)對(duì)比探究實(shí)驗(yàn),讓學(xué)生了解“控制變量法”在化學(xué)實(shí)驗(yàn)研究中的應(yīng)用,探究外部因素的影響規(guī)律,然后引出化學(xué)反應(yīng)速率的定義及計(jì)算,閱讀課文分析概念的內(nèi)涵與外延,按由易到難的習(xí)題進(jìn)行鞏固。
3.更換課本中的實(shí)驗(yàn)。首先,增加銅與稀鹽酸的反應(yīng),與鐵、鎂和稀鹽酸的反應(yīng)做對(duì)比,幫助學(xué)生理解最主要的影響因素是物質(zhì)本身的性質(zhì)。課本中 “不同濃度的過(guò)氧化氫分解實(shí)驗(yàn)”的現(xiàn)象區(qū)別不明顯,改為現(xiàn)象更明顯的Mg與不同濃度稀鹽酸反應(yīng),增加“表面積大小對(duì)化學(xué)反應(yīng)速率的影響”的實(shí)驗(yàn)。
4.本節(jié)課注重分析和處理實(shí)驗(yàn)數(shù)據(jù)能力的培養(yǎng)。
參考文獻(xiàn):
[1]高中化學(xué)教學(xué)參考書(shū)化學(xué)2(必修).江蘇教育出版社.P28.

