中國小麥花葉病毒CP和CRP蛋白的原核表達、抗血清制備及RNA2侵染性克隆構建
孔凡惠 脫建波 魏嬌等


摘要:中國小麥花葉病毒(Chinese wheat mosaic virus,CWMV)引起的小麥土傳花葉病在山東煙臺、威海等地危害嚴重。本研究克隆了CWMV煙臺分離物的衣殼蛋白(Coat protein,CP)及富含半胱氨酸蛋白(Cysteine-rich protein,CRP)基因,并將其連接到原核表達載體pEHISTEV,轉化大腸桿菌Rosetta。經IPTG誘導,表達出分子量均為19 kD的CP和CRP。將二者從凝膠中切下,乳化后免疫新西蘭大耳兔4次,獲得了兩種蛋白的多克隆抗體。ELISA檢測表明,CWMV CP和 CRP抗血清的效價分別為1∶4096和1∶2048。Western blot分析證明該抗血清只與感染CWMV的小麥有特異性反應,而與健康或感染小麥黃花葉病毒的小麥無反應。利用含T3啟動子的引物通過RT-PCR擴增出CWMV RNA2全長片段,經T/A克隆連接到pMD18-T,獲得質粒pMD18-T-CWMV-RNA2。該質粒經Xba Ⅰ線性化后,利用T3 RNA聚合酶進行體外轉錄,轉錄產物摩擦接種本氏煙,15℃培養3天后,利用Western blot可從接種葉片中檢測到瞬時表達的CWMV CP蛋白。
關鍵詞:中國小麥花葉病毒;衣殼蛋白(CP);富含半胱氨酸蛋白(CRP);抗血清制備;侵染性克隆
中圖分類號:S188+S435.121.4 文獻標識號:A 文章編號:1001-4942(2015)08-0006-05
Abstract Chinese wheat mosaic virus (CWMV) is a furovirus transmitted by Polymyxa graminis and induces soil-borne wheat mosaic disease. It has caused severe damage to winter wheat production in Yantai and Weihai of Shandong Province. The coat protein (CP) and cysteine-rich protein (CRP) genes of CWMV Yantai isolate were amplified by RT-PCR and cloned to prokaryotic expression vector pEHISTEV. The resultant plasmids were transformed into the competent cells of E. coil Rosetta. After induced with IPTG, both plasmids expressed protein with molecular weight of 19 kD. The New Zealand rabbits were immunized four times with CP and CRP cut from SDS-PAGE respectively, and the polyclonal antibody of the two proteins were obtained. The titers of antisera against CWMV CP and CRP were 1∶4096 and 1∶2048, respectively. In the Western blot assay, the antisera showed specific positive reaction only with wheat plants infected by CWMV, but not with those infected by WYMV or healthy ones. The full-length RNA2 of CWMV was amplified via RT-PCR with primer containing T3 promoter, and was linked to pMD18-T to produce the plasmid of pMD18-T-CWMV-RNA2. This plasmid was linearized with Xba Ⅰ and used as template for in vitro transcription with T3 RNA polymerase. The in vitro transcription product was mechanically inoculated to Nicotiana benthamiana leaves, and a band specific for CWMV CP was detected from the inoculated N. benthamiana leaves after three days.
Key words Chinese wheat mosaic virus (CWMV); Coat protein (CP); Cysteine-rich protein (CRP); Antiserum preparation; Infectious clone
多粘菌傳播的病毒病是我國小麥上的重要病害,在我國部分地區發生嚴重[1]。目前在我國發生較重、由多粘菌傳播的小麥病毒主要有小麥黃花葉病毒(Wheat yellow mosaic virus,WYMV)和中國小麥花葉病毒(Chinese wheat mosaic virus,CWMV)[2],其中CWMV主要在山東威海和煙臺等地發生。CWMV屬于帚狀病毒科(Virgaviridae)真菌傳桿狀病毒屬(Furovirus)[3,4],寄主范圍較窄,自然條件下僅侵染小麥,通過摩擦可侵染莧色黎、昆諾黎和本氏煙等[5]。小麥土傳花葉病毒發生顯癥的適宜溫度為4~15℃,當氣溫上升至20℃及以上時,病害發展受到抑制,新葉出現隱癥,但下部老葉仍然有明顯的癥狀[6,7]。endprint
CWMV病毒粒子桿狀,基因組由兩條單鏈正義RNA組成,5′-端均具有帽子結構。RNA1全長為7 147 nt,含有3個開放閱讀框(Open reading frame,ORF),編碼兩個分子量分別為153 kD和212 kD的復制相關蛋白和移動蛋白(Movement protein,MP)。RNA2全長為3 569 nt,也含有3個ORF,分別編碼19 kD的衣殼蛋白(Coat protein,CP)、84 kD的衣殼蛋白通讀蛋白(Coat protein-readthrough,CP-RT)及19 kD的富含半胱氨酸蛋白(Cystein rich protein,CRP)[4,8,9]。
本研究利用原核表達的CP和CRP蛋白制備了抗血清,并獲得了RNA2的侵染性克隆。
1 材料與方法
1.1 材料
1.1.1 感病樣品 CWMV病樣采自山東煙臺自然發病的小麥植株,通過機械摩擦接種保存在本氏煙(Nicotiana benthamiana)上。
1.1.2 質粒與菌株 原核表達載體pEHISTEV由英國圣安德魯斯大學劉煥庭惠贈,大腸桿菌菌株DH5α和Rosetta由本實驗室保存。
1.1.3 酶及試劑 克隆載體pMD18-T、反轉錄酶、限制性內切酶、Taq DNA聚合酶、T4 DNA連接酶、dNTP、無RNase水均購自TaKaRa公司;DNA回收試劑盒、質粒小提試劑盒購自北京全式金公司;羊抗兔IgG購自Sigma公司;其他試劑為進口或國產分析純。
1.1.4 引物 根據本實驗室測定的CWMV序列設計引物(表1),由上海生工生物工程有限公司合成。
1.2 方法
1.2.1 基因擴增及原核表達載體構建 利用TransZol法提取感病小麥葉片總RNA,以引物CWMV-RNA2-R 進行反轉錄,利用引物CWMV-CP-F和CWMV-CP-R擴增CWMV CP基因,引物CWMV-CRP-F和CWMV-CRP-R擴增CWMV CRP基因。CP基因經1%瓊脂糖凝膠電泳分離,純化回收后用NcoⅠ和SalⅠ 雙酶切,與同樣酶切處理的pEHISTEV在4℃連接過夜。CRP基因經BamHⅠ和SalⅠ雙酶切,與同樣酶處理的pEHISTEV在4℃過夜連接。連接產物轉化DH5α。將PCR驗證和酶切鑒定的陽性克隆進行測序分析,確定所得克隆閱讀框正確。
1.2.2 蛋白的誘導表達和SDS-PAGE分析 將測序證明正確的陽性克隆轉化大腸桿菌Rosetta。挑取單菌落接種于3 mL含50 mg/L卡那霉素的液體LB培養基中,37℃培養過夜,次日按1∶100稀釋到20 mL含50 mg/L卡那霉素的LB培養基中,37℃、220 r/min培養,至OD600值達0.4~0.6,加入IPTG至終濃度0.2 mmol/L,于25℃、150 r/min繼續培養5 h。12 000 r/min離心10 min,收集菌體,加入適量pH 8.0 TE溶液,振蕩懸浮,再加入等體積的2×SDS上樣緩沖液,100℃煮沸5 min,-20℃冰浴5 min,12 000 r/min離心10 min后進行SDS-PAGE電泳。
1.2.3 特異性抗血清的制備及效價的測定 用SDS-PAGE對原核表達產物進行分離,經12%聚丙烯酰胺分離膠、5%聚丙烯胺濃縮膠電泳后,用冰的0.25 mol/L KCl和1 mmol/L DTT染色,切取乳白色的目的條帶,按1∶1(W/V)加入0.9%生理鹽水在預冷的研缽中研磨,依據梯度稀釋牛血清白蛋白為參照進行SDS-PAGE。采取皮下多點注射免疫新西蘭大耳兔,初次免疫用等體積的弗氏完全佐劑乳化,之后改用弗氏不完全佐劑,共免疫4次。第一次免疫劑量為1 mg,之后每隔一周進行加強免疫,免疫量為0.6 mg,從第3次開始每次免疫后7 d耳緣靜脈取血,效價達到要求后心臟取血,分離血清,-80℃保存備用。
利用ACP-ELISA法[10]測定所制備抗血清的效價:在液氮中充分研磨感病小麥樣品,分別按1∶10(W/V)的比例加入抗原包被緩沖液(0.05 mol/L碳酸鹽緩沖液,pH 9.6),并以此為抗原包被酶聯板,以按同樣方法處理的健康小麥葉片作為陰性對照。制備的抗血清按1∶25~1∶214進行梯度稀釋。顯色后用酶標儀讀取450 nm的OD值,I(待測樣品讀數-空白讀數)/H(陰性樣品的讀數-空白讀數)≥3為陽性反應。
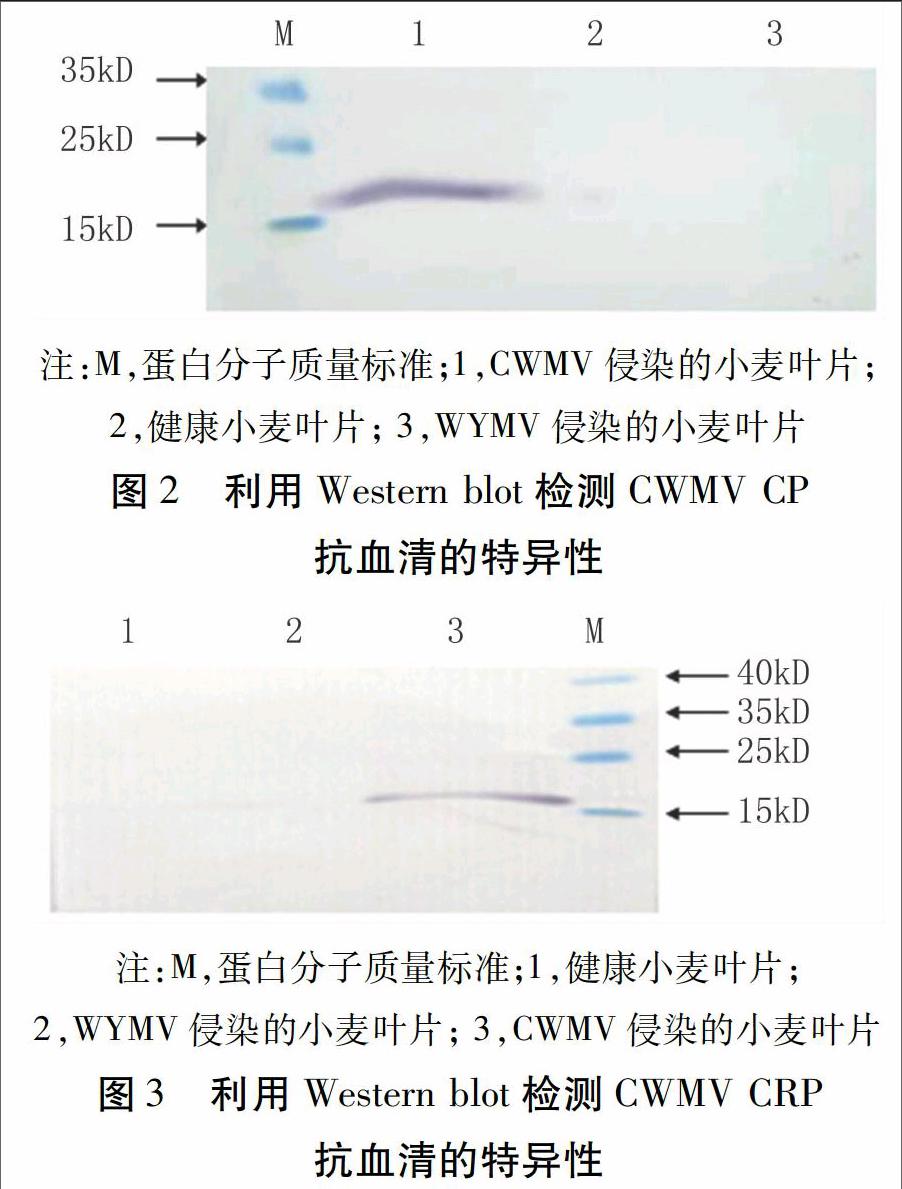
1.2.4 Western blot分析抗血清特異性 提取感染CWMV的小麥葉片蛋白,參照Towbin等[10]的方法,Western blot分析抗血清特異性。以煙臺地區CWMV侵染的小麥樣品為檢測樣品,健康小麥樣品及WYMV侵染的小麥樣品為陰性,樣品于SDS-PAGE電泳后電轉至NC膜上,于5%脫脂奶粉4℃封閉過夜后,對應加入適量所制備CWMV抗血清,經孵育、洗滌后,在堿性磷酸酯酶緩沖液中加入羊抗兔IgG(1∶5000稀釋),在NBT/BCIP顯色系統下顯色至條帶清晰,隨后用蒸餾水終止反應,觀察結果。
1.2.5 CWMV RNA2體外轉錄實驗 利用含T3啟動子的引物CWMV-RNA2-F與CWMV-RNA2-R一步擴增CWMV RNA2全長片段,經T/A克隆連接到pMD18-T,獲得質粒pMD18-T-CWMV-RNA2。重組質粒經XbaⅠ線性化后,直接作為體外轉錄模板,體外轉錄參考試劑盒方法進行,體系為:5×T3 buffer 10 μL,100 mmol/L DTT 5 μL,rUTP、rATP、rCTP(均為20 mmol/L)各1.25 μL,20 mmol/L rGTP 0.32 μL,5 mmol/L Cap analog 5 μL,RRI 0.5 μL,T3 polymerase 3 μL,線性化DNA 1 μg,加DEPC-H2O到總體積50 μL。37℃孵育1.5 h后,體外轉錄產物與等體積的GKP buffer混合后接種于提前置于15℃下處理的本氏煙上。接種后3天通過Western blot檢測其在本氏煙中的瞬時表達情況。endprint
2 結果與分析
2.1 CWMV CP基因及CRP基因克隆與序列分析
利用引物對CWMV-CP-F/CWMV-CP-R和CWMV-CRP-F/CWMV-CRP-R,從感病小麥葉片總RNA中擴增到530 bp的CP基因片段和521 bp的CRP基因片段。將PCR產物純化回收后,分別用NcoⅠ和SalⅠ、BamHⅠ和SalⅠ雙酶切,克隆到同樣酶切處理的pEHISTEV載體中,獲得重組質粒pEHISTEV-CWMV-CP和pEHISTEV-CWMV-CRP。通過PCR和測序證明其開放閱讀框正確。
2.2 CWMV CP與CRP的誘導表達和SDS-PAGE分析
將pEHISTEV-CWMV-CP和pEHISTEV-CWMV-CRP分別轉化大腸桿菌Rosetta,經1 mmol/mL IPTG誘導后進行SDS-PAGE電泳。結果表明,在20 kD附近出現特異性的目的蛋白條帶(圖1),與預期的CWMV CP與CRP大小一致,證明CWMV CP和CRP在大腸桿菌中得到了正確表達。
2.3 抗血清效價
從凝膠中切下CP和CRP對應的條帶,經乳化后免疫新西蘭大耳兔,獲得CWMV CP與CRP的抗血清。以感染CWMV的小麥葉片為抗原,健康小麥葉片為陰性對照,利用ACP-ELISA測定血清效價。結果表明,所得CWMV CP抗血清的效價為1∶4096,CWMV CRP抗血清的效價為1∶2048。
2.4 抗血清特異性檢測
利用Western blot分析所制備抗血清的特異性,結果顯示,所制備CWMV CP抗血清與CWMV侵染的小麥樣品發生特異性反應,而與健康小麥或感染WYMV的小麥均無反應(圖2)。所制備的CWMV CRP抗血清與CWMV侵染的小麥樣品發生特異性反應,產生約19 kD的目的條帶,而與健康小麥或感染WYMV的小麥樣品均無反應(圖3)。
2.5 CWMV RNA2體外轉錄實驗
利用CWMV-RNA2-F與CWMV-RNA2-R擴增CWMV RNA2全長片段,經T/A克隆連接到pMD18-T,獲得質粒pMD18-T-CWMV-RNA2。重組質粒經Xba Ⅰ 線性化后純化回收。以1 μg線性化產物為模板,用Promega公司的T3 RNA聚合酶進行體外轉錄。利用ScanDrop測定轉錄產物為13.6 μg/μL,使其與等體積的2×GKP緩沖液混合,選取4~5葉期本氏煙,將30 μL轉錄產物均勻摩擦接種于單個葉片上,取4~5片葉進行接種。接種后的植株置于15℃培養箱培養。3天后,取接種葉片,利用所制備CWMV CP血清進行Western blot檢測,結果表明,所獲得的CWMV RNA2體外轉錄物可在本氏煙中瞬時表達(圖4)。
3 結論與討論
在自然界中,CWMY和WYMV經常復合侵染,不易直接提取CWMV的病毒粒子。本研究利用大腸桿菌表達了CWMV CP和CRP,并制備了抗血清,所得抗血清的效價分別為1∶4096和1∶2048,只與CWMV侵染的小麥樣品反應,而與健康小麥和WYMV侵染的小麥樣品無反應,說明獲得血清效價高、特異性好,可用于Western blot及ELISA等對CWMV進行檢測。構建的CWMV RNA2克隆能表達出CP。
CRP是CWMV編碼的沉默抑制因子[9]。本研究制備的特異性抗血清為進一步研究該蛋白功能奠定了基礎。
2000年,Yamamiya等人成功構建了土傳小麥花葉病毒(Soil-brone wheat mosaic virus, SBWMV)的侵染性cDNA克隆[12],利用其體外轉錄物成功侵染了小麥及莧色黎。中國小麥花葉病毒和SBWMV同屬于真菌傳桿狀病毒屬,但其RNA1與RNA2核苷酸序列與SBWMV的同源性分別只有75%和63%[4]。本試驗中筆者成功獲得了CWMV RNA2的侵染性cDNA克隆,但還需在后期實驗中進一步獲得CWMV RNA1的侵染性克隆,以便利用反向遺傳學技術深入研究該病毒的致病機理。
參 考 文 獻:
[1] 中國農業科學院植物保護研究所. 中國農作物病蟲害[M]. 北京:中國農業出版社, 1995.
[2] Diao A, Chen J, Gitton F, et al. Sequence of European wheat mosaic virus and oat golden strip virus and genome analysis of the genus Furovirus [J]. Virology, 1999, 261(2): 331-339.
[3] Ye R, Zheng T, Chen J, et al. Characterization and partial sequence of a new furovirus of wheat in China [J]. Plant Pathol., 1999, 48: 379-387.
[4] Diao A, Chen J, Ye R, et al. Complete sequence and genome properties of Chinese wheat mosaic virus,a new furovirus of China [J]. J. Gen. Virol., 1999, 80: 1141-1145.
[5] 張巧艷,陳劍平. 中國小麥花葉病毒(CWMV)生物學特性初探[J].浙江農業學報, 2005, 17(3): 155-157.
[6] 王錫鋒,劉艷,韓成貴,等. 我國小麥病毒病害發生現狀與趨勢分析[J]. 植物保護, 2010, 36(3): 13-19.endprint
[7] Ohto Y, Naito S. Propagation of wheat yellow mosaic virus in winter wheat under low temperature conditions [J]. Ann. Phytopathol. Soc. Jap., 1997, 63(5): 361-365.
[8] Yang J, Chen J, Chen J, et al. Sequence of a second isolate of Chinese wheat mosaic furovirus[J]. J. Phytoathol., 2001, 149: 135-140.
[9] Sun L, Andika I B, Kondo H, et al. Identification of the amino acid residues and domains in the cysteine-rich protein of Chinese wheat mosaic virus that are important for RNA silencing suppression and subcellular localization [J]. Mol. Plant Pathol., 2013, 14(3): 265-278.
[10]Towbin H, Staehlin T, Gordon J. Electrophoretic transfer of proteins from polyacrylamide gels to nitrocellulose sheets: procedure and some application [J]. Proc. Natl. Acad. Sci. USA, 1979, 76(9): 4350-4354.
[11]田波. 植物病毒研究方法:上冊[M]. 北京:科學出版社,1987:247-249.
[12]Yamamiya A, Shirako Y. Construction of full-length cDNA clones to Soil-brone wheat mosaic virus RNA1 and RNA2, from which infectious RNAs are transcribed in vitro: virion formation and systemic without expression or the N-terminal and C-terminal extensions to the capsid protein [J]. Virology, 2000, 277(1): 66-75.endprint

