濱麥草與百薩偃麥草PHR1基因的克隆及序列分析
張雪瑩 李太強 王洪剛等

摘要:充分挖掘植物自身磷高效利用的生物學潛力,提高農作物對土壤難溶性磷的吸收和利用效率,對于培育磷高效利用的作物新品種、減少肥料投入和保護生態環境具有十分重要的意義。PHR1基因是植物磷信號調控網絡的重要低磷應答轉錄因子,本研究利用同源克隆的方法,分別從小麥近緣植物濱麥草和百薩偃麥草中克隆獲得了其PHR1基因序列。濱麥草LmPHR1和百薩偃麥草TbPHR1基因的ORF均為1 356 bp,編碼451個氨基酸;與已報道的小偃54A1、B1、D1的PHR1基因高度同源,一致性達到98.63%;對兩基因的氨基酸序列進行預測,結果表明它們均具有MYB-DNA結合結構域和一個預測的CC(Coiled coil)結構域;利用ClustalX軟件對已報道的水稻、小麥等PHR1基因進行聚類分析并構建系統進化樹,結果顯示,TbPHR1基因與二穗短柄草、水稻、玉米、擬南芥的PHR1基因在進化關系上更近一些,而LmPHR1基因與其他植物的PHR1基因進化關系較遠。
關鍵詞:濱麥草;百薩偃麥草;PHR1基因;同源克隆
中圖分類號:S512.9+S188 文獻標識號:A 文章編號:1001-4942(2015)08-0001-06
Abstract To fully explore the plant potential for high-efficiency phosphorus utilization and enhance the plant absorption and use efficiency of insoluble phosphorus in soil will play important roles in breeding new varieties, reducing fertilizer input and protecting agro-ecological environment. PHR1 is an important transcription factor of multiple Pi starvation responses in Pi signaling pathways. By homologous cloning, two PHR1 genes were cloned from Elymus mollis and Thinopyrum bessarabicum, which were named as LmPHR1 and TbPHR1. Their ORFs were both 1 356 bp, and both of them encoded 451 amino acids; their cDNA sequences shared 98.63% identity with the cDNA sequences of Xiaoyan 54 PHR1-A1, PHR1-B1, PHR1-D1. Their encoded proteins both had a MYB DNA binding domain and a predicted coiled-coil domain. Using the ClustalX for phylogenetic analysis of the two PHR1 genes with the reported PHR1 genes in rice and wheat, ect. The results showed that PHR1 had closer evolutionary relationship with the PHR1s from Brachypodium distachyon, Oryza sativa, Zea mays and Arabidopsis thaliana; while the LmPHR1 had more faraway evolutionary relationship with other plants PHR1 genes.
Key words Leymus mollis; Thinopyrum bessarabicum; PHR1 gene; Homologous clone
磷是植物生長發育所必需的營養元素之一,然而由于被土壤固定成為植物難以利用的形式(如有機磷、磷酸鋁、磷酸鐵等)或隨水流失,磷肥的利用率很低,導致土壤磷的“遺傳學缺乏”,即土壤中總磷含量高,但能被植物吸收利用的磷(有效磷)卻很低[1~3]。
磷缺乏是影響植物生長的一個主要營養脅迫。植物已進化出一系列復雜的代謝途徑來適應環境長期的磷元素營養缺乏,主要通過誘發形態學的變化、生理生化過程的變化以及與菌類共生等,這些統稱為低磷脅迫應答反應。這些應答反應涉及數百個磷脅迫可誘導基因的協同作用,它們可以調整植物體內磷利用的優先順序,同時提高體外對磷的吸收[4]。最近幾年通過對擬南芥和水稻兩種模式植物的低磷芯片數據分析發現,植物對低磷反應的適應性調控機制主要發生在轉錄水平上,目前已經分離鑒定到了多個參與低磷反應的關鍵轉錄因子,包括:PHR1、WRKY75、ZAT6、MYB62、PTF1、bHLH32。PHR1屬于MYB類轉錄因子,是第一個鑒定到的參與擬南芥低磷反應的轉錄因子,它以二聚體的形式結合在磷響應基因的啟動子區P1BS序列,調控下游基因的表達[5~7];最新研究表明,PHR1基因在磷脅迫光合作用調控中也起重要作用,并在磷脅迫時參與調控脂質重塑和三酰甘油積累[8,9]。目前已從多種植物中克隆到了PHR1基因,如擬南芥[5]、水稻[10]、小麥[11]、玉米[12]、歐洲油菜[13]等。
濱麥草(Leymus mollis,2n=28,JJNN)和百薩偃麥草(Thinopyrum bessarabicum,2n=14,JJ)是小麥重要的野生近緣植物,濱麥草屬植物主要集中于環境條件惡劣地區,因此保留了野生植物的抗性、耐逆等優良基因,具有耐鹽堿、耐旱、耐瘠薄等優良耐力以及抗葉銹病、條銹病、稈銹病、白粉病、赤霉病、蚜蟲等優良抗性[14]。百薩偃麥草為自花授粉的多年生海岸禾草,原產于黑海和地中海沿岸,是偃麥草屬中基因組最簡單的二倍體物種,對環境脅迫和生物脅迫具有很強的抗性,是小麥遺傳改良的重要資源,研究人員已利用遠緣雜交等手段將其部分優良特性基因轉入小麥[15]。然而,現有研究主要集中在抗病基因的挖掘上,對于抗逆境耐瘠薄等基因的研究很少。endprint
本研究以濱麥草和百薩偃麥草為材料,克隆其PHR1基因并進行序列和遺傳進化分析,為今后小麥磷高效新品種的培育及遺傳改良提供優良的基因資源。
1 材料與方法
1.1 試驗材料
本試驗所用材料為濱麥草(Leymus mollis)與百薩偃麥草(Thinopyrum bessarabicum),濱麥草引自西北農林科技大學,百薩偃麥草引自南京農業大學,均種植于山東農業大學農學院溫室。
1.2 試驗方法
1.2.1 RNA提取及cDNA第一鏈的合成 取濱麥草與百薩偃麥草幼葉,利用RNAsimple Total RNA Kit(天根公司)提取植物總RNA,提取步驟按試劑盒說明書進行。cDNA第一鏈合成用TransScript First-Strand cDNA Synthesis SuperMix(全式金公司),步驟按試劑盒說明書進行。
1.2.2 基因克隆 以cDNA第一鏈為模板擴增目的基因,所用引物為F(5′-ATGAGGARGTKTGATCTGAGRC-3′)、R(5′-TTAACTATCATGCASYCTWCG-3′)。PCR反應體系為15 μL,依次加入反轉錄產物2 μL,LA Taq 0.2 μL,Buffer I 7.5 μL,2.5 mmol/L dNTP 2.4 μL,正向引物(10 mmol/L)1 μL,反向引物(10 mmol/L)1 μL,最后加水至15 μL。PCR反應條件:95℃預變性5 min;94℃變性40 s,50℃退火30 s,72℃延伸2 min,35個循環;最后72℃延伸10 min,4℃保存。PCR產物經瓊脂糖凝膠電泳后,切膠回收。將回收片段連pEASY-T1載體(全式金公司),轉化大腸桿菌DH5α感受態細胞。取陽性克隆送上海桑尼公司測序。
1.2.3 序列比對與系統進化樹分析 將序列通過NCBI數據庫(http://www.ncbi.nlm.nih.gov/)進行Blast比對,下載其他物種的PHR1基因序列及蛋白序列。利用DNAMAN軟件,對PHR1的cDNA序列及蛋白序列進行同源比對分析,并構建系統進化樹,采用默認參數設置。
2 結果與分析
2.1 LmPHR1和TbPHR1基因的克隆及序列分析
以濱麥草和百薩偃麥草cDNA為模板,利用兼并引物進行PCR擴增,獲得了各自的PHR1基因全長,分別命名為LmPHR1和TbPHR1。兩基因的開放閱讀框(Open reading frame,ORF)均為1 356 bp,編碼451個氨基酸。起始密碼子為ATG,終止密碼子為TTA。LmPHR1和TbPHR1與報道的小偃54A1、B1、D1的PHR1基因序列一致性均為98.63%(見圖1)。
2.2 同源性分析
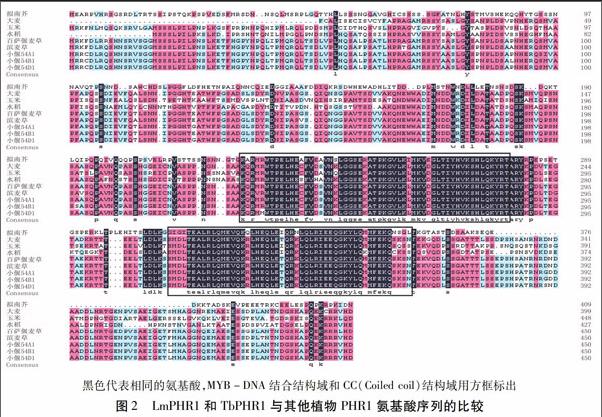
利用DNAMAN軟件對推導的LmPHR1和TbPHR1氨基酸序列與擬南芥、大麥、玉米、水稻、小麥的PHR1氨基酸序列進行同源性分析,結果(圖2)顯示,氨基酸序列比對一致性為79.88%,LmPHR1和TbPHR1與小偃54和大麥的PHR1氨基酸序列同源性較高,而與水稻、玉米、擬南芥的氨基酸同源性較低;保守結構域及特征序列的同源性相對較高一些,均存在MYB-like DNA-binding結構域和MYB-CC-LHEQLE轉錄激活域,其中DNA-binding結構域由55個氨基酸組成,在不同的植物中非常保守。
2.3 LmPHR1和TbPHR1基因的系統進化分析
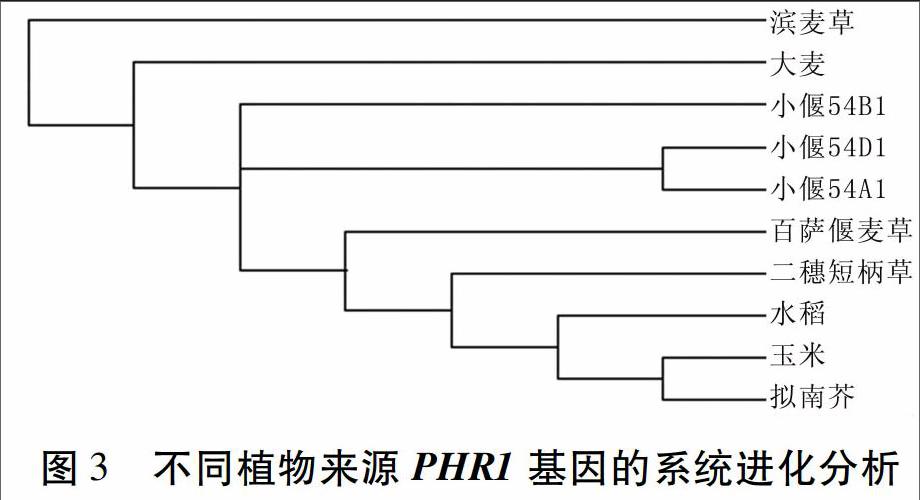
為進一步了解LmPHR1和TbPHR1與其他植物PHR1之間的進化關系,在多重比對的基礎上,用上述9個PHR1基因序列與二穗短柄草的PHR1基因序列構建系統進化樹,結果(圖3)顯示,TbPHR1與二穗短柄草和小偃54的PHR1基因的進化關系更近一些,而LmPHR1與其他植物的PHR1基因進化關系較遠。
3 結論
PHR1被認為是植物磷脅迫基因調控網絡中的核心調控因子,其表達水平基本不受外界磷濃度的影響,但控制著一部分低磷反應,如花青素的積累以及部分IPS基因的表達。本研究成功克隆了濱麥草與百薩偃麥草的PHR1基因的全長,并對其進行了序列比較和遺傳進化分析。結果顯示,LmPHR1和TbPHR1均與小偃54的PHR1基因序列和氨基酸序列高度同源,與已報道的大麥PHR1氨基酸序列一致性也較高,兩個結構域的基因序列高度保守;在進化關系上,TbPHR1與二穗短柄草和小偃54進化關系更近一些,而LmPHR1與其他植物的PHR1進化關系較遠。該試驗結果為進一步研究LmPHR1和TbPHR1的功能及磷脅迫響應機制奠定了基礎,也為小麥磷高效新品種的培育及利用基因工程手段改良小麥提供了優良的基因資源。
參 考 文 獻:
[1] 林海建,張志明,高世斌,等.玉米耐低磷研究現狀及磷高效育種策略的探討[J].中國農學通報, 2008, 24(1): 181-185.
[2] Tilman D. Global environmental impacts of agricultural expansion: the need for sustainable and efficient practices[J].Proceeding of the National Academy of Sciences of the United States of America, 1999, 96(11): 5995-6000.
[3] 魯如坤,史陶鈞.土壤磷素在利用過程中的消耗和積累[J].土壤通報, 1980(5): 6-8.
[4] Yuan H, Liu D. Signaling components involved in plant responses to phosphate starvation[J]. Journal of Integrative Plant Biology, 2008, 50(7): 849-859.endprint
[5] Rubio V, Linhares F, Solano R, et al. A conserved MYB transcription factor involved in phosphate starvation signaling both in vascular plants and in unicellular algae[J]. Genes & Development, 2001, 15(16): 2122-2133.
[6] Wykoff D D, Grossman A R, Weeks D P, et al. Psr1, a nuclear localized protein that regulates phosphorus metabolism in Chlamydomonas[J].Proceeding of the National Academy of Sciences of the United States of America, 1999, 96 (26): 15336-15341.
[7] Nilsson L, Müller R, Nielsen T H. Increased expression of the MYB-related transcription factor, PHR1, leads to enhanced phosphate uptake in Arabidopsis thaliana[J]. Plant, Cell & Environment, 2007, 30(12): 1499-1512.
[8] Nilsson L. The MYB-related transcription factor PHR1plays a central role in adjusting photosynthesis during phosphate starvation[D]. Copenhagen:University of Copenhagen, 2014.
[9] Pant B D, Burgos A, Pant P, et al. The transcription factor PHR1 regulates lipid remodeling and triacylglycerol accumulation in Arabidopsis thaliana during phosphorus starvation[J]. Journal of Experimental Botany, 2015: eru535.
[10]焦芳嬋. 水稻低磷脅迫相關轉錄因子OsPHR1和OsPHR2的研究[D]. 杭州:浙江大學, 2005.
[11]Wang J, Sun J H, Miao J, et al. A wheat phosphate starvation response regulator Ta-PHR1 is involved in phosphate signaling and increases grain yield in wheat[J]. Annals of Botany, 2013, 111:1139-1153.
[12]王秀紅. 玉米低磷應答轉錄因子ZmPHR1的克隆及功能分析[D]. 太原:山西大學, 2013.
[13]Ren F, Guo Q Q, Chang L L, et al. Brassica napus PHR1 gene encoding a MYB-like protein functions in response to phosphate starvation[J]. PLoS ONE, 2012, 7(8): e44005.
[14]何方. 小麥—濱麥草中間材料的創制及鑒定[D]. 泰安:山東農業大學, 2008.
[15]溫輝芹, 裴自友, 任永康. 簡單重復序列 (AAG)5 在百薩偃麥草染色體上的分布[J]. 山西農業科學, 2011, 39(6): 505-507.endprint

